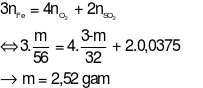Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 13)
-
7186 lượt thi
-
30 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Nhận định C không đúng do trong hợp chất flo chỉ có số oxi hóa là -1.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Vì dung dịch HCl là dung dịch axit nên làm quỳ tím hoá đỏ.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- HCl đóng vai trò là chất oxi hóa khi phản ứng với chất khử (Fe).
Hoặc có thể giải thích như sau:
- Trong phản ứng: Fe + 2HCl → FeCl2+ H2↑ số oxi hóa của H giảm từ +1 xuống 0 nên HCl đóng vai trò là chất oxi hóa.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
- Các nguyên tố nhóm Halogen là: Flo (F), Clo (Cl), Brom (Br), Iot (I).
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Thuốc thử để nhận biết ion sunfat (SO42 –) là dung dịch muối bari hoặc dung dịch Ba(OH)2.
Ba2++ SO42-→ BaSO4(↓ trắng)
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Chất được dùng để làm khô khí clo ẩm là dung dịch H2SO4đặc. Vì Cl2và H2SO4đặc đều là những chất oxi hóa mạnh nên không phản ứng với nhau. Ngoài ra, H2SO4đặc hút nước mạnh.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
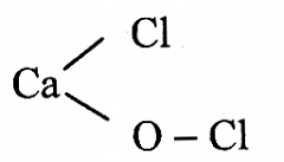
Clorua vôi là muối hỗn tạp, do tạo bởi một kim loại (Ca) liên kết với hai loại gốc axit (Cl-và ClO-).
Câu 8:
Nguyên tử S đóng vai trò vừa là chất khử, vừa là chất oxi hoá trong phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Xác định số oxi hoá của S trong từng phản ứng.
Dễ thấy đáp án B và D, S từ 0 lên +6 ⇒ Thể hiện tính khử.
Đáp án C, S từ 0 xuống – 2 ⇒Thể hiện tính oxi hoá.
Đáp án A, S từ 0 lên +2 và từ 0 xuống – 2 ⇒ S vừa là chất khử, vừa là chất oxi hoá.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Ozon không được ứng dụng để điều chế oxi trong phòng thí nghiệm.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Loại A và D do clo, brom tác dụng được với nước nhưng không oxi hóa được nước.
Loại B do iot không oxi hóa được nước.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Đáp án A sai vì tính axit của HF yếu hơntính axit của HCl.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Điện phân nước là phương pháp dùng để điều chế oxi trong công nghiệp.
Câu 13:
Phản ứng được dùng để sản xuất SO2trong công nghiệp là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Trong công nghiệp, SO2được sản xuất bằng cách đốt S hoặc quặng pirit sắt:
4FeS2+ 11O2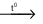 8SO2+ 2Fe2O3
8SO2+ 2Fe2O3
S + O2 SO2
SO2
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Trường hợp không xảy ra phản ứng là: Sục khí H2S vào dung dịch FeCl2vì FeS tan trong HCl nên không thỏa mãn điều kiện xảy ra phản ứng.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
NaF + AgNO3→ không tác dụng (chọn D)
NaCl + AgNO3→ AgCl↓ + NaNO3(loại B)
NaBr + AgNO3→ AgBr↓+ NaNO3 (loại A)
NaI + AgNO3→ AgI↓+ NaNO3 (loại C)
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là:
- Khí SO2được dùng làm chất tẩy màu, tan trong nước tạo thành dung dịch có môi trường axit → làm màu quỳ tím chuyển sang đỏ.
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là:
- Tính chất hóa học đặc trưng của oxi là tính oxi hóa mạnh.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi sục SO2vào dung dịch H2S thì xảy ra phản ứng:
SO2+ 2H2S → 3S↓ + 2H2O
Vậy hiện tượng là dung dịch bị vẩn đục màu vàng (S).
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- Tính axit của axit halogenhidric: HF < HCl < HBr < HI
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
- HF (axit flohiđric) là axit yếu nhưng có tính chất đặc biệt là ăn mòn các đồ vật bằng thuỷ tinh. Vì vậy, axit HF không thể chứa trong bình thủy tinh.
4HF + SiO2 SiF4+ 2H2O
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
- Al bị thụ động hoá bởi dung dịch H2SO4đặc, nguội, nên cần thiết phải là H2SO4đặc, nóng.
6H2SO4(đặc)+ 2Al  Al2(SO4)3+ 6H2O + 3SO2↑
Al2(SO4)3+ 6H2O + 3SO2↑
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Dung dịch axit clohiđric đặc tác dụng với MnO2(cần đun nóng) tạo ra khí clo.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D

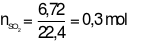
Xét 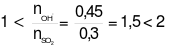
→ Sản phẩm gồm 2 muối: Na2SO3(x mol), NaHSO3(y mol)
Ta có hệ phương trình:
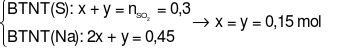
mmuối=  = 0,15.126 + 0,15.104 = 34,5 gam
= 0,15.126 + 0,15.104 = 34,5 gam
Câu 24:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
- Dễ thấy các kim loại trên khi tác dụng với dung dịch HCl dư đều cho muối hoá trị II.
Gọi chung hỗn hợp kim loại là M ta có:
M + 2HCl → MCl2+ H2
Theo phương trình ta có: nHCl= 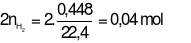
Áp dụng định luật bảo toàn khối lượng ta có:
mchất rắn = mkim loại + mHCl –  = 1,53 + 0,04.36,5 – 0,02.2 = 2,95 gam.
= 1,53 + 0,04.36,5 – 0,02.2 = 2,95 gam.
Câu 25:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Ta có:
HClO3+ 5HCl → 3Cl2↑ + 3H2O (1)
13(mol)
MnO2+ 4HCl → MnCl2+ Cl2+ 2H2O (2)
1 1 (mol)
CaOCl2+ 2HCl → CaCl2+ Cl2+ H2O (3)
1 1 (mol)
2KMnO4+ 16HCl → 2KCl + 2MnCl2+ 5Cl2+ 8H2O (4)
1 2,5 (mol)
Từ 4 PTHH trên nhận thấy nếu cho 1 mol mỗi chất: CaOCl2, KMnO4, HClO3, MnO2lần lượt phản ứng với lượng dư dung dịch HCl đặc, chất tạo ra lượng khí Cl2nhiều nhất là HClO3.
Câu 26:
Cho cân bằng hóa học sau: 2SO2(k) + O2(k) ⇄ 2SO3(k) ; ∆H < 0 và các biện pháp: (1) tăng nhiệt độ, (2) tăng áp suất chung của hệ phản ứng, (3) hạ nhiệt độ, (4) dùng thêm chất xúc tác V2</>O5, (5) giảm nồng độ SO3, (6) giảm áp suất chung của hệ phản ứng. Những biện pháp làm cân bằng trên chuyển dịch theo chiều thuận là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Loại (1) do: Tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch (do phản ứng tỏa nhiệt).
Loại (4) do: Chất xúc tác khônglàm chuyển dịch cân bằng hóa học.
Loại (6) do: Giảm áp suất chung của hệ phản ứng cân bằng chuyển dịch theo chiều nghịch.
Câu 27:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cho hỗn hợp X tác dụng với BaCl2:
H2SO4+ BaCl2→ BaSO4↓ + 2HCl (1)
0,1 mol←0,1 → 0,2mol
Ta có:

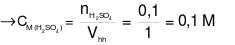
Trong dung dịch Y: 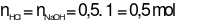
⇒ nHCl (X)= nHCl (Y)– nHCl (1) = 0,3 mol
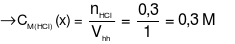
Câu 28:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
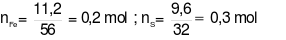
Fe + S  FeS
FeS
0,20,2
FeS + 2HCl → FeCl2+ H2S↑
0,2 0,2
H2S + Pb(NO3)2→ PbS↓ + 2HNO2
0,20,2
mPbS= 0,2.239 = 47,8 gam
Câu 29:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
nX= 0,7 mol
Gọi 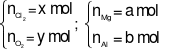
Bảo toàn khối lượng ta có:
mX = mZ– mY= 60,2 – 22,2 = 38 gam
Theo bài ra ta có hệ phương trình:

Áp dụng định luật bảo toàn electron ta có:
2a + 3b = 2x + 4y ⇒2a + 3b = 2.0,4 + 4.0,3 (1)
mY= 24a + 27b = 22,2 (2)
Từ (1) và (2) ta có hệ phương trình:
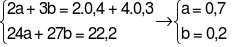
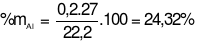
Câu 30:
Nung m gam bột sắt trong oxi, thu được 3 gam hỗn hợp chất rắn X. Hoà tan hết X vào H2SO4đặc, nóng, dư thoát ra 0,84 lít khí SO2(là sản phẩm khử duy nhất, đo ở đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Quy đổi hỗn hợp chất rắn X chỉ có Fe và O2.
Gọi 
Theo bài ra ta có phương trình: mX= 56x + 32y = 3 gam (1)
Hoà tan hết chất rắn X vào H2SO4đặc, nóng, dư thu được SO2.
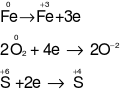
Ta có: 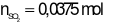
Áp dụng định luật bảo toàn electron ta có: 3x = 4y + 2.0,0375 (2)
Từ (1) và (2) ta có hệ phương trình: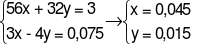
m = 0,045.56 = 2,52 gam
Cách 2:
Quy đổi hỗn hợp chất rắn X chỉ có Fe và O2.
Ta có: Fe + O2 3 gam hh X
3 gam hh X
BTKL ta có: moxi= 3 – m
X + H2SO4đặc, nóng → 0,0375 mol SO2
Áp dụng định luật bảo toàn electron ta có: