Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (Đề 10)
-
7182 lượt thi
-
24 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các số oxi hóa thường gặp của S là: -2 (![]() ); 0 (
); 0 (![]() ); +4 (
); +4 (![]() );
);
+6 (![]() ).
).
Trong hợp chất SO2, nguyên tố S có số oxi hóa +4, là số oxi hóa trung gian. Do đó, SO2vừa có tính oxi hóa, vừa có tính khử.
Loại A vì đơn chất O3có số oxi hóa 0, chỉ có thể giảm xuống số oxi hóa -2 (trong hợp chất). Do đó, O3chỉ có tính oxi hóa.
Loại B vì: H2SO4chỉ có tính oxi hóa.
Loại C vì: SO3chỉ có tính oxi hóa.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Phân biệt dung dịch: Na2SO4; NaCl.
Dùng dung dịch BaCl2: thấy xuất hiện kết tủa trắng là Na2SO4.
Phương trình hóa học: BaCl2+ Na2SO4BaSO4+ 2NaCl.
Không có hiện tượng gì là NaCl.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm VIA là ns2np4.
Câu 4:
Thể tích khí SO2 (đktc) thu được sau phản ứng khi cho 4,8 gam Cu tác dụng với H2SO4đặc nóng dư là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Bảo toàn electron:
2![]() = 2nCu
= 2nCu![]() = nCu= 0,075 (mol).
= nCu= 0,075 (mol).
![]() = 0,075×22,4 = 1,68 (lít).
= 0,075×22,4 = 1,68 (lít).
Câu 5:
Các số oxi hóa của lưu huỳnh thường gặp là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Các số oxi hóa thường gặp của S là: -2 (![]() ); 0 (
); 0 (![]() ); +4 (
); +4 (![]() ); +6 (
); +6 (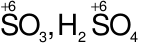 ).
).
Câu 6:
Cho m gam nhôm vào dung dịch H2SO4loãng, dư thu được 3,36 lít khí hiđro (đktc). Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
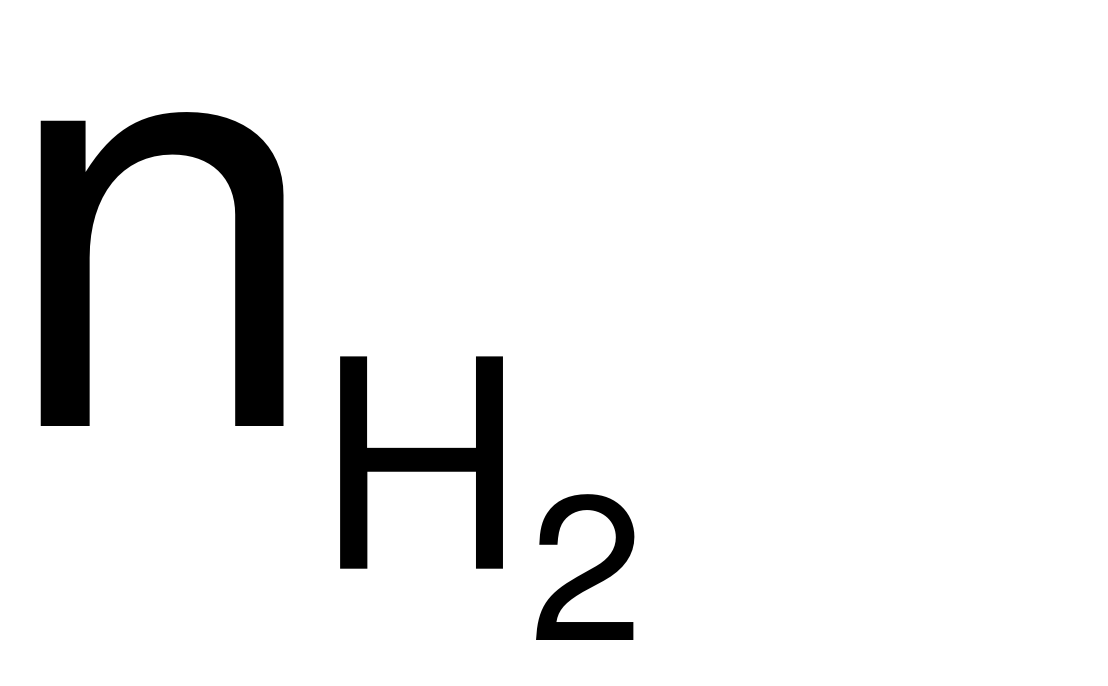 = 0,15 (mol).
= 0,15 (mol).
Bảo toàn electron:
3nAl= 2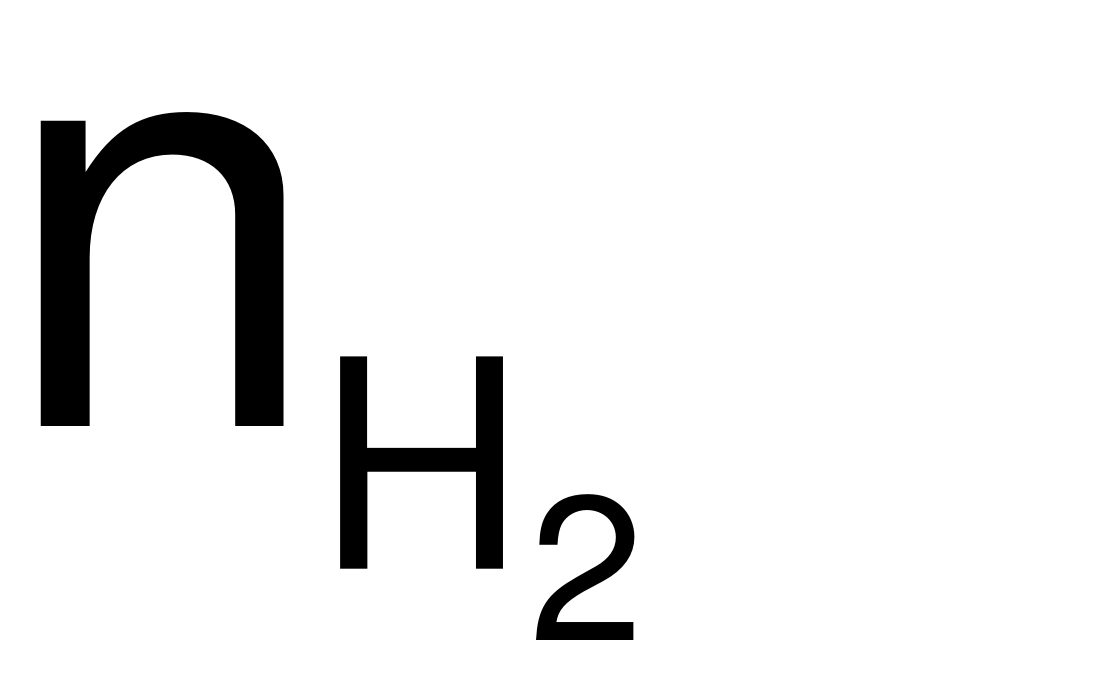 nAl=
nAl= ![]() (mol).
(mol).
mAl= 0,1×27 = 2,7 (gam).
Câu 7:
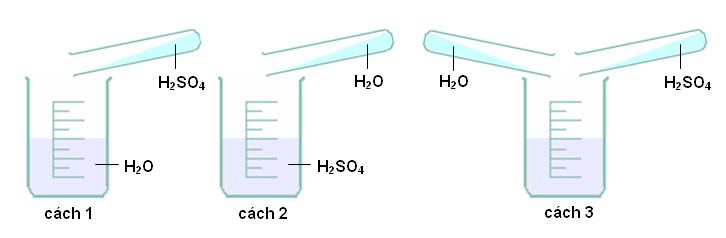
Để đảm bảo an toàn thí nghiệm nên làm theo
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Muốn pha loãng axit sunfuric đặc, phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh, tuyệt đối không làm ngược lại. Vì nếu rót nước vào axit H2SO4đặc, nước sôi đột ngột kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dung dịch làm quỳ tím hóa đỏ: H2SO4.
Dung dịch làm quỳ tím hóa xanh: NaOH.
Dung dịch không làm đổi màu quỳ tím: Na2SO4, NaCl.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Thuốc thử đặc trưng để nhận biết khí ozon (O3) là: KI + hồ tinh bột.
Phương trình hóa học; 2KI + O3+ H2O I2+ 2KOH + O2.
Hiện tượng: iot sinh ra tạo thành với hồ tinh bột một chất có màu xanh.
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phản ứng giữa S và Hg xảy ra ngay ở nhiệt độ thường.
Dùng bột S để thu gom thủy ngân rơi vãi.
Phương trình hóa học: S + Hg HgS.
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Một số kim loại không phản ứng được với axit H2SO4đặc, nguội là: Al, Fe, Cr.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Kim loại đứng trước (H) trong dãy hoạt động hóa học có khả năng tác dụng với dung dịch H2SO4loãng sinh ra khí H2.
Có 4 kim loại tác dụng với dung dịch H2SO4loãng là: Na, Mg, Fe, Zn.
Phương trình hóa học:
2Na + H2SO4Na2SO4+ H2
Mg + H2SO4MgSO4+ H2
Fe + H2SO4FeSO4+ H2
Zn + H2SO4ZnSO4+ H2
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Một mẫu khí thải được sục vào dung dịch CuSO4, thấy xuất hiện kết tủa màu đen.
Khí thải đó có chứa H2S.
Phương trình hóa học; CuSO4+ H2S CuS (đen)+ H2SO4.
Câu 14:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron của nguyên tử S (Z = 16) là: 1s22s22p63s23p4.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình hóa học:
2FeO + 4H2SO4Fe2(SO4)3+ SO2+ 4H2O.
Sản phẩm thu được gồm: Fe2(SO4)3, SO2, H2O.
Câu 16:
Hấp thụ hoàn toàn 2,24 lit khí SO2(đtkc) vào 100ml dung dịch NaOH 1,5M. Tính khối lượng muối thu được.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
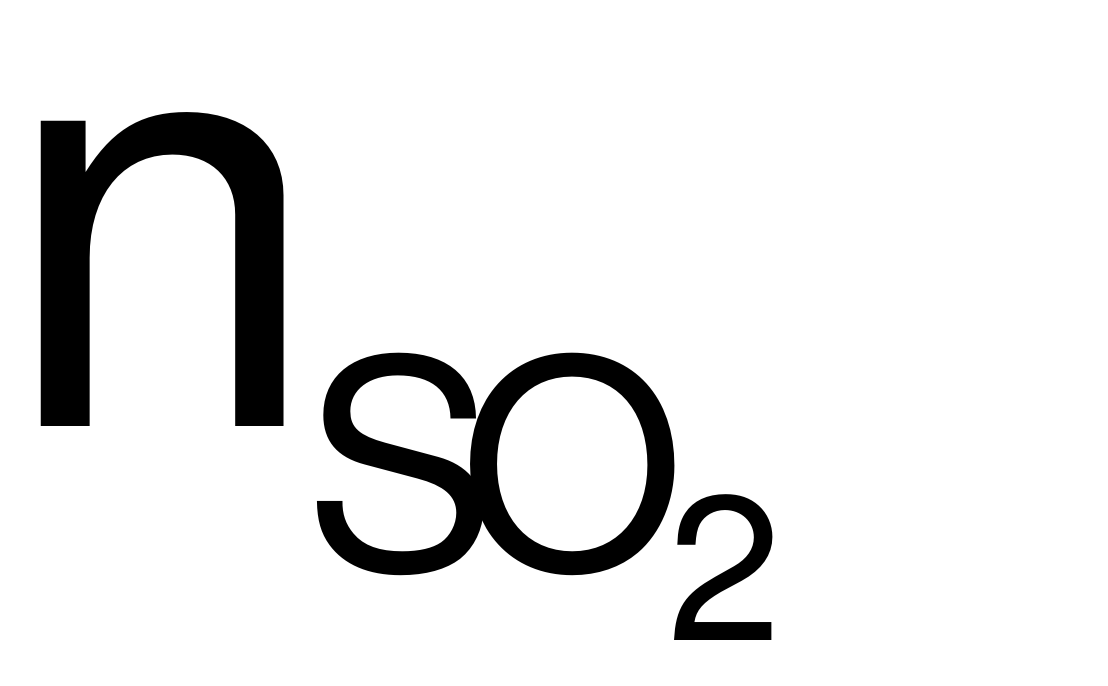 = 0,1 (mol); nNaOH= 0,15 (mol).
= 0,1 (mol); nNaOH= 0,15 (mol).
Nhận xét: 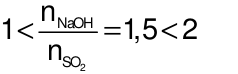 tạo 2 muối NaHSO3(x mol) và Na2SO3(y mol).
tạo 2 muối NaHSO3(x mol) và Na2SO3(y mol).
Phương trình hóa học:
SO2+ NaOH NaHSO3
x x x (mol)
SO2+ 2NaOH Na2SO3+ H2O
y 2y y (mol)
Ta có hệ phương trình: 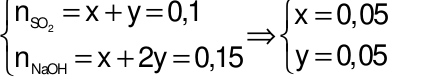 .
.
mmuối= 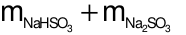 = 0,05×104 + 0,05×126 = 11,5 (gam).
= 0,05×104 + 0,05×126 = 11,5 (gam).
Câu 17:
Hỗn hợp X gồm oxi và ozôn có tỉ khối đối với H2là 17,6. Tính % thể tích oxi trong hỗn hợp X.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
![]() = 17,6×2 = 35,2 (đvC).
= 17,6×2 = 35,2 (đvC).
Áp dụng quy tắc đường chéo: 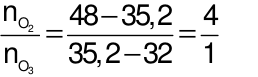 .
.
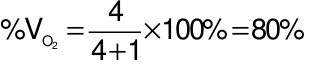 .
.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số oxi hóa của Fe: 0, +2, +3.
Có 5 chất (có số oxi hóa của nguyên tố Fe < +3) khi tác dụng với H2
SO4đặc, nóng xảy ra phản ứng oxi hóa khử: Fe, Fe3O4, FeO, FeCO3, Fe(OH)2(sản phẩm thu được: Fe2(SO4)3; SO2; H2O).Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Điều chế O2trong phòng thí nghiệm bằng cách nhiệt phân hợp chất giàu oxi và kém bền với nhiệt như KClO3, KMnO4, …
2KClO3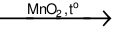 2KCl + 3O2
2KCl + 3O2
Câu 20:
Cho 2,81 gam hỗn hợp gồm 3 oxit Fe2O3, MgO, ZnO tan vừa đủ trong 300 ml dung dịch H2SO40,1M thì khối lượng hỗn hợp các muối sunfat khan tạo ra là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Sơ đồ phản ứng:
Oxit 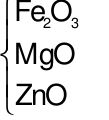 + H2SO4muối
+ H2SO4muối 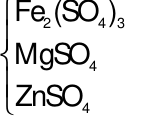 + H2O.
+ H2O.
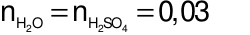 (mol).
(mol).
Bảo toàn khối lượng:
moxit+ 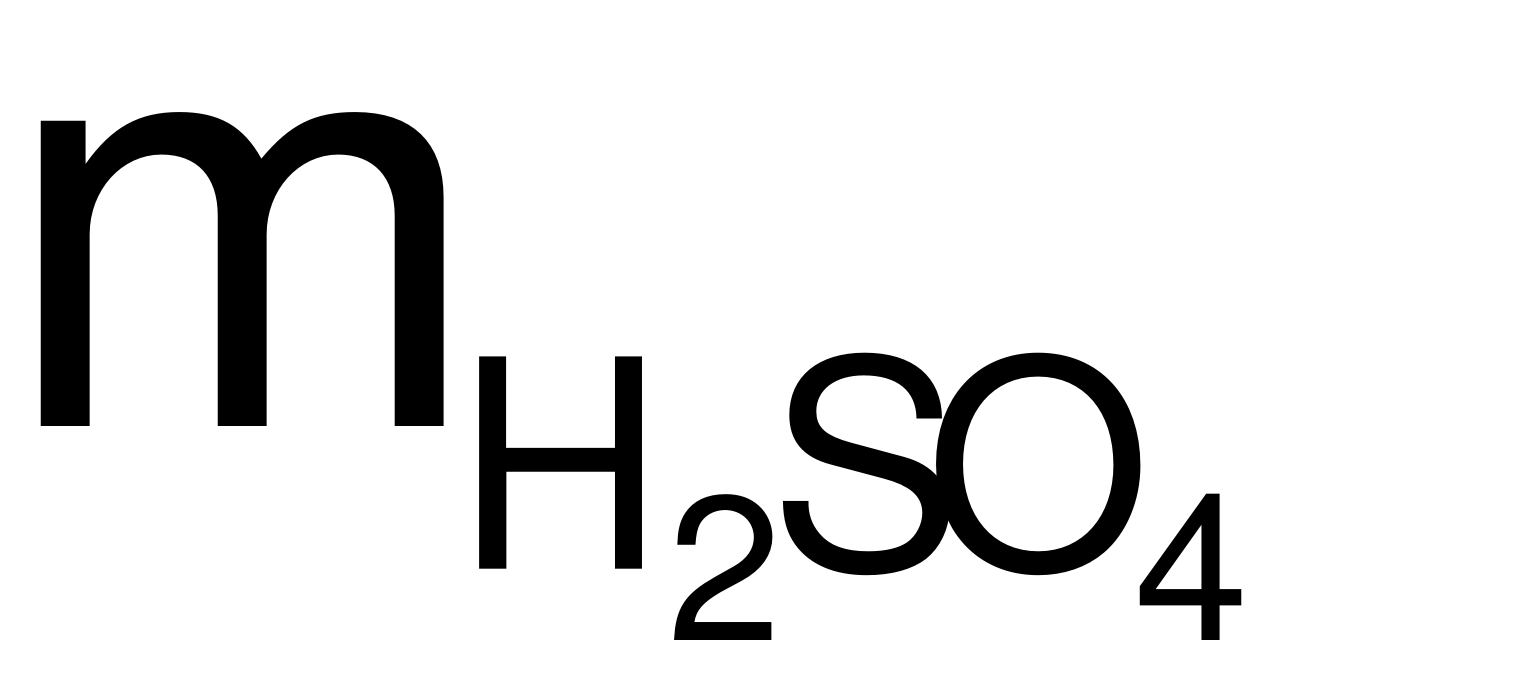 = mmuối+
= mmuối+ 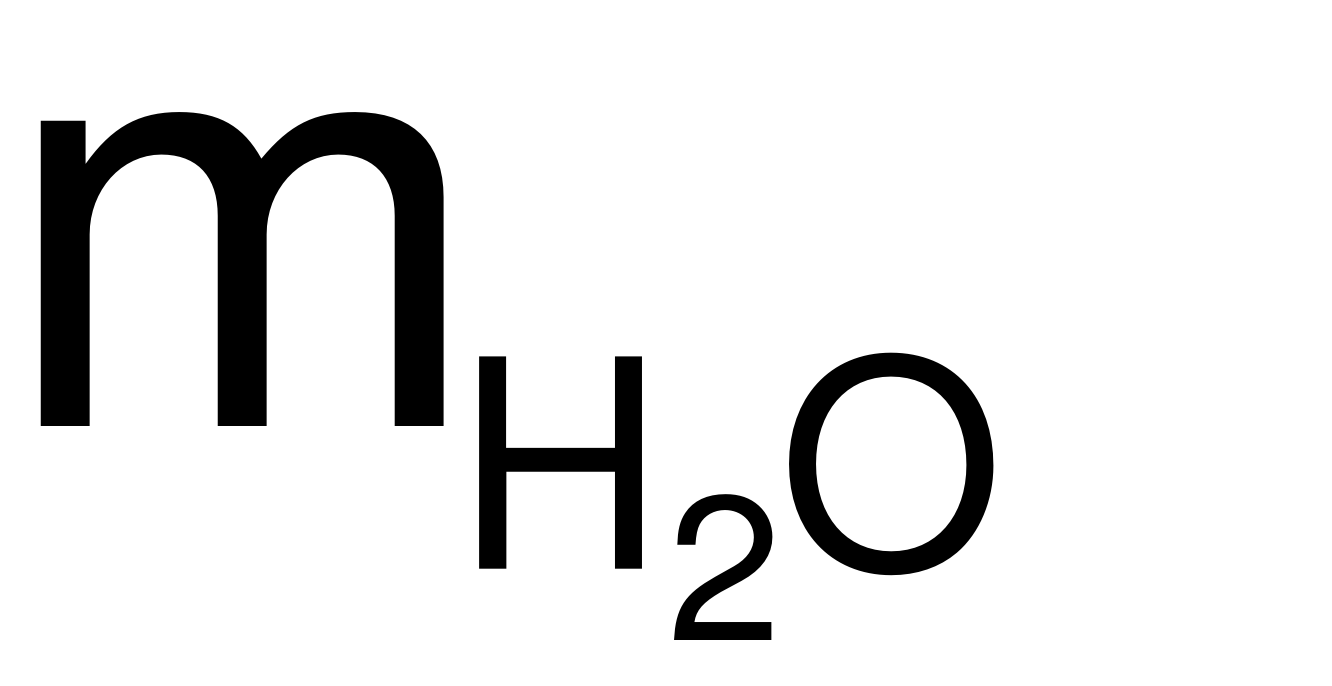
2,81 + 0,03×98 = mmuối+ 0,03×18
mmuối= 5,21 (gam).
Câu 21:
(1,25 điểm). Viết các phương trình phản ứng hóa học thực hiện sơ đồ chuyển hóa sau (mỗi mũi tên viết một phương trình phản ứng):
S ![]() H2S
H2S ![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4![]() CuSO4.
CuSO4.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
(1) S + H2![]() H2S
H2S
(2) 2H2S + 3O2 (dư)![]() 2SO2+ 2H2O
2SO2+ 2H2O
(3) 2SO2+ O2![]() 2SO3
2SO3
(4) SO3+ H2O H2SO4
(5) H2SO4+ CuO CuSO4+ H2O
Câu 22:
Bằng phương pháp hóa học hãy nhận biết các dung dịch sau: NaOH, NaCl, Na2SO4, H2SO4.
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
- Lấy các mẫu thử.
- Dùng quỳ tím:
Dung dịch làm quỳ tím hóa đỏ là H2SO4.
Dung dịch làm quỳ tím hóa xanh là NaOH.
Dung dịch không làm đổi màu quỳ tím là NaCl và Na2SO4.
- Phân biệt: NaCl, Na2SO4.
Dùng dung dịch BaCl2: thấy xuất hiện kết tủa trắng là Na2SO4, không có hiện tượng gì là NaCl.
Na2SO4+ BaCl2BaSO4+ 2NaCl
Câu 23:
Cho 19,2g hỗn hợp X gồm Fe và Cu tác dụng với dung dịch H2SO4đặc, nóng, dư thu được 8,96 lít khí SO2(đktc).
 Xem đáp án
Xem đáp án
a. Phương trình hóa học:
2Fe + 6H2SO4Fe2(SO4)3+ 3SO2+ 6H2O
Cu + 2H2SO4CuSO4+ SO2+ 2H2O
b. ![]() (mol).
(mol).
Gọi số mol của Fe và Cu trong hỗn hợp X lần lượt là x, y (mol).
56x + 64y = 19,2 (1)
Bảo toàn e: 3nFe+ 2nCu= 2![]()
3x + 2y = 0,8 (2)
Từ (1) và (2), suy ra: x = 0,16; y = 0,16.
%mFe= ![]() ;
;
%mCu= 100% - 46,67% = 53,33%.
Câu 24:
Trong một bình kín dung tích không đổi có chứa 1,3a mol O2và 2,5a mol SO2ở 100oC, 2 atm (có mặt của xúc tác V2O5), nung nóng bình một thời gian sau đó đưa bình về nhiệt độ ban đầu, áp suất trong bình lúc đó là P atm. Biết hiệu suất phản ứng là 76%. Tìm P
 Xem đáp án
Xem đáp án
Hướng dẫn giải:
ntrước= 1,3a + 2,5a = 3,8a (mol).
Phương trình hóa học: 2SO2+ O2![]() 2SO3.
2SO3.
Nhận xét: ![]() Phương trình hóa học tính theo SO2.
Phương trình hóa học tính theo SO2.
Hiệu suất phản ứng là 76% Số mol SO2phản ứng = ![]() (mol)
(mol)
2SO2+ O2 2SO3
2SO3
Ban đầu: 2,5a 1,3a (mol)
Phản ứng: 1,9a 0,95a 1,9a (mol)
Sau phản ứng: 0,6a 0,35a 1,9a (mol)
nsau= 0,6a + 0,35a + 1,9a = 2,85a (mol).
![]() (atm).
(atm).
