Đề thi cuối kì 2 Hóa 11 có đáp án (Đề 6)
-
8291 lượt thi
-
24 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phương trình hóa học:
C6H6+ 3Cl2 C6H6Cl6
C6H6Cl6
C6H6+ 3H2 C6H12
C6H12
C6H6+ Br2(dd) → Không xảy ra
C6H6+ HNO3(đặc) C6H5NO2+ H2O
C6H5NO2+ H2O
(Chú ý: C6H6+ Br2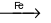 C6H5Br + HBr)
C6H5Br + HBr)
Câu 2:
Công thức tổng quát của anken là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Công thức tổng quát của anken là: CnH2n( n = 2).
Ví dụ: C2H4, C3H6, ...
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình hóa học:
CH3-CH(CH3)-CH2-CH3+ Cl2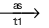 CH3-CCl(CH3)-CH2-CH3+ HCl
CH3-CCl(CH3)-CH2-CH3+ HCl
→ Sản phẩm chính: CH3-CCl(CH3)-CH2-CH3(2-clo-2-metylbutan).
Câu 4:
Dùng dung dịch nước Br2 làm thuốc thử có thể phân biệt:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Dùng dung dịch nước Br2 làm thuốc thử có thể phân biệt: Toluen (C6H5CH3), stiren (C6H5CH=CH2).
Hiện tượng :
Dung dịch brom nhạt màu là stiren:
C6H5CH=CH2+ Br2→ C6H5CHBr-CH2Br.
Không có hiện tượng gì là toluen.
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chất dùng để điều chế ancol etylic bằng phương pháp tổng hợp là etilen (C2H4).
C2H4+ H2O  C2H5OH
C2H5OH
Câu 7:
Cho 8,1 gam But-1-in vào dung dịch AgNO3/NH3 thì thu được bao nhiêu gam kết tủa?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Sơ đồ phản ứng:
CH≡C-CH2-CH3 CAg≡C-CH2-CH3↓.
CAg≡C-CH2-CH3↓.
→ n↓= nbut-1-in=  = 0,15 (mol)
= 0,15 (mol)
→ m↓= 0,15×161 = 24,15 (gam).
Câu 8:
Cho hỗn hợp khí gồm metan và etilen đi qua dung dịch Br2 dư thì lượng Br2 tham gia phản ứng là 24 gam. Thể tích khí etilen (ở đktc) có trong hỗn hợp đầu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cho hỗn hợp khí metan (CH4) và etilen (C2H4) qua dung dịch Br2, chỉ có etilen tham gia phản ứng:
CH2=CH2+ Br2→ CH2Br=CH2Br.
→ 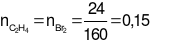 (mol)
(mol)
→  = 0,15×22,4 = 3,36 (lít).
= 0,15×22,4 = 3,36 (lít).
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Khi chiếu sáng hoặc đun nóng, các ankan dễ dàng tham gia phản ứng thế, phản ứng tách hiđro và phản ứng cháy.
Tính chất hóa học đặc trưng của ankan là phản ứng thế.
Ví dụ: CH4+ Cl2 CH3Cl + HCl.
CH3Cl + HCl.
Câu 11:
(2 điểm)
Viết phương trình hóa học theo sơ đồ sau (ghi rõ điều kiện phản ứng nếu có):CH3COONa CH4
CH4 C2H2
C2H2 C2H4
C2H4 C2H5OH
C2H5OH
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) CH3COONa + NaOH  CH4↑ + Na2CO3
CH4↑ + Na2CO3
(2) 2CH4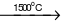 C2H2+ 3H2
C2H2+ 3H2
(3) C2H2+ H2 C2H4
C2H4
(4) C2H4+ H2O  C2H5OH
C2H5OH
Câu 12:
(3 điểm)
Cho 14 gam hỗn hợp X gồm phenol và ancol etylic tác dụng với natri dư thấy có 2,24 lít khí thoát ra (đktc).
a) Tính thành phần phần trăm khối lượng các chất trong hỗn hợp X.
b) Cho 1/2 lượng hỗn hợp X tác dụng với dung dịch brom thu được m gam kết tủa trắng của 2,4,6- tribromphenol. Tính m.
c) Khi cho 28 gam hỗn hợp X trên tác dụng với CuO, đun nóng thu được anđehit Y tương ứng. Cho 50 gam dung dịch Y tác dụng với dung dịch AgNO3 trong NH3(đủ) thu được a gam Ag kết tủa. Tính nồng độ phần trăm của Y trong dung dịch đã dùng và tính giá trị a.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
a) Phương trình hóa học:
2C6H5OH + 2Na → 2C6H5ONa + H2↑
x0,5x (mol)
2C2H5OH + 2Na → 2C2H5ONa + H2↑
y 0,5y (mol)
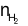 = 0,1 (mol).
= 0,1 (mol).
Gọi số mol C6H5OH và C2H5OH lần lượt là x, y (mol).
Ta có hệ phương trình:
 .
.
→  ;
;
 = 100% - 67,14% = 32,86%.
= 100% - 67,14% = 32,86%.
b) Phương trình hóa học:
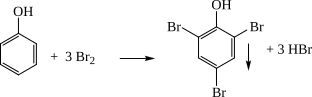
→  (mol)
(mol)
→ m↓ = 0,05331 = 16,55 (gam).
c) 28 gam hỗn hợp X có: 0,2 mol C6H5OH và 0,2 mol C2H5OH.
Sơ đồ phản ứng: C2H5OH 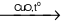 CH3CHO
CH3CHO  2Ag↓.
2Ag↓.
→ Anđehit Y là CH3CHO.
Ta có: nAg= 2 = 20,2 = 0,4 (mol)
= 20,2 = 0,4 (mol)
→ a = mAg= 0,4108 = 43,2 (gam).
 = 0,2 (mol).
= 0,2 (mol).
→ C%(Y)= 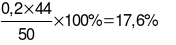 .
.
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là:B
Phân biệt: hex-1-in (CH≡C-CH2-CH2-CH2-CH3), toluen (C6H5CH3), benzen (C6H6).
→ Dùng dung dịch KMnO4.
+ Hex-1-in làm mất màu dung dịch thuốc tím ở ngay điều kiện thường.
+ Toluen làm mất màu dung dịch thuốc tím khi đun nóng.
C6H5CH3+ +2KMnO4 C6H5COOK + 2MnO2↓ + KOH + H2O
C6H5COOK + 2MnO2↓ + KOH + H2O
+ Benzen không làm mất màu dung dịch thuốc tím kể cả khi đun nóng.
Câu 14:
Công thức tổng quát của ankin là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Công thức tổng quát của ankin là: CnH2n-2( n = 2).
Ví dụ: C2H2, C3H4, ...
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Những hợp chất khác nhau nhưng có cùng công thức phân tử được gọi là các chất đồng phân của nhau.
→ C2H5OH, CH3-O-CH3đều có công thức phân tử là C2H6O, do đó chúng là đồng phân của nhau.
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Các ank-1-in, anđehit có khả năng tác dụng với AgNO3/NH3(ank-1-in tạo kết tủa màu vàng nhạt, anđehit tạo kết tủa Ag).
→ Dãy gồm các chất đều tác dụng AgNO3/NH3: Vinylaxetilen (CH2=CH-C≡CH), but-1-in (CH≡C-CH2-CH3), propin (CH≡C-CH3).
Loại A và D vì: Etilen (CH2=CH2) không tác dụng với AgNO3/NH3.
Loại C vì: But-2-in (CH3-C≡C-CH3) không tác dụng với AgNO3/NH3.
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Chất dùng để điều chế ancol etylic bằng phương pháp sinh hóa là tinh bột ((C6H10O5)n).
(C6H10O5)n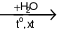 C6H12O6
C6H12O6 C2H5OH
C2H5OH
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Gọi công thức của anđehit là R(CHO)n.
Phương trình hóa học: R(CHO)n+ nH2→ R(CH2OH)n.
Bảo toàn khối lượng:
3 + 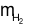 = 3,2 →
= 3,2 → 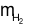 = 0,2 (gam) →
= 0,2 (gam) → 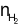 = 0,1 (mol).
= 0,1 (mol).
→ nA= 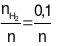 (mol) → MA=
(mol) → MA= 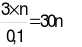 .
.
→ Chọn n = 1, MA= 30 → A là HCHO (anđehit fomic).
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là:C
Sơ đồ phản ứng: X + O2 CO2+ H2O.
CO2+ H2O.
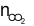 = 0,4 (mol);
= 0,4 (mol);  = 0,6 (mol).
= 0,6 (mol).
Bảo toàn nguyên tố C và H:
m = mX= mC+ mH= 0,412 + 0,62 = 6 (gam).
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CH2=C(CH3)-CH3+ HCl → CH3-CCl(CH3)-CH3(sản phẩm chính)
2-clo-2-metyl propan
CH2=C(CH3)-CH3+ HCl → CH2Cl-CH(CH3)-CH3(sản phẩm phụ)
1-clo-2-metyl propan
Câu 22:
Anken X có công thức cấu tạo CH3–CH2–C(CH3)=CH–CH3. Tên của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Câu 23:
(2 điểm)
Viết phương trình hóa học theo sơ đồ sau( ghi rõ điều kiện phản ứng nếu có):CH3COONa CH4
CH4 C2H2
C2H2 C2H4
C2H4 C2H5OH
C2H5OH
 Xem đáp án
Xem đáp án
Hướng dẫn giải
(1) CH3COONa + NaOH  CH4↑ + Na2CO3
CH4↑ + Na2CO3
(2) 2CH4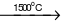 C2H2+ 3H2
C2H2+ 3H2
(3) C2H2+ H2 C2H4
C2H4
(4) C2H4+ H2O  C2H5OH
C2H5OH
Câu 24:
Cho 14 gam hỗn hợp X gồm phenol và ancol etylic tác dụng với natri dư thấy có 2,24 lít khí thoát ra (đktc).
a) Tính thành phần phần trăm khối lượng các chất trong hỗn hợp X.
b) Cho 1/2 lượng hỗn hợp X tác dụng với dung dịch brom thu được m gam kết tủa trắng của 2,4,6- tribromphenol. Tính m?
c) Khi cho 28 gam hỗn hợp X trên tác dụng với CuO, đun nóng thu được anđehit Y tương ứng. Cho 50 gam dung dịch Y tác dụng với dung dịch AgNO3 trong NH3( đủ) thu được a gam Ag kết tủa. Tính nồng độ phần trăm của Y trong dung dịch và tính giá trị a?
 Xem đáp án
Xem đáp án
Hướng dẫn giải
a) Phương trình hóa học:
2C6H5OH + 2Na → 2C6H5ONa + H2↑
x 0,5x (mol)
2C2H5OH + 2Na → 2C2H5ONa + H2↑
y 0,5y (mol)
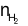 = 0,1 (mol).
= 0,1 (mol).
Gọi số mol C6H5OH và C2H5OH lần lượt là x, y (mol).
Ta có hệ phương trình:
 .
.
→  ;
;
 = 100% - 67,14% = 32,86%.
= 100% - 67,14% = 32,86%.
b) Phương trình hóa học:

→  (mol)
(mol)
→ m↓ = 0,05331 = 16,55 (gam).
c) 28 gam hỗn hợp X có: 0,2 mol C6H5OH và 0,2 mol C2H5OH.
Sơ đồ phản ứng: C2H5OH 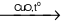 CH3CHO
CH3CHO  2Ag↓.
2Ag↓.
→ Anđehit Y là CH3CHO.
Ta có: nAg= 2 = 20,2 = 0,4 (mol)
= 20,2 = 0,4 (mol)
→ a = mAg= 0,4108 = 43,2 (gam).
 = 0,2 (mol).
= 0,2 (mol).
→ C%(Y)= 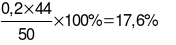 .
.

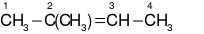 : 2-metylbut-2-en.
: 2-metylbut-2-en.