Đề thi cuối kì 2 Hóa 11 có đáp án (Đề 11)
-
8263 lượt thi
-
27 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Chất điện li mạnh là những chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Những chất điện li mạnh là các axit mạnh như HCl, HNO3, HClO4, H2SO4…; các bazơ mạnh như NaOH, KOH, Ba(OH)2, Ca(OH)2, … và hầu hết các muối.
Dãy gồm những chất điện li mạnh là: CH3COONa, HCl, NaOH.
Loại A vì HF là chất điện li yếu.
Loại C vì H2S là chất điện li yếu.
Loại D vì H3PO4là chất điện li yếu.
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
pH < 7: môi trường axit.
pH = 7: môi trường trung tính.
pH >7: môi trường kiềm.
Phát biểu khôngđúng là: Môi trường kiềm có pH < 7.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Al(OH)3là hiđroxit lưỡng tính:
Sự phân li theo kiểu bazơ: Al(OH)3 Al3++ 3OH-.
Al3++ 3OH-.
Sự phân li theo kiểu axit: Al(OH)3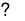
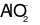 + H3O+.
+ H3O+.
Câu 4:
Trong phòng thí nghiệm người ta thu khí N2bằng phương pháp dời nước vì
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong phòng thí nghiệm người ta thu khí N2 bằng phương pháp dời nước vì N2 rất ít tan trong nước.
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Công thức tổng quát của anken là CnH2n(n ≥ 2).
Ví dụ: C2H4, C3H6, ...
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
CH C-CH3có tên gọi là propin.
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Gọi công thức phân tử của X là (CH2O)n(n ≥ 1).
Ta có: MX= 30n = 45×2 n = 3
Công thức phân tử của X là C3H6O3.
Câu 8:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
But-1-en khi phản ứng với dung dịch brom thu được 1,2-đibrombutan.
Phương trình hóa học:
CH2=CH-CH2-CH3+ Br2CH2Br-CHBr-CH2-CH3.
Câu 9:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Sấm sét cung cấp năng lượng cho phản ứng giữa N2và O2tạo thành NO:
N2+ O2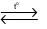 2NO
2NO
Câu 10:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
C (Z = 6): 1s22s22p2.
Có 2 lớp electron thuộc chu kì 2.
Số electron lớp ngoài cùng là 4, nguyên tố p thuộc nhóm IVA.
C ở ô thứ 6, chu kì 2, nhóm IV của bảng tuần hoàn.
Câu 11:
Trong các hợp chất sau hợp chất nào không phải hợp chất hữu cơ?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, muối cacbonat, xianua, cacbua, …).
Hợp chất không phải hợp chất hữu cơ: (NH4)2CO3.
Câu 12:
Khi phân tích định tính nguyên tố hiđro trong hợp chất hữu cơ người ta thường đốt cháy chất hữu cơ đó rồi cho sản phẩm đi qua
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi phân tích định tính nguyên tố hiđro trong hợp chất hữu cơ người ta thường đốt cháy chất hữu cơ đó rồi cho sản phẩm đi qua CuSO4 khan.
Hiện tượng: CuSO4 khan từ màu trắng chuyển sang màu xanh của muối ngậm nước CuSO4.5H2O xác nhận có H trong hợp chất nghiên cứu.
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong thành phần hợp chất hữu cơ nhất thiết phải có cacbon, hay gặp hiđro, oxi, nitơ, sau đó đến halogen, lưu huỳnh, …
Câu 14:
Vì sao người ta không dùng CO2 để dập các đám cháy của kim loại có tính khử mạnh như (Mg, Al, Ca...)?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Không dùng CO2 để dập các đám cháy của kim loại có tính khử mạnh như (Mg, Al, Ca...)do CO2 tác dụng với các kim loại có tính khử mạnh.
Ví dụ: CO2+ 2Mg  2MgO + C
2MgO + C
Câu 15:
Hiện tượng xảy ra khi thổi từ từ khí CO2 vào dung dịch Ba(OH)2 dư là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi thổi từ từ khí CO2 vào dung dịch Ba(OH)2 dư:
CO2+ Ba(OH)2BaCO3+ H2O
Hiện tượng: xuất hiện kết tủa trắng.
Câu 16:
A.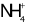 ; Na+;
; Na+; 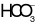 ;
; 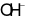 .
.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Để các ion có thể tồn tại đồng thời trong cùng một dung dịch thì giữa các ion không xảy ra phản ứng.
Tập hợp các ion có thể tồn tại đồng thời trong cùng một dung dịch: Fe2+; 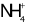 ;
; 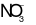 ;
; 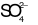 .
.
Loại A vì có phản ứng xảy ra giữa các ion:
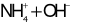 NH3+ H2O
NH3+ H2O

Loại C vì có phản ứng xảy ra giữa các ion:
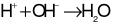

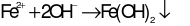
Loại D vì có phản ứng xảy ra giữa các ion:

Câu 17:
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Muối nitrat của kim loại yếu (Ag, Au, Hg, …) bị phân hủy tạo thành kim loại tương ứng, NO2và O2.
Dãy muối rắn đều sinh ra kim loại: AgNO3 , Hg(NO3)2.
2AgNO3 2Ag + 2NO2+ O2
2Ag + 2NO2+ O2
Hg(NO3)2 Hg + 2NO2+ O2
Hg + 2NO2+ O2
Loại B, C, D vì:
2Cu(NO3)2 2CuO + 4NO2+ O2
2CuO + 4NO2+ O2
2Mg(NO3)2 2MgO + 4NO2+ O2
2MgO + 4NO2+ O2
Câu 18:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phản ứng viết khôngđúng là: P2O3+ 3H2O 2H3PO4.
Phản ứng đúng: P2O5+ 3H2O 2H3PO4.
Câu 19:
Hấp thụ hoàn toàn 2,24 lit CO2 vào 75 ml dung dịch nước vôi trong Ca(OH)21M. Khối lượng kết tủa thu được sau phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
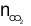 = 0,1 (mol);
= 0,1 (mol);  = 0,075 (mol)
= 0,075 (mol)
 = 0,075×2 = 0,15 (mol),
= 0,075×2 = 0,15 (mol),  = 0,075 (mol).
= 0,075 (mol).
Nhận xét: 1 < 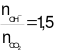 < 2 xảy ra 2 phản ứng sau:
< 2 xảy ra 2 phản ứng sau:
CO2+ 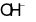
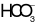
x x (mol)
CO2+ 2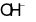
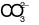 + H2O
+ H2O
y 2y y (mol)
Ca2++ 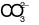 CaCO3
CaCO3
Ta có hệ phương trình:
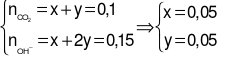 .
.
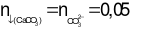 (mol) m= 0,05×100 = 5 (gam).
(mol) m= 0,05×100 = 5 (gam).
</></>
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Sơ đồ phản ứng: X + O2 CO2+ H2O.
CO2+ H2O.
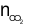 = 0,1 (mol);
= 0,1 (mol); 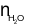 = 0,1 (mol).
= 0,1 (mol).
nX= 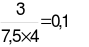 (mol).
(mol).
mX= mC+ mH+ mO
3 = 0,1×12 + 0,1×2 + mOmO= 1,6 (gam)
nO(X)=  = 0,1 (mol).
= 0,1 (mol).
Phân tử X gồm 3 nguyên tố C, H và O.
Số C = 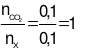 (nguyên tử);
(nguyên tử);
Số H = 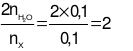 (nguyên tử);
(nguyên tử);
Số O (trong X) = 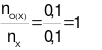 (nguyên tử).
(nguyên tử).
Công thức phân tử của X là CH2O.
Câu 21:
Đốt cháy hoàn toàn 2,24 lít hỗn hợp A (đktc) gồm CH4, C2H6 và C3H8 thu được V lít khí CO2 (đktc) và 7,2 gam H2O. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
nA= 0,1 (mol); 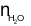 = 0,4 (mol).
= 0,4 (mol).
Hỗn hợp A gồm các ankan.
Khi đốt cháy A, ta có: nA= 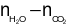
0,1 = 0,4 – 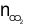
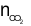 = 0,3 (mol).
= 0,3 (mol).
 = 0,3×22,4 = 6,72 (lít).
= 0,3×22,4 = 6,72 (lít).
Câu 22:
Dung dịch A chứa 2 axit H2SO4 aM và HCl 0,2M. Dung dịch B chứa 2 bazơ NaOH 0,5M và Ba(OH)2 0,25M. Biết 100 ml dung dịch A trung hoà 120 ml dung dịch B. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
100 ml dung dịch A (H2SO4aM và HCl 0,2M).
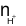 = 0,1×(2a + 0,2) = (0,2a + 0,02) (mol).
= 0,1×(2a + 0,2) = (0,2a + 0,02) (mol).
120 ml dung dịch B (NaOH 0,5M và Ba(OH)20,25M).
 = 0,12×(0,5 + 0,25×2) = 0,12 (mol).
= 0,12×(0,5 + 0,25×2) = 0,12 (mol).
Phương trình ion: H++ OH-→ H2O
Ta có:  → 0,2a + 0,02 = 0,12 → a = 0,5.
→ 0,2a + 0,02 = 0,12 → a = 0,5.
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình ion:
CO2+ OH-→ 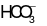 (1)
(1)
CO2+ 2OH-→ 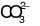 (2)
(2)
Ba2++ 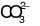 → BaCO3↓ (3)
→ BaCO3↓ (3)
nKOH= 0,1 (mol) →  = 0,1 (mol).
= 0,1 (mol).
 = 0,025 (mol)
= 0,025 (mol)
→  = 0,025 (mol);
= 0,025 (mol);  = 20,025 = 0,05 (mol).
= 20,025 = 0,05 (mol).
→ 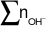 = 0,1 + 0,05 = 0,15 (mol).
= 0,1 + 0,05 = 0,15 (mol).
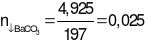 (mol).
(mol).
Nhận xét:  .
.
Trường hợp 1:Chỉ xảy ra phản ứng (1) và (3).
→  (mol)
(mol)
→  = 0,02522,4 = 0,56 (lít).
= 0,02522,4 = 0,56 (lít).
Trường hợp 2:Xảy ra phản ứng (1), (2) và (3).
CO2+ OH-→ 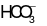 (1)
(1)
0,10,1(mol)
CO2+ 2OH-→ 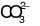 (2)
(2)
0,0250,050,025 (mol)
Ba2++ 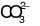 → BaCO3↓ (3)
→ BaCO3↓ (3)
0,025 0,025 (mol)
→  = 0,1 + 0,025 = 0,125 (mol)
= 0,1 + 0,025 = 0,125 (mol)
→  = 0,12522,4 = 2,8 (lít).
= 0,12522,4 = 2,8 (lít).
Câu 24:
Cho 13,8 gam chất hữu cơ X có công thức phân tử C7H8 tác dụng với một lượng dư dung dịch AgNO3 trong NH3, thu được 45,9 gam kết tủa. X có bao nhiêu đồng phân cấu tạo thỏa mãn tính chất trên?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phân tử C7H8có độ bất bão hòa 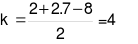 .
.
C7H8tác dụng với dung dịch AgNO3/NH3thu được kết tủa
→ phân tử C7H8 có liên kết C≡C đầu mạch.
nX= 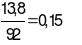 (mol).
(mol).
Thay thế 1 nguyên tử H bằng 1 nguyên tử Ag → tăng 108 – 1 = 107 (đvC).
Nhận xét: 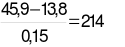 → thay thế 2 nguyên tử H bằng 2 nguyên tử Ag.
→ thay thế 2 nguyên tử H bằng 2 nguyên tử Ag.
→ Phân tử C7H8(K = 4) có 2 liên kết ba C≡C đầu mạch.
Đồng phân cấu tạo của X:
CH≡CCH2CH2CH2C≡CH; CH≡CCH(CH3)CH2C≡CH; CH≡CC(CH3)2C≡CH;
CH≡CCH(C2H5)C≡CH.
Câu 25:
Viết PTHH của phản ứng xảy ra khi cho:
a) 2-metyl propen tác dụng với hiđro, đun nóng ( xúc tác Ni)
b) axetilen tác dụng với nước
c) propin tác dụng với dung dịch AgNO3/NH3
d) popen tác dụng với dung dịch KMnO4
 Xem đáp án
Xem đáp án
Hướng dẫn giải
a) 2-metyl propen tác dụng với hiđro, đun nóng ( xúc tác Ni):
CH2=C(CH3)-CH3+ H2 CH3-CH(CH3)-CH3
CH3-CH(CH3)-CH3
b) axetilen tác dụng với nước:
CH≡CH + H2O 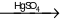 CH3CHO
CH3CHO
c) propin tác dụng với dung dịch AgNO3/NH3
CH≡C-CH3+ AgNO3+ NH3→ CAg≡ C-CH3↓ + NH4NO3
d) popen tác dụng với dung dịch KMnO4
3CH2=CH-CH3+ 2KMnO4+ 4H2O → 3CH2(OH)-CH(OH)-CH3+ 2KOH + 2MnO2
Câu 26:
Cho 12,4 gam photpho tác dụng hoàn toàn với oxi. Sau đó cho toàn bộ lượng P2O5 tạo ra hòa tan vào 80 ml dung dịch NaOH 25% (d =1,28g/ml).
- Viết các PTHH xảy ra.
- Tính khối lượng muối thu được.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
nP= 0,4 (mol); nNaOH= 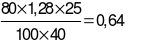 (mol).
(mol).
Phương trình hóa học:
4P + 5O2 2P2O5(1)
2P2O5(1)
0,4 0,2(mol)
2NaOH + P2O5+ H2O → 2NaH2PO4(2)
2xx2x (mol)
4NaOH + P2O5 → 2Na2HPO4+ H2O (3)
4yy2y(mol)
Nhận xét: 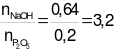 → sản phẩm tạo 2 muối: NaH2PO4và Na2HPO4.
→ sản phẩm tạo 2 muối: NaH2PO4và Na2HPO4.
Gọi số mol P2O5ở phản ứng (1) và (2) lần lượt là x, y (mol).
Ta có hệ phương trình:
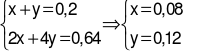 .
.
→ mmuối= 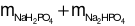 = 20,08120 + 20,12142 = 53,28 (gam).
= 20,08120 + 20,12142 = 53,28 (gam).
Câu 27:
Đốt cháy hoàn toàn 0,1 mol chất hữu cơ A cần 12,8 gam O2. Sau phản ứng thu được 16,8 lít hỗn hợp hơi (136oC; 1atm) gồm CO2và hơi nước. Hỗn hợp này có tỷ khối so với CH4 là 2,1.
Xác định công thức cấu tạo của A và gọi tên A biết rằng A tạo kết tủa vàng khi cho tác dụng với dung dịch AgNO3 trong NH3. Tính lượng kết tủa khi cho 0,1 mol A phản ứng với hiệu suất 90%.
 Xem đáp án
Xem đáp án
Hướng dẫn giải
Sơ đồ phản ứng: A + O2 CO2+ H2O.
CO2+ H2O.
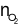 = 0,4 (mol).
= 0,4 (mol).
 =
= 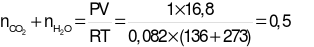 (mol).
(mol).
→  = 0,5(2,116) = 16,8 (gam).
= 0,5(2,116) = 16,8 (gam).
Gọi số mol CO2và số mol H2O lần lượt là x, y (mol).
Ta có hệ phương trình:
 .
.
Bảo toàn khối lượng:
mA+ 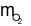 =
= 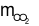 +
+ 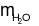 → mA+ 12,8 = 16,8 → mA= 4 (gam).
→ mA+ 12,8 = 16,8 → mA= 4 (gam).
mO(A)= mA– (mC+ mH) = 4 – (0,312 + 0,22) = 0 (gam).
→ Trong phân tử A chỉ gồm 2 nguyên tố C và H.
Số C = 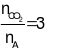 ; Số H =
; Số H =  .
.
→ Công thức phân tử của A là C3H4.
A tạo kết tủa vàng khi cho tác dụng với dung dịch AgNO3trong NH3
→ Công thức cấu tạo của A là: CH≡C-CH3.
Sơ đồ phản ứng: CH≡C-CH3 CAg≡C-CH3↓.
CAg≡C-CH3↓.
0,1 0,1 (mol)
→ m↓= 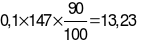 (gam).
(gam).
