Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 13)
-
6971 lượt thi
-
22 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Dẫn từ từ CO2 vào dung dịch chỉ chứa 0,02 mol Ba(OH)2. Đồ thị dưới đây biểu diễn sự phụ thuộc của số mol kết tủa BaCO3 tạo thành theo số mol CO2.
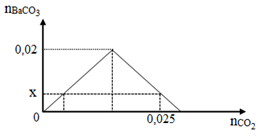
Giá trị của x là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
1) Ba(OH)2 + CO2 → BaCO3 + H2O
(2) BaCO3 + CO2 + H2O → Ba(HCO3)2
Xét tại thời điểm BaCO3 tối đa thì chỉ có phản ứng (1) xảy ra
Xét tại thời điểm nCO2 = 0,025 mol thì xảy ra cả (1) và (2)
→ lượng kết tủa bị CO2 hòa tan một phần
Giải chi tiết:
(1) Ba(OH)2 + CO2 → BaCO3 + H2O
(2) BaCO3 + CO2 + H2O → Ba(HCO3)2
Xét tại thời điểm BaCO3 tối đa thì phản ứng (1) vừa kết thúc => nBaCO3 = nCO2 = nBa(OH)2 = 0,02 mol
Xét tại thời điểm nCO2 = 0,025 mol thì BaCO3 đã bị hòa tan một phần => Xảy ra (1) và (2)
(1) Ba(OH)2 + CO2 → BaCO3 + H2O
0,02 → 0,02 → 0,02 mol
(2) BaCO3 + CO2 + H2O → Ba(HCO3)2
Trước phản ứng: 0,02 0,005 mol
Phản ứng: 0,005 ← 0,005 → 0,005 mol
Sau phản ứng: 0,015 0 0,005 mol
→ x = nBaCO3 = 0,015 mol
Câu 2:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
- Phân đạm cung cấp nguyên tố N
- Phân lân cung cấp nguyên tố P
- Phân kali cung cấp nguyên tố K
Giải chi tiết:
Phân đạm cung cấp cho cây trồng nguyên tố dinh dưỡng nitơ (N)
Câu 3:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
Khi bón phân ure thì phân sẽ chuyển hóa thành (NH4)2CO3
Nhận định ảnh hưởng của từng loại phân đến (NH4)2CO3 (thông qua chuyển thành NH3).
Giải chi tiết:
Không nên bón phân urê cho cây trồng cùng lúc với vôi sống vì:
CO(NH2)2 + 2H2O → (NH4)2CO3
CaO + H2O → Ca(OH)2
Ca(OH)2 + (NH4)2CO3 → CaCO3 + 2NH3 + H2O
→ Như vậy sẽ làm mất NH4+ để cung cấp cho cây, đồng thời mất lượng OH- để khử chua đất.
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
pH = - log[H+]
Giải chi tiết:
HNO3 là chất điện li mạnh, khi hòa tan trong nước điện li hoàn toàn thành ion:
HNO3 → H+ + NO3-
0,01M → 0,01M
→ [H+] = 0,01M → pH = -log 0,01 = 2
Câu 5:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
- Bảo toàn điện tích → nMg2+
- mrắn = mion
Giải chi tiết:
- Bảo toàn điện tích: nNa+ + 2nMg2+ = nCl- + 2nSO42-
→ 0,05 + 2nMg2+ = 0,04 + 2.0,03 → nMg2+ = 0,025 mol
- Ta có: mmuối = mion = mNa+ + mMg2+ + mCl- + mSO42- = 0,05.23 + 0,025.24 + 0,04.35,5 + 0,03.96 = 6,05 gam
Câu 6:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Nếu pH < 7 => MT axit
Nếu pH = 7 => MT trung tính
Nếu pH > 7 => MT bazơ
Giải chi tiết:
Nước thải có pH = 3,5 < 7 → nước thải mang môi trường axit
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Khi cho m g Al vào thì → mAl(NO3)3 = (m/27).213 < 8m → Muối có NH4NO3 → nNH4NO3 theo m
- Viết các quá trình cho - nhận e. Áp dụng định luật bảo toàn e => Phương trình (1) ẩn m, x
- Khi cho NaOH vào Y: NaOH + NH4NO3 → NaNO3 + NH3 + H2O
4NaOH + Al(NO3)3 → 3NaNO3 + NaAlO2 + 2H2O
Từ số mol NaOH phản ứng => Phương trình (2) ẩn m, x
Giải hệ (1) và (2) tìm được m và x.
Giải chi tiết:
Khi cho m g Al vào thì → mAl(NO3)3 = (m/27).213 < 8m → Muối có NH4NO3
Ta có: nAl = mol → nNH4NO3 = mol
QT cho e: Al → Al+3 + 3e
QT nhận e: 2N+5 + 8e → 2N+1 ; N+5 + 8e → N-3
- Bảo toàn e: 3nAl = 8nN2O + 8nNH4NO3 => (1)
- Khi cho NaOH vào Y: NaOH + NH4NO3 → NaNO3 + NH3 + H2O
4NaOH + Al(NO3)3 → 3NaNO3 + NaAlO2 + 2H2O
→ nNaOH phản ứng = nNH4NO3 + 4nAl(NO3)3 → 0,646 = → m = 4,32 gam (2)
Từ (1) và (2) suy ra x = 0,054 mol → x gần nhất với 0,055
Câu 8:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Sơ đồ tổng hợp HNO3: NH3 → NO → NO2 → HNO3
Theo lý thuyết: 17g (1mol) → 63 g (1mol)
4 tấn → ? tấn
Thực tế H = 96% nên mHNO3 thực tế = mlý thuyết . 96% → mdd HNO3
Giải chi tiết:
Sơ đồ tổng hợp HNO3: NH3 → NO → NO2 → HNO3
Theo lý thuyết: 17g (1mol) → 63 g (1mol)
4 tấn → 4.63/17 = 14,82 tấn
Cả quá trình hiệu suất phản ứng là H = 96% => mHNO3 thực tế = 14,82 . 96% = 14,23 tấn
Khối lượng dung dịch HNO3 60% thu được thực tế là: mdd HNO3 = = 23,72 tấn
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Silic tan được trong dung dịch NaOH: 2NaOH + Si + H2O → Na2SiO3 + 2H2
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Chất điện li gồm có axit, bazo và muối.
Giải chi tiết:
Chất điện li là HNO3 (axit).
Câu 11:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Viết PTHH → hiện tượng.
Giải chi tiết:
Nhỏ từ từ dung dịch HCl đến dư vào dung dịch NaHCO3: HCl + NaHCO3 → NaCl + H2O + CO2
→ Hiện tượng là thoát ra khí không màu
Câu 12:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Amoni nitrat có công thức hóa học là NH4NO3.
Câu 13:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Giải chi tiết:
PT phân tử: NaOH + HNO3 → NaNO3 + H2O
+ Phương trình ion đầy đủ: Na+ + OH- + H+ + NO3- → Na+ + NO3- + H2O
+ Phương trình ion thu gọn: H+ + OH- → H2O
Câu 14:
 Xem đáp án
Xem đáp án
Chọn đáp án B
C hoạt tính có khả năng hấp phụ cao nên được dùng trong nhiều loại mặt nạ phòng độc.
Câu 15:
Thực hiện thí nghiệm như hình vẽ dưới đây:
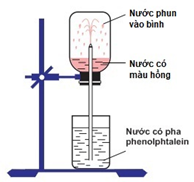
Bên trong bình, lúc đầu có chứa khí X. Hiện tượng xảy ra khi tiến hành thí nghiệm: nước phun mạnh vào bình và chuyển thành màu hồng. Khí X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
- Vì nước phun mạnh vào bình chứa khí X nên khí X tan tốt trong nước
- Nước chứa phenolphthalein chuyển màu hồng nên X tác dụng H2O tạo thành dung dịch có tính bazo
→ X
Giải chi tiết:
- Vì nước phun mạnh vào bình chứa khí X nên khí X tan tốt trong nước (khi bị hòa tan thì thể tích khí trong bình giảm nên nước phun vào bình).
- Nước chứa phenolphthalein chuyển màu hồng nên X tác dụng H2O tạo thành dung dịch có tính bazo
Vậy X là NH3
Câu 16:
Hoàn thành phương trình hóa học cho các phản ứng sau:
a) KNO3 Xem đáp án
Xem đáp án
Câu 20:
Bảng dưới đây ghi lại kết quả quan sát khi nhỏ dung dịch Ca(OH)2 vào các ống nghiệm (1), (2), (3), đun nóng đựng một trong các dung dịch NaNO3, (NH4)2CO3, K3PO4 không theo thứ tự.
|
Ống nghiệm |
(1) |
(2) |
(3) |
|
Hiện tượng |
Xuất hiện kết tủa trắng |
Không hiện tượng |
Xuất hiện kết tủa trắng và thoát ra khí mùi khai |
a) Các ống nghiệm (1), (2), (3) lần lượt chứa dung dịch của chất nào?
b) Viết phương trình hóa học xảy ra.
 Xem đáp án
Xem đáp án
a.
Phương pháp giải:
Dựa vào các PTHH xảy ra khi cho Ca(OH)2 vào các dung dịch NaNO3, (NH4)2CO3 và K3PO4 → Nhận định hiện tượng
Giải chi tiết:
Xét ống 1: Chất trong ống (1) + Ca(OH)2 → Kết tủa trắng nên ống 1 chứa K3PO4
Xét ống 2: Chất trong ống (2) + Ca(OH)2 → Không hiện tượng nên ống 2 là NaNO3
Xét ống 3: Chất trong ống (3) + Ca(OH)2 → Khí mùi khai (NH3) và kết tủa trắng → chứa (NH4)2CO3
b.
2K3PO4 + 3Ca(OH)2 → Ca3(PO4)2↓ + 6KOH
(NH4)2CO3 + Ca(OH)2 → CaCO3↓ + 2NH3↑ + 2H2O
Câu 21:
Hòa tan hoàn toàn m gam Mg vào dung dịch HNO3 dư, thu được 336 ml khí NO2 (đktc, sản phẩm khử duy nhất). Tính giá trị của m.
 Xem đáp án
Xem đáp án
Phương pháp giải:
Tính theo PTHH: Mg + 4HNO3 → Mg(NO3)2 + 2NO2 + 3H2O
Giải chi tiết:
nNO2 = 015 mol
PTHH: Mg + 4HNO3 → Mg(NO3)2 + 2NO2 + 3H2O
0,0075 ← 0,015 mol
→ m = mMg = 0,0075.24 = 0,18 gam
Câu 22:
Một cái ao dùng để nuôi thủy sản chứa 5000 m3 nước có pH = 4,2. Trước khi nuôi, người ta làm tăng độ pH trong ao lên 7,0 bằng cách hòa m gam vôi sống (nguyên chất) vào nước trong ao. Tính giá trị m.
 Xem đáp án
Xem đáp án
Phương pháp giải:
Ta có: [H+] = 10-pH → nH+ = [H+] .V
PTHH: CaO + 2H+ → Ca2+ + H2O
Để pH = 7 thì toàn bộ H+ phản ứng hết với CaO nên nCaO = ½ nH+
Giải chi tiết:
Ta có: [H+] = 10-4,2 → nH+ = [H+] .V = 10-4,2 . 5000 . 103 = 315,48 mol
PTHH: CaO + 2H+ → Ca2+ + H2O
Để pH = 7 thì toàn bộ H+ phản ứng hết với CaO nên nCaO = ½ nH+ = 315,48 : 2 = 157,74 mol
→ m = mCaO = 157,74 . 56 = 8833,44 gam
