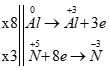Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 18)
-
6960 lượt thi
-
29 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
pH = -log[H+]
Do HCl là chất điện li mạnh nên ta có: [H+] = CM HCl
Giải chi tiết:
nHCl = 2,24.10-3 : 22,4 = 10-4 mol
=> CM HCl = nHCl : V dd = 10-4 : 0,1 = 10-3 (M)
Do HCl là chất điện li mạnh nên ta có: [H+] = CM HCl = 10-3 (M)
=> pH = -log[H+] = -log(10-3) = 3
Câu 2:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Tính theo PTHH: CaCO3 → CaO + CO2
Giải chi tiết:
CaCO3 → CaO + CO2
100 tấn → 56 tấn
x tấn ← 5,6 tấn
=> x = 5,6.100 : 56 = 10 tấn
Nhưng do hiệu suất phản ứng đạt 95% nên lượng CaCO3 thực tế cần dùng là: 10.100/95 = 10,526 tấn
Câu 3:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Quan sát Chọn đáp án ta thấy 2 trường hợp sau:
TH1: MNO3 → MNO2
TH2: 2M(NO3)n → M2On
Giải chi tiết:
Quan sát Chọn đáp án ta thấy 2 trường hợp sau:
TH1: MNO3 → MNO2
M + 62 → M + 46 (gam)
9,4 4 (gam)
=> 4(M + 62) = 9,4.(M + 46) => M = -34,14 (loại)
TH2: 2M(NO3)n → M2On
2(M+62n) 2M+16n
9,4 4
=> 8(M+62n) = 9,4.(2M+16n) => M = 32n
Ta thấy: n = 2 => M = 64 (Cu)
=> Muối đã dùng là Cu(NO3)2
Câu 4:
Một chất Y có tính chất sau:
- Không màu, rất độc.
- Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
 Xem đáp án
Xem đáp án
Chọn đáp án B
CO là khí có những tính chất thỏa mãn với đề bài:
- Không màu, rất độc
- Cháy trong không khí với ngọn lửa màu xanh và sinh ra khí làm đục nước vôi trong:
2CO + O2 → 2CO2 (nhiệt độ)
CO2 + Ca(OH)2 → CaCO3 + H2O
Câu 5:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Áp dụng định luật bảo toàn điện tích.
Giải chi tiết:
Áp dụng định luật bảo toàn điện tích cho một dung dịch ta có:
n (+) = n (-) => nNa+ + 2nCa2+ = nHCO3- + nCl-
=> x + 2y = z + t
Câu 6:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Ba(OH)2 là một chất điện li mạnh, khi hòa tan vào nước điện li hoàn toàn thành các ion.
Ba(OH)2 → Ba2+ + 2OH-
Giải chi tiết:
Ba(OH)2 là một chất điện li mạnh, khi hòa tan vào nước điện li hoàn toàn thành các ion.
Ba(OH)2 → Ba2+ + 2OH-
5.10-4 → 10-3
=> pOH = -log[OH-] = -log(10-3) = 3
=> pH = 14 – pOH = 11
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Nhỏ từ từ đến dư các dung dịch vào BaCO3:
- Không hiện tượng => NaOH
- Kết tủa tan dần đến hết và sủi bọt khí => HCl
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
- Sủi bọt khí, sau phản ứng thu được kết tủa trắng:
BaCO3 + H2SO4 → BaSO4↓ + H2O + CO2↑
Câu 8:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Tính theo PTHH: CaCO3 → CaO + CO2 (nhiệt độ)
Giải chi tiết:
nCaCO3 = 200.90% = 180 kg
PTHH: CaCO3 → CaO + CO2 (nhiệt độ)
100 kg → 56 kg
180 kg → 100,8 kg
Do hiệu suất phản ứng là 90% nên lượng vôi sống thực tế thu được là: 100,8.90% = 90,72 kg
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án C
CO là một oxit trung tính nên không có khả năng tạo muối.
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Supephotphat đơn có thành phần là CaSO4 và Ca(H2PO4)2
Supephotphat kép có thành phần là Ca(H2PO4)2
Khi trộn supephotphat với vôi bột sẽ có phản ứng sau xảy ra:
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 ↓ + 4H2O
P trong phân bị kết tủa dưới dạng Ca3(PO4)2 => Làm giảm hàm lượng P2O5 trong phân bón
Câu 11:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Những dung dịch có môi trường axit làm quỳ tím chuyển thành đỏ.
Giải chi tiết:
A. Dung dịch BaCl2 tạo bởi axit mạnh HCl và bazo mạnh Ba(OH)2 => môi trường trung tính => không làm đổi màu quỳ tím
B. Dung dịch CuSO4 tạo bởi axit mạnh H2SO4 và bazo yếu Cu(OH)2 => môi trường axit => làm quỳ tím chuyển đỏ
C. Dung dịch Na2CO3 tạo bởi axit yếu H2CO3 và bazo mạnh NaOH => môi trường bazo => làm quỳ tím chuyển xanh
D. Dung dịch NH3 có môi trường bazo => làm quỳ tím chuyển xanh
Câu 12:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Thuốc muối có thành phần chính là NaHCO3, khi uống vào dạ dày thì NaHCO3 tác dụng với HCl có trong dạ dày theo PTHH sau:
NaHCO3 + HCl → NaCl + H2O + CO2
Câu 13:
 Xem đáp án
Xem đáp án
Chọn đáp án D
A loại vì H2SO4 đặc không phản ứng với NO3-
B loại vì không phản ứng
C loại vì phản ứng có thể tạo NH4NO3 ta không quan sát được hiện tượng
D đúng
PTHH: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Câu 14:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phân tử N2 có chứa 1 liên kết ba bền vững nên nitơ tương đối trơ ở nhiệt độ thường
Câu 15:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Chất trung tính khi cho vào nước không làm thay đổi pH của dung dịch.
Giải chi tiết:
A. Na2CO3 được tạo bởi bazo mạnh NaOH và axit yếu H2CO3 => môi trường bazo => làm pH tăng
B. Na2SO4 được tạo bởi bazo mạnh NaOH và axit mạnh H2SO4 => môi trường trung tính => không làm thay đổi pH
C. HCl có môi trường axit => làm pH giảm
D. NH4Cl được tạo bởi bazo yếu NH3 và axit mạnh HCl => môi trường axit => làm pH giảm
Câu 16:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Nguyên tắc để làm khô khí là dùng chất có tính hút ẩm, không phản ứng với chất cần làm khô.
Giải chi tiết:
+ A loại vì H2SO4 phản ứng với NH3: H2SO4 + 2NH3 → (NH4)2SO4
+ B đúng
+ C loại vì P2O5 phản ứng với NH3:
P2O5 + 3H2O → 2H3PO4
3NH3 + H3PO4 → (NH4)3PO4
+ D loại vì tạo Cu(OH)2 sau đó Cu(OH)2 phản ứng với NH3:
CuSO4 + 2NH3 + 2H2O → Cu(OH)2 + (NH4)2SO4
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
Câu 17:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Bài toán CO2 tác dụng với dung dịch kiềm:
Tính tỉ lệ:
+ (*) ≥ 2 => Chỉ tạo muối CO32-
+ 1 < (*) < 2 => Tạo muối CO32- và HCO3-
+ (*) ≤ 1 => Chỉ tạo muối HCO3-
Giải chi tiết:
nCO2 = 0,5 mol; nOH- = 2nBa(OH)2 = 0,8 mol
=> tạo 2 muối CO32- (x mol) và HCO3- (y mol)
BTNT “C” => nCO2 = nCO32- + nHCO3- => x + y = 0,5 (1)
BTĐT: 2nBa2+ = 2nCO32- + nHCO3- => 2x + y = 0,8 (2)
Giải (1) và (2) thu được x = 0,3 và y = 0,2
nBa2+ (0,4 mol) > nCO32- (0,3 mol) => CO32- hết, Ba2+ dư
=> nBaCO3 = nCO32- = 0,3 mol
Câu 18:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
Dựa vào phương pháp điều chế N2O trong phòng thí nghiệm.
Giải chi tiết:
Trong phòng thí nghiệm, người ta điều chế N2O bằng phương pháp nhiệt phân muối NH4NO3:
NH4NO3 N2O + 2H2O
Câu 19:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
pH = 1 => [H+] = 0,1M
Đặt thể tích dung dịch HCl 1M cần thêm vào là V (lít)
=> nHCl = V mol
Sau khi trộn với 90 ml H2O:
[H+] = CM HCl sau trộn = = 0,1M => V
Giải chi tiết:
pH = 1 => [H+] = 0,1M
Đặt thể tích dung dịch HCl 1M cần thêm vào là V (lít)
=> nHCl = V mol
Sau khi trộn với 90 ml H2O:
[H+] = CM HCl sau trộn = = 0,1M => V = 0,01 lít = 10 ml
Câu 20:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
Chất điện li là chất khi tan trong nước phân li thành các ion.
Giải chi tiết:
Axit clohidric khi tan trong nước phân li hoàn toàn thành các ion nên là chất điện li.
HCl → H+ + Cl-
Câu 21:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion:
MgCl2 → Mg2+ + 2Cl-
NaCl → Na+ + Cl-
Giải chi tiết:
nMgCl2 = 0,15.0,5 = 0,075 mol; nNaCl = 0,05.1 = 0,05 mol
MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion:
MgCl2 → Mg2+ + 2Cl-
0,075 → 0,15 (mol)
NaCl → Na+ + Cl-
0,05 → 0,05 (mol)
=> nCl- = 0,15 + 0,05 = 0,2 mol
=> [Cl-] = n : V = 0,2 : (0,15 + 0,05) = 1M
Câu 22:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
HS ghi nhớ một số hidroxit lưỡng tính thường gặp như: Al(OH)3, Zn(OH)2, Cr(OH)3, Sn(OH)2, …
Giải chi tiết:
Các hidroxit lưỡng tính là: (I) Al(OH)3; (IV) Zn(OH)2.
Câu 23:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Phương pháp giải:
Dựa vào phương pháp điều chế N2 trong phòng thí nghiệm.
Giải chi tiết:
Trong phòng thí nghiệm, người ta điều chế N2 bằng cách đun nóng dung dịch NaNO2 và NH4Cl:
NaNO2 + NH4Cl NaCl + N2 + 2H2O
Câu 24:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Tính tỉ lệ
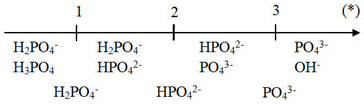
Qua sơ đồ ta thấy:
(*) ≤ 1 => tạo muối H2PO4-
1 < (*) < 2 => tạo muối H2PO4- và HPO42-
(*) = 2 => tạo muối HPO42-
2 < (*) < (3) => tạo muối HPO42- và PO43-
(*) ≤ 3 => tạo muối PO43-
Giải chi tiết:
Ta có: => tạo muối NaH2PO4 và Na2HPO4
Câu 25:
Viết phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch:
a) Na2CO3 + HCl
 Xem đáp án
Xem đáp án
Phương pháp giải:
Cách chuyển đổi từ phương trình dạng phân tử sang phương trình dạng ion rút gọn:
- Bước 1: Chuyển tất cả các chất vừa dễ tan và điện li mạnh thành ion. Giữ nguyên các chất khí, kết tủa hay chất điện li yếu.
- Bước 2: Lược bỏ những ion không tham gia phản ứng thu được phương trình ion rút gọn.
Giải chi tiết:
Phương trình phân tử: Na2CO3 + 2HCl → 2NaCl + H2O + CO2
Phương trình ion rút gọn: CO32- + 2H+ → H2O + CO2
Câu 27:
Hoàn thành các phương trình phản ứng sau:
a) Mg + HNO3 → ? + N2 + ?
 Xem đáp án
Xem đáp án
Phương pháp giải:
Điền những chất còn thiếu vào dấu “?” và cân bằng phản ứng bằng phương pháp thăng bằng electron.
Giải chi tiết:
a) 5Mg + 12HNO3 → 5Mg(NO3)2 + N2 + 6H2O
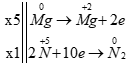
Câu 29:
Hòa tan hoàn toàn 20 gam hỗn hợp Cu và Fe bằng dung dịch HNO3 đặc nguội, dư thu được 8,96 lít khí NO2 (ở đktc, là sản phẩm khử duy nhất). Tính % khối lượng mỗi kim loại trong hỗn hợp đầu.
 Xem đáp án
Xem đáp án
Phương pháp giải:
Fe không phản ứng với HNO3 đặc, nguội. Chỉ có Cu phản ứng:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
Giải chi tiết:
nNO2 = 8,96 : 22,4 = 0,4 mol
Fe không phản ứng với HNO3 đặc, nguội. Chỉ có Cu phản ứng:
Cách 1: Tính theo PTHH
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
0,2 ← 0,4 (mol)
=> nCu = 0,2 mol => mCu = 0,2.64 = 12,8 gam
=> %mCu = = 64%; %mFe = 100 - 64 = 36%
Cách 2: Áp dụng phương pháp bảo toàn e
2nCu = nNO2 => nCu = 0,5nNO2 = 0,5.0,4 = 0,2 mol
=> mCu = 0,2.64 = 12,8 gam
=> %mCu = = 64%; %mFe = 100 - 64 = 36%