Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 24)
-
6965 lượt thi
-
15 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
HCl là một axit mạnh, điện li hoàn toàn.
pH = -log[H+]
Giải chi tiết:
HCl là một axit mạnh, điện li hoàn toàn:
HCl → H+ + Cl-
→ [H+] = CM HCl = 0,01M
→ pH = -log[H+] = -log(0,01) = 2
Câu 2:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Ruột bút chì được sản xuất từ than chì.
Câu 3:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5.
Ngoài ra, HS ghi nhớ thêm:
Độ dinh dưỡng của phân đạm được đánh giá bằng hàm lượng % của N.
Độ dinh dưỡng của phân kali được đánh giá bằng hàm lượng % của K2O.
Giải chi tiết:
Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng % của P2O5.
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Áp dụng định luật bảo toàn điện tích cho dung dịch Y.
Giải chi tiết:
Áp dụng định luật bảo toàn điện tích cho dung dịch Y ta có:
2nMg2+ + nNa+ = nCl- + 2nSO42- => 2.0,02 + 0,03 = 0,03 + 2.y
=> y = 0,02
Câu 5:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Trong phòng thí nghiệm người ta điều chế CO bằng phản ứng:
HCOOH CO + H2O
Câu 6:
Đối với dung dịch axit mạnh HNO3 0,1M nếu bỏ qua sự điện li của nước thì đánh giá nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Axit mạnh khi tan vào nước điện li hoàn toàn thành các ion.
Giải chi tiết:
HNO3 khi tan vào nước điện li hoàn toàn thành các ion:
HNO3 → H+ + NO3-
0,1M 0,1M 0,1M
=> [H+] = [NO3-] = 0,1M
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Phương pháp giải:
Phương pháp đường chéo, bảo toàn e, bảo toàn nguyên tố.
Giải chi tiết:
Khi thêm O2 vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2 bị hấp thụ khí còn lại là N2O và N2.
=> nNO = nNO2 = 0,3 – 0,2 = 0,1 mol
Áp dụng đường chéo cho hỗn hợp Z:
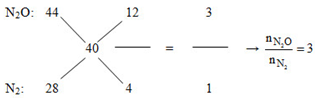
Mà nN2O + nN2 = nZ = 0,2 mol => nN2O = 0,15 và nN2 = 0,05
Đặt: nMg = 4x và nAl = 5x (mol) => nMg(OH)2 = 4x và mAl(OH)3 = 5x
m kết tủa max = mKL + mOH- => m + 39,1 = m + 17(4x.2 + 5x.3) => x = 0,1
=> nMg = 0,4 mol và nAl = 0,5 mol
Ta thấy: 2nMg + 3nAl > 3nNO + 8nN2O + 10nN2 => Có tạo muối NH4NO3
Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3
=> 2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3
=> nNH4NO3 = 0,0375 mol
Công thức tính nhanh: nHNO3 pư = 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 = 2,875 mol
=> nHNO3 bđ = 2,875 + 2,875.(20/100) = 3,45 mol
=> m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam
m dd sau pư = mMg + mAl + m dd HNO3 – mNO – mN2O – mN2
= 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam
Ta có: nAl(NO3)3 = nAl = 0,5 mol
→ %mAl = (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7%
Câu 8:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Giả sử hấp thụ CO2 vào dung dịch NaOH và Na2CO3 thu được CO32- (a mol) và HCO3- (b mol)
BTNT “C”: nCO2 + nNa2CO3 = nCO3 2- + nHCO3- => (1)
BTĐT: nNa+ = 2nCO32- + nHCO3- => (2)
Giải (1) và (2) thu được a và b
*Nhỏ từ từ HCl vào dd X (CO32- và HCO3-)
Thứ tự phản ứng:
H+ + CO32- → HCO3-
H+ + HCO3- → H2O + CO2
Giải chi tiết:
Giả sử hấp thụ CO2 vào dung dịch NaOH và Na2CO3 thu được CO32- (a mol) và HCO3- (b mol)
BTNT “C”: nCO2 + nNa2CO3 = nCO3 2- + nHCO3- => a + b = 0,1 + 0,1 => a + b = 0,2 (1)
BTĐT: nNa+ = 2nCO32- + nHCO3- => 2a + b = 0,08 + 2.0,1 => 2a + b = 0,28 (2)
Giải (1) và (2) thu được a = 0,08 và b = 0,12 mol
*Nhỏ từ từ HCl vào dd X (0,08 mol CO32- và 0,12 mol HCO3-)
Thứ tự phản ứng:
H+ + CO32- → HCO3-
0,08← 0,08
H+ + HCO3- → H2O + CO2
0,08 ← 0,08
=> nHCl = 0,08 + 0,08 = 0,16 mol
Câu 9:
Viết các phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch giữa các cặp chất sau.
a) NaOH + HCl Xem đáp án
Xem đáp án
Phương pháp giải:
Cách chuyển đổi từ phương trình dạng phân tử sang phương trình dạng ion rút gọn:
- Bước 1: Chuyển tất cả các chất vừa dễ tan và điện li mạnh thành ion. Giữ nguyên các chất khí, kết tủa hay chất điện li yếu.
- Bước 2: Lược bỏ những ion không tham gia phản ứng thu được phương trình ion rút gọn.
Giải chi tiết:
a)
Phương trình phân tử: NaOH + HCl → NaCl + H2O
Phương trình ion rút gọn: OH- + H+ → H2O
Câu 10:
 Xem đáp án
Xem đáp án
b)
Phương trình phân tử: Na2CO3 + Ca(NO3)2 → CaCO3↓ + 2NaNO3
Phương trình ion rút gọn: Ca2+ + CO32- → CaCO3↓
Câu 11:
 Xem đáp án
Xem đáp án
c)
Phương trình phân tử: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
Phương trình ion rút gọn: Cu2+ + 2OH- → Cu(OH)2↓
Câu 12:
d) Al(OH)3 + NaOH
 Xem đáp án
Xem đáp án
d)
Phương trình phân tử: Al(OH)3 + NaOH → NaAlO2 + 2H2O
Phương trình ion rút gọn: Al(OH)3 + OH- → AlO2- + 2H2O
Câu 13:
Cho 224 ml khí CO2 (đktc) hấp thụ hết trong 100 ml dung dịch KOH 0,2M. Viết phương trình phản ứng và tính khối lượng của những chất có trong dung dịch tạo thành.
 Xem đáp án
Xem đáp án
Phương pháp giải:
Bài toán CO2 tác dụng với dung dịch kiềm:
Tính tỉ lệ:
+ (*) ≥ 2 => Chỉ tạo muối CO32-
+ 1 < (*) < 2 => Tạo muối CO32- và HCO3-
+ (*) ≤ 1 => Chỉ tạo muối HCO3-
Giải chi tiết:
nCO2 = 0,224 : 22,4 = 0,01 mol; nKOH = 0,1.0,2 = 0,02 mol
nKOH : nCO2 = 0,02 : 0,01 = 2 => Chỉ tạo muối K2CO3
PTHH: CO2 + 2KOH → K2CO3
0,01 0,02 0,01
Dung dịch tạo thành có chứa K2CO3 => mK2CO3 = 0,01.138 = 1,38 gam
Câu 14:
Khi hòa tan 35,2 gam hỗn hợp Cu và CuO trong 2,0 lít dung dịch HNO3 1,0M (loãng) thấy thoát ra 4,48 lít NO (đktc).
a) Xác định hàm lượng phần trăm của CuO trong hỗn hợp.
b) Tính nồng độ mol của Cu(NO3)2 và axit HNO3 của dung dịch sau phản ứng, biết rằng thể tích của dung dịch không thay đổi.
 Xem đáp án
Xem đáp án
Phương pháp giải:
a)
Bảo toàn e ta có: 2nCu = 3nNO => nCu
=> mCuO = m hỗn hợp – mCu
=> %mCuO
b)
BTNT “Cu”: nCu(NO3)2 = nCu + nCuO
BTNT “N”: nHNO3 dư = nHNO3 bđ – 2nCu(NO3)2 – nNO
Giải chi tiết:
a) nHNO3 = 2 mol; nNO = 0,2 mol
Bảo toàn e ta có: 2nCu = 3nNO => nCu = 1,5nNO = 1,5.0,2 = 0,3 mol
=> mCuO = m hỗn hợp – mCu = 35,2 – 0,3.64 = 16 gam => nCuO = 16 : 80 = 0,2 mol
=> %mCuO = (16 : 35,2).100% = 45,45%
b)
BTNT “Cu”: nCu(NO3)2 = nCu + nCuO = 0,3 + 0,2 = 0,5 mol
BTNT “N”: nHNO3 dư = nHNO3 bđ – 2nCu(NO3)2 – nNO = 2 – 2.0,5 – 0,2 = 0,8 mol
=> CM Cu(NO3)2 = 0,5 : 2 = 0,25M
=> CM HNO3 = 0,8 : 2 = 0,4M
Câu 15:
Từ quặng photphorit, có thể điều chế axit photphoric theo sơ đồ sau:
Quặng photphorit
Biết hiệu suất chung của cả quá trình là 90%. Để điều chế được 1 tấn dung dịch H3PO4 49%, cần khối lượng quặng photphorit chứa 73% Ca3(PO4)2 là bao nhiêu?
 Xem đáp án
Xem đáp án
Phương pháp giải:
Tính theo sơ đồ:
Giải chi tiết:
Ta có sơ đồ sau:
Lượng quặng photphorit cần dùng là: m = 1.(49/100):98:2.310.(100/90).(100/73) = 1,18 tấn
