Bộ 30 đề thi học kì 1 Hóa 11 có đáp án (Đề 23)
-
6966 lượt thi
-
13 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Chọn đáp án D
C2H5OH khi tan trong nước không phân li ra ion.
Câu 2:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Dựa vào khái niệm chất điện li mạnh: Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion.
Giải chi tiết:
Chất điện li mạnh là chất khi tan trong nước, các phân tử hòa tan đều phân li thành ion (tức α=1).
Câu 3:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Tính pH của dung dịch: pH = -log[H+]
+ pH < 7 => môi trường axit
+ pH = 7 => môi trường trung tính
+ pH > 7 => môi trường bazo
Chú ý: Không có môi trường lưỡng tính.
Giải chi tiết:
pH = -log[H+] = -log(5.10-4) = 3,3
Ta thấy pH < 7 nên dung dịch X có môi trường axit
Câu 4:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Do phân tử N2 có chứa liên kết 3 rất bền vững, không phân cực và có năng lượng lớn nên N2 tương đối trơ về mặt hóa học ở điều kiện thường.
Câu 5:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Dựa vào phương pháp nhận biết ion PO43- bằng phương pháp hóa học.
Giải chi tiết:
Ta dùng ion Ag+ để nhận biết ion PO43- do tạo kết tủa màu vàng:
Ag+ + PO43- → Ag3PO4 ↓ vàng
Câu 6:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
- Supephotphat đơn: Ca(H2PO4)2 và CaSO4
- Supephotphat kép: Ca(H2PO4)2
Giải chi tiết:
Thành phần hóa học chính của phân lân supephotphat kép là Ca(H2PO4)2.
Câu 7:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Ure (NH2)2CO là phân bón có thành phần N lớn nhất.
Câu 8:
 Xem đáp án
Xem đáp án
Chọn đáp án B
Phương pháp giải:
Tính tỉ lệ
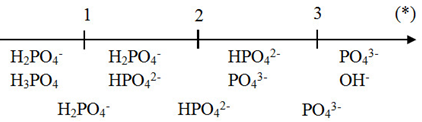
Giải chi tiết:
=> Muối Na2HPO4
Câu 9:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Dung dịch có môi trường axit làm quỳ tím chuyển đỏ.
Cách đánh giá môi trường của một dung dịch muối:
- Muối được tạo từ axit mạnh + bazo mạnh => Môi trường trung tính
- Muối được tạo bởi axit mạnh + bazo yếu => Môi trường axit
- Muối được tạo bởi axit yếu + bazo mạnh => Mối trường bazo
Chú ý: Không có môi trường lưỡng tính
Giải chi tiết:
NH4Cl được tạo bởi bazo yếu (NH3) và axit mạnh HCl nên có môi trường axit => làm quỳ tím chuyển đỏ.
Câu 10:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Phương pháp giải:
Nắm được phản ứng nhiệt phân các muối nitrat của KL:
- Muối của KL kiềm (K, Na, …), kiềm thổ (Ca, Ba, …) phân hủy thành muối nitrit + O2.
- Muối của Mg, Zn, Fe, ..., Cu phân hủy thành oxit kim loại + NO2 + O2.
- Muối của các kim loại Ag, Au, Hg, … bị phân hủy thành các kim loại tương ứng + NO2 + O2.
Giải chi tiết:
2AgNO3 2Ag + 2NO2 + O2
Câu 11:
Trộn 500 ml dung dịch HNO3 0,02M với 500 ml dung dịch NaOH 0,04M thu được dung dịch X. Tính pH của dung dịch X.
 Xem đáp án
Xem đáp án
Phương pháp giải:
- Tính nH+; nOH-
- Viết PTHH dưới dạng ion
- Tính toán theo PTHH
- Tính pH của dung dịch thu được sau phản ứng
Giải chi tiết:
nH+ = nHNO3 = 0,02.0,5 = 0,01 mol
nOH- = nNaOH = 0,04.0,5 = 0,02 mol
H+ + OH- → H2O
Bđ: 0,01 0,02 (mol)
Pư: 0,01→0,01 (mol)
Sau: 0 0,01 (mol)
[OH-] = n/V = 0,01/(0,5 + 0,5) = 0,01M
=> pOH = -log[OH-] = -log(0,01) = 2
=> pH = 14 – pOH = 14 – 2 = 12
Vậy pH của dung dịch thu được sau phản ứng là 12.
Câu 12:
Hòa tan hoàn toàn 3,04 gam hỗn hợp X gồm (Fe, Cu) tác dụng hoàn toàn với dung dịch HNO3 loãng dư, sau phản ứng thu được 0,896 lít khí NO (sản phẩm khử duy nhất, ở đktc). Tính khối lượng mỗi kim loại trong hỗn hợp X?
 Xem đáp án
Xem đáp án
Phương pháp giải:
Cách 1: Viết và tính toán theo PTHH:
Đặt ẩn là số mol của Fe và Cu. Dựa vào dữ kiện đề bài để lập hệ phương trình.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Cách 2: Sử dụng định luật bảo toàn electron:
Đặt ẩn là số mol của Fe và Cu. Dựa vào dữ kiện đề bài để lập hệ phương trình.
Giải chi tiết:
nNO = 0,896/22,4 = 0,04 mol
Cách 1: Viết và tính toán theo PTHH
Đặt x, y lần lượt là số mol của Fe và Cu
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
x → x (mol)
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
y → 2y/3 (mol)
- Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1)
- Số mol khí NO thu được: nNO = x + 2y/3 = 0,04 (2)
Giải (1) và (2) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Cách 2: Sử dụng định luật bảo toàn electron:
- Khối lượng hỗn hợp: m hh = 56x + 64y = 3,04 (1’)
- Định luật bảo toàn e: 3nFe + 2nCu = 3nNO => 3x + 2y = 3.0,04 (2’)
Giải (1’) và (2’) thu được x = 0,02 mol và y = 0,03 mol
Trong hỗn hợp ban đầu: mFe = 0,02.56 = 1,12 gam và mCu = 0,03.64 = 1,92 gam
Câu 13:
Phản ứng của thuốc nổ đen: 2KNO3 + 3C + S 3CO2 + N2 + K2S; ΔH < 0
Tính phần trăm theo khối lượng các chất trong thuốc nổ đen, biết rằng thuốc nổ đen được trộn theo đúng tỉ lệ phản ứng. Khi đốt 1 kg thuốc nổ đen có thể tạo thành khối khí có thể tích bao nhiêu (ở 2730C và 1 atm).
 Xem đáp án
Xem đáp án
Phương pháp giải:
Tính toán theo PTHH.
Giải chi tiết:
Hỗn hợp thuốc nổ đen gồm KNO3, C, S với tỉ lệ mol tương ứng là 2 : 3 : 1.
* Tính phần trăm theo khối lượng các chất trong thuốc nổ đen:
*Tính thể tích khí sinh ra khi đốt 1 kg thuốc nổ đen:
Thể tích khí thu được ở 273oC và p = 1 atm:
