(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Vĩnh Phúc (Lần 2) có đáp án
(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Vĩnh Phúc (Lần 2) có đáp án
-
232 lượt thi
-
42 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 3:
Để loại bỏ lớp cặn trong ấm đun nước hiệu quả (thành phần chính là CaCO3), ta thường dùng chất nào sau đây?
 Xem đáp án
Xem đáp án
Để loại bỏ lớp cặn trong ấm đun nước lâu ngày, người ta có thể dùng giấm ăn vì giấm ăn chứa CH3COOH hòa tan cặn (CaCO3):
CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
Chọn C
Câu 6:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, trùng hợp metyl metacrylat thu được poli(metyl metacrylat).
B. Đúng
C. Sai, đa số polime không tan trong các dung môi thông thường.
D. Sai, tơ xenlulozơ axetat và tơ visco đều là tơ bán tổng hợp.
Chọn B
Câu 7:
Từ 3,24 kg tinh bột thì điều chế được bao nhiêu lít dung dịch ancol etylic 46°. Biết hiệu suất điều chế là 80% và khối lượng riêng của C2H5OH là 0,8 g/ml.
 Xem đáp án
Xem đáp án
(C6H10O5)n → nC6H12O6 → 2nC2H5OH
→ mC2H5OH thực tế = 80%.3,24.46.2/162 = 1,472 kg
→ VC2H5OH = 1,472/0,8 = 1,84 lít
→ VddC2H5OH = 1,84/46% = 4 lít
Chọn D
Câu 8:
Để xử lí các khí thải như CO2, SO2, H2S người ta thường sử dụng dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Để xử lí các khí thải như CO2, SO2, H2S người ta thường sử dụng dung dịch Ca(OH)2:
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O
H2S + Ca(OH)2 → CaS + H2O
Chọn B
Câu 11:
Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch nào sau đây sinh ra muối sắt(III)?
 Xem đáp án
Xem đáp án
Chọn B
Câu 15:
Dung dịch nào sau đây tác dụng với Al(OH)3?
 Xem đáp án
Xem đáp án
Dung dịch NaOH tác dụng với Al(OH)3:
Al(OH)3 + NaOH → NaAlO2 + H2O
Chọn A
Câu 16:
Cho thanh kim loại Zn vào dung dịch chất nào sau đây chỉ xảy ra hiện tượng ăn mòn hóa học?
 Xem đáp án
Xem đáp án
Cho thanh kim loại Zn vào dung dịch HCl chỉ xảy ra hiện tượng ăn mòn hóa học:
Zn + 2HCl → ZnCl2 + H2
Thanh Zn bị ăn mòn hóa học và ăn mòn điện hóa khi cho vào dung dịch còn lại.
Chọn B
Câu 18:
Hòa tan hết 4 gam hỗn hợp gồm MgO và Ca cần vừa đủ V ml dung dịch HCl 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
MgO + 2HCl → MgCl2 + H2O
Ca + 2HCl → CaCl2 + H2
n hỗn hợp = 4/40 = 0,1 → nHCl = 0,2 → V = 200 ml
Chọn B
Câu 22:
Thí nghiệm nào sau đây không xảy ra phản ứng?
 Xem đáp án
Xem đáp án
A. Na + H2O → NaOH + H2
NaOH + CuSO4 → Cu(OH)2 + Na2SO4
B. Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
C. Không phản ứng
D. Fe + Fe(NO3)3 → Fe(NO3)2
Chọn C
Câu 23:
Kim loại nào sau đây có khả năng dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Độ dẫn điện: Ag > Cu > Au > Al > Fe → Kim loại dẫn điện tốt nhất là Ag.
Chọn C
Câu 26:
Cho 3,1 gam metylamin tác dụng hết với dung dịch HCl thì khối lượng muối thu được là
 Xem đáp án
Xem đáp án
CH3NH2 + HCl → CH3NH3Cl
nHCl = nCH3NH2 = 0,1
→ m muối = mCH3NH2 + mHCl = 6,75 gam
Chọn A
Câu 27:
Cho các phát biểu sau:
(a) Khi tham gia phản ứng tráng bạc, glucozơ bị oxi hóa thành axit gluconic.
(b) Ở dạng mạch hở, fructozơ chứa 5 nhóm OH đều cạnh nhau và 1 nhóm CO.
(c) Cao su thiên nhiên tan trong dung môi xăng, benzen.
(d) Đipeptit Glu-Val có 5 nguyên tử oxi trong phân tử.
(e) Tơ nilon-6,6 được điều chế từ phản ứng trùng ngưng hexametylenđiamin và axit terephtalic.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, khi tham gia phản ứng tráng bạc, glucozơ bị oxi hóa thành muối amoni gluconat.
(b) Sai, fructozơ chỉ có 4 nhóm OH cạnh nhau.
(c) Đúng
(d) Đúng, số O = 4 + 2 – 1 = 5
(e) Sai, tơ nilon-6,6 được điều chế từ phản ứng trùng ngưng hexametylenđiamin và axit adipic.
Chọn A
Câu 28:
Cho kim loại Fe lần lượt phản ứng với dung dịch các chất riêng biệt sau: H2SO4 loãng, CuCl2, Fe(NO3)2, AgNO3, NaCl. Số trường hợp có phản ứng hóa học xảy ra là
 Xem đáp án
Xem đáp án
Có 3 trường hợp xảy ra phản ứng:
Fe + H2SO4 loãng → FeSO4 + H2
Fe + CuCl2 → FeCl2 + Cu
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Chọn D
Câu 29:
Butagas là một loại khí gas dùng trong sinh hoạt, có hàm lượng phần trăm theo khối lượng các chất như sau: butan 99,4% còn lại là pentan. Khi đốt cháy 1 mol butan, 1 mol pentan thì nhiệt lượng tỏa ra lần lượt là 2654 kJ và 3600 kJ. Để nâng nhiệt độ của 1 gam nước (D = 1 gam/ml) lên 1°C cần 4,16 J. Khối lượng gas cần dùng để đun sôi 2 lít nước nói trên từ 20°C – 100°C là
 Xem đáp án
Xem đáp án
Lượng gas cần dùng chứa C4H10 (x mol) và C5H12 (y mol)
→ mC4H10 = 58x = 99,4%(58x + 72y)
Bảo toàn năng lượng:
2654.10³x + 3600.10³y = 2000.1.4,16(100 – 20)
→ x = 0,24915; y = 0,00121
→ mGas = 58x + 72y = 14,54 gam
Chọn D
Câu 30:
Tiến hành các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Hấp thụ hết 2 mol CO2 vào dung dịch chứa 3 mol NaOH.
(c) Cho KHS tác dụng với dung dịch NaOH theo tỉ lệ mol 1:1
(d) Cho Fe3O4 tác dụng với dung dịch HNO3 đặc, nóng, dư.
(e) Hòa tan hết Mg vào dung dịch HNO3 không thấy khí thoát ra.
Số thí nghiệm thu được 2 muối là
 Xem đáp án
Xem đáp án
(a) Cl2 + 2NaOH → NaCl + NaClO + H2O
(b) nNaOH/nCO2 = 1,5 → Tạo 2 muối
(c) 2KHS + 2NaOH → K2S + Na2S + 2H2O
(d) Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
(e) 4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 + 3H2O
Chọn A
Câu 31:
Hỗn hợp E gồm các triglixerit và axit béo tự do (không có tạp chất khác), trong E nguyên tố oxi chiếm 10,9777% theo khối lượng. Xà phòng hóa hoàn toàn m gam E bằng dung dịch NaOH dư đun nóng, sau phản ứng thu được dung dịch chứa 133,38 gam hỗn hợp muối (C15H31COONa, C17H35COONa, C17H33COONa, C17H31COONa) và 11,04 gam glixerol. Đốt cháy hoàn toàn m gam E cần dùng 11,625 mol O2. Mặt khác, m gam E phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
nC3H5(OH)3 = 0,12
Quy đổi E thành HCOOH (x), CH2 (y), H2 (z), C3H5(OH)3 (0,12) và H2O (-0,12.3 = -0,36)
m muối = 68x + 14y + 2z = 133,38
nO2 = 0,5x + 1,5y + 0,5z + 3,5.0,12 = 11,625
mO = 16.2x = 10,9777%(46x + 14y + 2z + 0,12.92 – 0,36.18)
→ x = 0,44; y = 7,44; z = -0,35
→ a = -z = 0,35
Chọn D
Câu 32:
Mỗi hecta đất trồng ngô, người nông dân cần cung cấp 86 kg N; 40 kg P2O5 và 210 kg K2O. Loại phân mà người nông dân sử dụng là phân hỗn hợp NPK (20 – 20 – 15) trộn với phân kali KCl (độ dinh dưỡng 60%) và ure (độ dinh dưỡng 46%). Tổng khối lượng phân bón đã sử dụng cho 1 hecta đất trồng ngô là
 Xem đáp án
Xem đáp án
m phân hỗn hợp = a kg
m phân kali = b kg
m phân urê = c kg
mN = 20%a + 46%c = 86
mP2O5 = 20%a = 40
mK2O = 15%a + 60%b = 210
→ a = 200; b = 300; c = 100
→ a + b + c = 600 kg
Chọn D
Câu 33:
Este X có công thức phân tử C4H6O2, sau khi thủy phân thu được sản phẩm có khả năng tham gia phản ứng tráng bạc. Số công thức cấu tạo thỏa mãn tính chất của X là
 Xem đáp án
Xem đáp án
X có 4 cấu tạo:
HCOO-CH=CH-CH3 → HCOOH + CH3-CH2-CHO
HCOO-CH2-CH=CH2 → HCOOH + CH2=CH-CH2OH
HCOO-C(CH3)=CH2 → HCOOH + CH3-CO-CH3
CH3-COO-CH=CH2 → CH3COOH + CH3CHO
Sản phẩm in đậm là chất tham gia tráng gương.
Chọn C
Câu 34:
Điện phân dung dịch chứa đồng thời NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi nước) với cường độ dòng điện không đổi. Kết quả của thí nghiệm được ghi ở bảng sau:
|
Thời gian (s) |
Khối lượng catot tăng |
Anot |
Khối lượng dung dịch giảm |
|
t1 = 1544 |
m (gam) |
Một khí duy nhất |
5,4 (gam) |
|
t2 = 4632 |
3m (gam) |
Hỗn hợp khí |
15,1 (gam) |
|
t |
4,5m (gam) |
Hỗn hợp khí |
20,71 (gam) |
Giá trị của t là
 Xem đáp án
Xem đáp án
Trong 1544 giây: nCu = nCl2 = a
→ m giảm = 64a + 71a = 5,4 → a = 0,04
→ m = 64a = 2,56
ne trong 1544s = 2nCu = 0,08 (1)
Trong 4632 giây: nCu = 3a = 0,12; nCl2 = u và nO2 = v
m giảm = 0,12.64 + 71u + 32v = 15,1
Bảo toàn electron → 0,12.2 = 2u + 4v
→ u = 0,1 và v = 0,01
Trong t giây: nCu = 4,5a = 0,18; nH2 = x; nCl2 = 0,1 và nO2 = y
m giảm = 0,18.64 + 2x + 0,1.71 + 32y = 20,71
Bảo toàn electron → 0,18.2 + 2x = 0,1.2 + 4y
→ x = 0,045; y = 0,0625
→ ne trong t giây = 0,18.2 + 2x = 0,45 (2)
(1)(2) → 1544.0,45 = 0,08t
→ t = 8685s
Chọn B
Câu 35:
Hỗn hợp E gồm Fe, Fe3O4, Fe2O3 và FeS2. Nung 19,36 gam E trong bình kín chứa 0,245 mol O2 thu được chất rắn X (chỉ gồm Fe và các oxit) và 0,15 mol khí SO2. Hòa tan hết X trong dung dịch HCl nồng độ 5,84% thu được 0,075 mol H2 và dung dịch Y chỉ chứa muối. Cho tiếp dung dịch AgNO3 dư vào Y thu được 102,3 gam kết tủa gồm Ag và AgCl. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của muối FeCl2 trong Y gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
X còn Fe dư nên O2 đã phản ứng hết.
Bảo toàn khối lượng → mX = 17,6
Y gồm FeCl2 (a), FeCl3 (b)
→ m↓ = 143,5(2a + 3b) + 108a = 102,3 (1)
nH2O = nO(X) = c
→ mX = 56(a + b) + 16c = 17,6 (2)
Bảo toàn electron: 3(a + b) = 2c + a + 0,075.2 (3)
(1)(2)(3) → a = 0,15; b = 0,1; c = 0,225
nHCl = 2nH2 + 2nH2O = 0,6
mddY = mX + mddHCl – mH2 = 392,45
→ C%FeCl2 = 4,85%
Chọn D
Câu 36:
Cho các hợp chất hữu cơ no, mạch hở sau: X và Y (có cùng số mol) là hai axit cacboxylic đơn chức, kế tiếp nhau trong dãy đồng đẳng, Z là ancol ba chức (có số nguyên tử cacbon nhỏ hơn 5). Đun 5 mol hỗn hợp E gồm X, Y, Z với xúc tác H2SO4 đặc (giả sử chỉ xảy ra phản ứng este hóa với hiệu suất 50% được tính theo hai axit X và Y) thu được 3,5 mol hỗn hợp F gồm X, Y, Z và các sản phẩm hữu cơ (chỉ chứa nhóm chức este). Tiến hành các thí nghiệm sau:
+ Thí nghiệm 1: Cho a mol F tác dụng với Na dư, sau phản ứng hoàn toàn thu được 0,6 mol khí H2.
+ Thí nghiệm 2: Đốt cháy hoàn toàn (a + 0,35) mol F cần vừa đủ 5,925 mol khí O2 thu được CO2 và H2O.
Phần trăm khối lượng của các este trong F có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nH2O = nE – nF = 1,5
→ nCxH2xO2 = 1,5/50% = 3 và nCyH2y+2O3 = 5 – 3 = 2
-COOH + -OH → -COO- + H2O
→ nH linh động giảm = nH2O = 1,5
Nếu cho 3,5 mol F tác dụng với Na thì thu được nH = 3 + 2.3 – 1,5 – 1,5 = 6
Cho a mol F tác dụng với Na thu được nH = 0,6.2 = 1,2
→ a = 1,2.3,5/6 = 0,7
Đốt a + 0,35 = 1,05 mol F cần nO2 = 5,925
→ Đốt 3,5 mol F cần nO2 = 19,75
Đốt 5 mol E tốn O2 giống như đốt 3,5 mol F nên:
nO2 = 3(1,5x – 1) + 2(1,5y – 1) = 19,75
→ 3x + 2y = 16,5
nX = nY nên x lấy các giá trị 1,5 – 2,5 – 3,5….
Mặt khác 3 ≤ y < 5 nên x = 3,5; y = 3 là nghiệm duy nhất.
mF = mE – mH2O = 3(14x + 32) + 2(14y + 50) – 1,5.18 = 400
Este dạng (CxH2x-1O2)3C3H5 (1,5/3 = 0,5 mol)
→ %Este = 0,5(42x + 134)/400 = 35,125%
Chọn A
Câu 37:
Nung 21,6 gam hỗn hợp Mg và Fe trong không khí, thu được 27,2 gam hỗn hợp rắn X. Hòa tan hết X cần vừa đủ 550 ml dung dịch HCl 2M, thu được V lít khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
nH2O = nO = (mX – m kim loại)/16 = 0,35
nHCl = 1,1 = 2nH2O + 2nH2
→ nH2 = 0,2 → V = 4,48 lít
Chọn C
Câu 38:
Nung 21,6 gam hỗn hợp Mg và Fe trong không khí, thu được 27,2 gam hỗn hợp rắn X. Hòa tan hết X cần vừa đủ 550 ml dung dịch HCl 2M, thu được V lít khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
nH2O = nO = (mX – m kim loại)/16 = 0,35
nHCl = 1,1 = 2nH2O + 2nH2
→ nH2 = 0,2 → V = 4,48 lít
Chọn C
Câu 39:
Cho dãy chuyển hoá (mỗi ký hiệu là 1 chất):
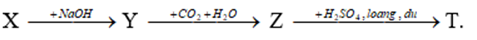
Biết T có phân tử khối lớn hơn 60; X và Z được dùng làm bột nở trong công nghiệp thực phẩm; Z được dùng làm thuốc chữa đau dạ dày do thừa axit.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
X và Z được dùng làm bột nở trong công nghiệp thực phẩm → X là (NH4)2CO3 và Z là NaHCO3
Y là Na2CO3; MT > 60 nên T là Na2SO4
A. Đúng: CO32- + M2+ → MCO3 (M là Mg, Ca)
B. Đúng
C. Đúng: (NH4)2CO3 → NH3 + CO2 + H2O
D. Sai: NaHCO3 → Na2CO3 + CO2 + H2O
Chọn D
Câu 40:
Cho dãy chuyển hoá (mỗi ký hiệu là 1 chất):
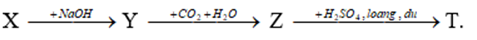
Biết T có phân tử khối lớn hơn 60; X và Z được dùng làm bột nở trong công nghiệp thực phẩm; Z được dùng làm thuốc chữa đau dạ dày do thừa axit.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
X và Z được dùng làm bột nở trong công nghiệp thực phẩm → X là (NH4)2CO3 và Z là NaHCO3
Y là Na2CO3; MT > 60 nên T là Na2SO4
A. Đúng: CO32- + M2+ → MCO3 (M là Mg, Ca)
B. Đúng
C. Đúng: (NH4)2CO3 → NH3 + CO2 + H2O
D. Sai: NaHCO3 → Na2CO3 + CO2 + H2O
Chọn D
Câu 41:
Cho E (C4H8O3) và F (C4H6O5) là các chất hữu cơ mạch hở. Trong phân tử chất F chứa đồng thời các nhóm -OH, -COO và -COOH. Cho các chuyển hóa sau:
(1) E + NaOH → X + Y
(2) F + NaOH → X + H2O
(3) X + HCl → Z + NaCl
Biết X, Y, Z là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) Chất X có số nguyên tử oxi bằng số nguyên tử hiđro.
(b) Phân tử chất E chứa đồng thời nhóm -OH và nhóm -COOH.
(c) Trong công nghiệp, chất Y được điều chế trực tiếp từ etilen.
(d) Nhiệt độ sôi của chất Y nhỏ hơn nhiệt độ sôi của ancol metylic.
(e) 1 mol chất Z tác dụng với Na dư thu được tối đa 1 mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
F chứa đồng thời các nhóm -OH, -COO và -COOH nên F là HO-CH2-COO-CH2-COOH
→ X là HO-CH2-COONa; Z là HO-CH2-COOH
E là HO-CH2-COO-C2H5; Y là C2H5OH
(a) Đúng, X là C2H3O3Na
(b) Sai, E chứa đồng thời -OH và -COO-
(c) Đúng: C2H4 + H2O → C2H5OH
(d) Sai, C2H5OH có nhiệt độ sôi lớn hơn CH3OH do phân tử khối lớn hơn.
(e) Đúng, Z có 2H linh động nên 1 mol chất Z tác dụng với Na dư thu được tối đa 1 mol khí H2.
Chọn D
Câu 42:
Khi cho 0,15 mol este đơn chức X tác dụng với dung dịch vừa đủ với 12 gam NaOH sau khi phản ứng kết thúc tổng khối lượng sản phẩm hữu cơ thu được là 29,7 gam. Số nguyên tử hiđro trong phân tử X là
 Xem đáp án
Xem đáp án
nX = 0,15 và nNaOH = 0,3 → nX : nNaOH = 1 : 2 → X là este của phenol
→ nH2O = nX = 0,15
Bảo toàn khối lượng → mX = 29,7 + 0,15.18 – 12 = 20,4
→ MX = 20,4/0,15 = 136: C8H8O2
Chọn A
