(2023) Đề thi thử Hóa học THPT Cù Huy Cận, Hà Tĩnh có đáp án
(2023) Đề thi thử Hóa học THPT Cù Huy Cận, Hà Tĩnh có đáp án
-
201 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Chất nào sau đây phản ứng với dung dịch H2SO4 đặc, nóng sinh ra khí SO2?
 Xem đáp án
Xem đáp án
FeO phản ứng với dung dịch H2SO4 đặc, nóng sinh ra khí SO2:
2FeO + 4H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 4H2O
Chọn D
Câu 3:
Chất nào sau đây là muối axit?
 Xem đáp án
Xem đáp án
NaHCO3 là muối axit vì gốc axit có khả năng nhường H+.
Chọn A
Câu 5:
Cho thanh kim loại Fe vào dung dịch chất nào sau đây sẽ xảy ra hiện tượng ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Nhúng thanh sắt vào dung dịch CuSO4 có xảy ra sự ăn mòn điện hoa học:
Fe + CuSO4 → FeSO4 + Cu
Cu sinh ra bám vào thanh Fe tạo cặp điện cực Fe-Cu tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hoa học.
Chọn B
Câu 7:
Trong phản ứng của kim loại Fe với khí Cl2, một nguyên tử Fe nhường bao nhiêu electron?
 Xem đáp án
Xem đáp án
Một nguyên tử Fe nhường 3 electron:
Fe → Fe+3 + 3e
Chọn B
Câu 9:
Chất nào sau đây có khả năng làm mềm được nước cứng vĩnh cửu?
 Xem đáp án
Xem đáp án
Na3PO4 có khả năng làm mềm nước cứng vĩnh cửu do loại bỏ được Ca2+, Mg2+ ra khỏi dung dịch:
Ca2+ + PO43- → Ca3(PO4)2
Mg2+ + PO43- → Mg3(PO4)2
Chọn B
Câu 13:
MgO tác dụng với HCl trong dung dịch tạo ra H2O và chất nào sau đây?
 Xem đáp án
Xem đáp án
MgO tác dụng với HCl trong dung dịch tạo ra H2O và MgCl2:
MgO + 2HCl → MgCl2 + H2O
Chọn A
Câu 15:
Chất nào sau đây tan hoàn toàn trong dung dịch NaOH dư?
 Xem đáp án
Xem đáp án
Al2O3 tan hoàn toàn trong dung dịch NaOH dư:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Chọn C
Câu 16:
Trong các vụ cháy, một trong những nguyên nhân gây tử vong cho con người là do nhiễm độc khí X. Khi đi vào máu, khí X kết hợp với hemoglobin, chiếm mất vị trí của oxi gắn với hemoglobin, dẫn đến oxi không được hemoglobin vận chuyển đến các mô của tế bào. Khí X là:
 Xem đáp án
Xem đáp án
Chọn A
Câu 18:
Cặp chất nào sau đây là đồng phân
 Xem đáp án
Xem đáp án
Cặp chất axit axetic và metyl fomat là đồng phân vì chúng có cùng CTPT là C2H4O2.
Chọn B
Câu 19:
Thủy phân saccarozơ thu được hai monosaccarit X và Y. Chất X có trong máu người với nồng độ khoảng 0,1%. Hai chất X và Y lần lượt là
 Xem đáp án
Xem đáp án
Thủy phân saccarozơ thu được hai monosaccarit là glucozơ và fructozơ.
Chất X có trong máu người với nồng độ khoảng 0,1% → X là glucozơ → Y là fructozơ.
Chọn B
Câu 21:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A sai, tơ nitron điều chế bằng phản ứng trùng hợp CH2=CH-CN.
Chọn A
Câu 22:
Trong công nghiệp, saccarozơ là nguyên liệu để thủy phân thành glucozơ và fructozơ dùng trong kĩ thuật tráng gương, ruột phích. Để thu được 20,25 kg glucozơ cần thủy phân m kg saccarozơ với hiệu suất phản ứng là 75%. Giá trị của m là
 Xem đáp án
Xem đáp án
Saccarozơ + H2O → Glucozơ + Fructozơ
342…………………….180
m………………………20,25
H = 75% → m = 20,25.342/(180.75%) = 51,3 kg
Chọn D
Câu 23:
Thủy phân este nào sau đây trong dung dịch NaOH thu được muối và ancol bậc 2?
 Xem đáp án
Xem đáp án
Thủy phân isopropyl fomat trong dung dịch NaOH thu được muối và ancol bậc 2:
HCOOCH(CH3)2 + NaOH → HCOONa + (CH3)2CHOH
Chọn B
Câu 24:
Hòa tan hết 8,05 gam hỗn hợp gồm ZnO và Fe2O3 cần vừa đủ V ml dung dịch HCl 1M, sau phản ứng thu được dung dịch chứa 14,925 gam hỗn hợp muối. Giá trị của V là
 Xem đáp án
Xem đáp án
nH2O = x → nHCl = 2x, bảo toàn khối lượng:
8,05 + 36,5.2x = 14,925 + 18x → x = 0,125
→ VddHCl = 250 ml
Chọn B
Câu 26:
Thủy phân hoàn toàn 9 gam este đơn chức X bằng dung dịch KOH dư, đun nóng, thu được 12,6 gam muối Y và m gam ancol Z. Giá trị của m là
 Xem đáp án
Xem đáp án
mRCOOR’ < mRCOOK → R’ < K = 39
Nếu R’ = 15 → nX = (12,6 – 9)/(39 – 15) = 0,15
→ MX = 60 (HCOOCH3) → mZ = 0,15.32 = 4,8
Nếu R’ = 29 → nX = (12,6 – 9)/(39 – 29) = 0,36
→ MX = 25: Loại.
Chọn A
Câu 27:
Cho kim loại Fe lần lượt phản ứng với các dung dịch: FeCl3, ZnSO4, AgNO3, MgCl2. Số trường hợp xảy ra phản ứng hóa học là
 Xem đáp án
Xem đáp án
Có 2 trường hợp xảy ra phản ứng hóa học là:
Fe + 2FeCl3 → 3FeCl2
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Chọn D
Câu 28:
Thí nghiệm nào sau đây không thu được kim loại?
 Xem đáp án
Xem đáp án
Chọn C
A. AgNO3 + Fe(NO3)2 → Fe(NO3)2 + Ag
B. Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
C. 2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
D. CO + CuO (t°) → Cu + CO2
Câu 29:
Để phản ứng vừa đủ với 6,3 gam amin X (no, đơn chức, mạch hở) cần 400 ml dung dịch HCl 0,35M. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
X đơn chức nên nX = nHCl = 0,14
→ MX = 45: X là C2H7N
Chọn B
Câu 30:
Đốt cháy hoàn toàn 2,16 gam kim loại Mg trong 0,56 lít (đktc) khí O2 đến phản ứng hoàn toàn thu được chất rắn X. Hòa tan hết X vào dung dịch H2SO4 loãng thu được V lít H2 ở đktc. Giá trị của V là
 Xem đáp án
Xem đáp án
nMg = 0,09; nO2 = 0,025
Bảo toàn electron: 2nMg = 4nO2 + 2nH2
→ nH2 = 0,04 → V = 0,896 lít
Chọn B
Câu 31:
Để đơn giản ta xem một loại xăng là hỗn hợp gồm pentan và hexan có tỉ khối hơi so với metan là 4,85. Nếu đốt cháy hoàn toàn 56 lít hơi xăng trên cần trộn với vừa đủ V lít không khí và lượng nhiệt tỏa ra là x (kJ). Giả thiết thể tích đo ở điều kiện tiêu chuẩn; không khí chứa 20% O2 theo thể tích, còn lại là N2; cho biết nhiệt lượng tỏa ra khi đốt cháy 1 mol ankan được tính theo công thức: Q = (221,5 + 663,5n) kJ/mol, với n là số nguyên tử cacbon trong phân tử. Giá trị của V và x lần lượt là
 Xem đáp án
Xem đáp án
nC5H12 = a và nC6H14 = b
→ a + b = 2,5 và 72a + 86b = 2,5.4,85.16
→ a = 1,5; b = 1
nO2 = 8a + 9,5b = 21,5
→ V không khí = 21,5.22,4/20% = 2408 lít
Q = a(221,5 + 663,5.5) + b(221,5 + 663,5.6) = 9511 kJ
Chọn B
Câu 32:
Cho các thí nghiệm sau:
(a) Cho kim loại Al vào dung dịch NaOH.
(b) Cho dung dịch KHSO4 vào dung dịch Ba(HCO3)2.
(c) Cho dung dịch HCl vào dung dịch Fe(NO3)2.
(d) Cho kim loại Ag vào dung dịch HNO3 đặc, nóng.
(e) Cho dung dịch NH4H2PO4 vào dung dịch NaOH dư, đun nóng.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm sinh ra chất khí là
 Xem đáp án
Xem đáp án
(a) Al + H2O + NaOH → NaAlO2 + H2
(b) KHSO4 + Ba(HCO3)2 → BaSO4 + K2SO4 + CO2 + H2O
(c) Fe2+ + H+ + NO3- → Fe3+ + NO + H2O
(d) Ag + H2SO4 đặc nóng → Ag2SO4 + SO2 + H2O
(e) NH4H2PO4 + NaOH dư → Na3PO4 + NH3 + H2O
Chọn D
Câu 33:
Cho sơ đồ phản ứng sau:
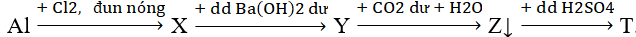
Các chất Y và T là
 Xem đáp án
Xem đáp án
Al + Cl2 → AlCl3 (X)
AlCl3 + Ba(OH)2 dư → Ba(AlO2)2 (Y) + BaCl2 + H2O
Ba(AlO2)2 + CO2 dư + H2O → Al(OH)3 (Z) + Ba(HCO3)2
Al(OH)3 + H2SO4 → Al2(SO4)3 (T) + H2O
Chọn D
Câu 34:
Cho hai chất hữu cơ no, mạch hở A, B (đều có công thức phân tử C4H6O4 và có 2 nhóm chức este) tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
A + 2NaOH (t°) → 2X + Y.
B + 2NaOH (t°) → X + Z + T
Biết: Y và Z là các ancol có số nhóm chức khác nhau; T là chất hữu cơ no, mạch hở. Cho các phát biểu sau:
(a) Chất Y thuộc loại ancol no, mạch hở, đơn chức.
(b) Chất X có khả năng tham gia phản ứng tráng bạc.
(c) Chất Z có nhiệt độ sôi thấp hơn ancol etylic.
(d) Chất T có phân tử khối bằng 98 đvC.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
A là (HCOO)2C2H4; X là HCOONa; Y là C2H4(OH)2
B là HCOO-CH2-COO-CH3; Z là CH3OH; T là HO-CH2-COONa
(a) Sai, Y thuộc loại ancol no, mạch hở, hai chức.
(b) Đúng, X dạng NaO-CHO nên có tráng bạc.
(c) Đúng, CH3OH có phân tử khối nhỏ hơn C2H5OH nên nhiệt độ sôi thấp hơn.
(d) Đúng
Chọn D
Câu 35:
Cho các phát biểu sau:
(a) Do có tính sát trùng, fomon được dùng để ngâm mẫu động vật.
(b) Thành phần chính của sợi bông, sợi đay là tinh bột.
(c) Ở điều kiện thường, glucozơ và alanin đều là chất rắn và dễ tan trong nước.
(d) Thủy phân saccarozơ chỉ thu được glucozơ.
(e) Poli(metyl metacrylat) được dùng để chế tạo thuỷ tinh hữu cơ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng.
(b) Sai, thành phần chính của sợi bông, sợi đay là xenlulozơ.
(c) Đúng.
(d) Sai, thủy phân saccarozơ thu được glucozơ và fructozơ.
(e) Đúng.
Chọn A
Câu 36:
Thủy phân hoàn toàn m gam hỗn hợp X gồm các triglixerit trong dung dịch NaOH, thu được glixerol và hỗn hợp Y gồm ba muối C15H31COONa, C17HxCOONa và C17HyCOONa có tỉ lệ mol tương ứng là 1 : 2 : 1. Đốt cháy hoàn toàn m gam X cần vừa đủ 3,155 mol O2, thu được H2O và 2,22 mol CO2. Mặt khác, cho p gam X trên tác dụng tối đa với 0,0375 mol Br2 trong dung dịch. Giá trị của p gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
C trung bình của muối = (16 + 18.2 + 18)/4 = 17,5
→ C trung bình của X = n = 17,5.3 + 3 = 55,5
X dạng CnH2n+2-2kO6 (2,22/55,5 = 0,04 mol)
→ nO2 = 0,04(1,5n – 2,5 – 0,5k) = 3,155
→ k = 3,75
mX = 0,04(14n + 90,5) = 34,7
nBr2 = 0,04(k – 3) = 0,03
Tỉ lệ: 34,7 gam X tác dụng tối đa với 0,03 mol Br2
→ p gam X tác dụng tối đa với 0,0375 mol Br2
→ p = 43,375
Chọn A
Câu 37:
Cho hỗn hợp X gồm m gam Fe và 8,1 gam Al vào 1 lít dung dịch Y chứa AgNO3 a mol/l và Cu(NO3)2 2a mol/l. Sau khi phản ứng kết thúc, thu được 67,4 gam chất rắn Z gồm ba kim loại và dung dịch T. Cho Z tác dụng với dung dịch H2SO4 đặc, nóng (dư), thu được 19,04 lít khí SO2 (ở đktc, là sản phẩm khử duy nhất). Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
nAl = 0,3; nAg+ = a; nCu2+ = 2a;
nFe phản ứng với Y = b và nFe dư (trong Z) = c
Bảo toàn electron:
a + 2.2a = 0,3.3 + 2b
a + 2.2a + 3c = 0,85.2
mZ = 108a + 64.2a + 56c = 67,4
→ a = 0,25; b = 0,175; c = 0,15
→ mFe = 56(b + c) = 18,2 gam
Chọn C
Câu 38:
Hỗn hợp E gồm ba este mạch hở X, Y và Z, trong đó có một este hai chức và hai este đơn chức; MX < MY < MZ. Đốt cháy hết 27,26 gam E cần vừa đủ 1,195 mol O2, thu được H2O và 1,1 mol CO2. Mặt khác, thủy phân hoàn toàn 27,26 gam E trong dung dịch NaOH dư, thu được hỗn hợp các muối của axit cacboxylic no và 14,96 gam hỗn hợp hai ancol kế tiếp nhau trong dãy đồng đẳng. Phần trăm khối lượng của X trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng → nH2O = 0,95
→ nO(E) = (mE – mC – mH)/16 = 0,76
→ nAncol = nNaOH = nO(E)/2 = 0,38
→ M ancol = 39,37
→ Ancol gồm CH3OH (0,18) và C2H5OH (0,2)
nEste đôi = nCO2 – nH2O = 0,15
Bảo toàn O → nEste đơn = 0,08
Quy đổi muối thành HCOONa (0,08), (COONa)2 (0,15) và CH2
Bảo toàn khối lượng → m muối = 27,5 → nCH2 = 0,14
Dễ thấy nCH2 < n(COONa)2 nên muối đôi không có thêm CH2.
E gồm CH3OOC-COOC2H5 (0,15) → Các este đơn: HCOOCH3.kCH2 (0,03), HCOOC2H5.gCH2 (0,05)
→ nCH2 = 0,03k + 0,05g = 0,14
→ k = 3 và g = 1 là nghiệm duy nhất.
X là CH3COOC2H5 (0,05) -® %X = 16,14%
Y là C3H7COOCH3 (0,03)
Chọn C
Câu 39:
Trộn m gam hỗn hợp X gồm Mg, MgO, Fe, FeO, Fe2O3, Fe3O4, Cu và CuO (trong đó nguyên tố oxi chiếm 10,1% theo khối lượng hỗn hợp X) với 2,96 gam Mg(NO3)2, thu được hỗn hợp Y. Hòa tan hoàn toàn Y trong dung dịch chứa đồng thời HCl; 0,025 mol KNO3 và 0,075 mol NaNO3, thu được dung dịch Z chỉ chứa muối clorua và 2,24 lít hỗn hợp khí T gồm N2 và NO. Tỉ khối của T so với H2 là 14,75. Cho Z phản ứng với dung dịch Ba(OH)2 dư trong điều kiện không có không khí, thu được 37,735 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nMg(NO3)2 = 0,02; T gồm N2 (0,025) và NO (0,075)
Bảo toàn N → nNH4+ = 0,015
X chứa kim loại (a gam) và O (b mol)
→ mO = 16b = 10,1%(a + 16b) (1)
nHCl = 12nN2 + 4nNO + 10nNH4+ + 2nO = 2b + 0,75
Z + Ba(OH)2 tạo dung dịch chứa muối KCl (0,025), NaCl (0,075) và BaCl2 (b + 0,325, tính theo bảo toàn Cl)
→ nBa(OH)2 phản ứng = b + 0,325
→ nOH- trong kết tủa = 2(b + 0,325) – nNH4+ = 2b + 0,635
→ a + 0,02.24 + 17(2b + 0,635) = 37,735 (2)
(1)(2) → a = 21,36; b = 0,15
→ m = a + 16b = 23,76
Chọn B
Câu 40:
Hòa tan hoàn toàn m gam hỗn hợp chất rắn gồm CuSO4, CuCl2, NaCl và Na2SO4 vào nước thu được dung dịch X. Cho dung dịch X tác dụng với lượng dư dung dịch Ba(OH)2 thu được 71,1 gam kết tủa. Mặt khác, khi điện phân một lượng dung dịch X như trên (điện cực trơ, có màng ngăn, hiệu suất 100%) với cường độ dòng điện 5A, thu được thể tích khí V (đktc) thoát ra ở hai điện cực phụ thuộc vào thời gian t như đồ thị bên:
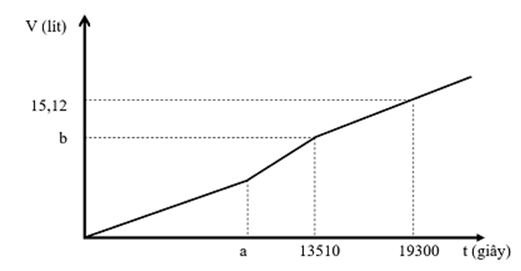
Giá trị của m là
 Xem đáp án
Xem đáp án
Đoạn 1:
CuCl2 → Cu + Cl2
CuSO4 + 2NaCl → Cu + Cl2 + Na2SO4
Đoạn 2 có độ dốc lớn hơn nên tốc độ thoát khí nhanh hơn → Phản ứng:
2NaCl + 2H2O → H2 + Cl2 + 2NaOH
Đoạn 3: 2H2O → 2H2 + O2
ne đoạn 3 = (19300 – 13510).5/96500 = 0,3
→ Khí đoạn 3 gồm H2 (0,15) và O2 (0,075)
n khí tổng = 0,675
→ n khí đoạn 1 và 2 = 0,675 – khí đoạn 3 = 0,45
ne đoạn 1 + đoạn 2 = 13510.5/96500 = 0,7
→ nCl2 = 0,35 → nH2 đoạn 2 = 0,45 – 0,35 = 0,1
Bảo toàn electron cho catot → nCu = 0,25
→ nCu(OH)2 = 0,25 → nBaSO4 = 0,2
X gồm Cu2+ (0,25), Cl- (0,7), SO42- (0,2), bảo toàn điện tích → nNa+ = 0,6
→ m = 73,85 gam
Chọn C
