Thi Online (2023) Đề thi thử Hóa Liên THPT Chuyên Hùng Vương, Gia Lai (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa Liên THPT Chuyên Hùng Vương, Gia Lai (Lần 1) có đáp án
-
600 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Kim loại M có thể điều chế được bằng cả ba phương pháp thủy luyện, nhiệt luyện, điện phân. Kim loại M là
 Xem đáp án
Xem đáp án
Chọn D
Câu 2:
Trong phản ứng của kim loại R với O2, một nguyên tử R nhường 2 eletron. R là kim loại nào trong các kim loại sau?
 Xem đáp án
Xem đáp án
Trong phản ứng của kim loại R với O2, một nguyên tử R nhường 2 eletron → Chọn R là Ca:
Ca → Ca2+ + 2e
Câu 3:
Chất béo là thức ăn quan trọng của con người, là nguồn cung cấp dinh dưỡng và năng lượng đáng kể cho cơ thể hoạt động. Ngoài ra, một lượng lớn chất béo được dùng trong công nghiệp để sản xuất:
 Xem đáp án
Xem đáp án
Một lượng lớn chất béo được dùng trong công nghiệp để sản xuất xà phòng và glixerol từ phản ứng:
(RCOO)3C3H5 + 3NaOH → 3RCOONa + C3H5(OH)3
Câu 4:
Ấm đun nước lâu ngày, thường thấy xuất hiện một lớp cặn ở đáy. Thành phần chính của lớp cặn đó thường là chất nào trong các chất sau?
 Xem đáp án
Xem đáp án
Thành phần chính của lớp cặn trong ấm đun nước thường là CaCO3, chất này được tích tụ lâu ngày nhờ phản ứng:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Ca(HCO3)2 thường có sẵn trong nước tự nhiên.
Câu 11:
Hiện tượng “hiệu ứng nhà kính” làm cho nhiệt độ Trái Đất nóng lên, làm biến đổi khí hậu, gây hạn hán, lũ lụt,. Tác nhân chủ yếu gây ra “hiệu ứng nhà kính” là do sự tăng nồng độ trong khí quyển của chất khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 15:
Crom (VI) oxit là chất rắn màu đỏ thẫm, được sử dụng trong mạ crom. Công thức của crom (VI) oxit là
 Xem đáp án
Xem đáp án
Chọn A
Câu 16:
Saccarozơ là một loại đisasaccarit có nhiều trong cây mía, hoa thốt nốt, củ cải đường. Công thức phân tử của saccarozơ là
 Xem đáp án
Xem đáp án
Chọn D
Câu 17:
Nhúng thanh sắt vào dung dịch nào sau đây có xảy ra sự ăn mòn điện hoa học?
 Xem đáp án
Xem đáp án
Nhúng thanh sắt vào dung dịch CuSO4 có xảy ra sự ăn mòn điện hoa học:
Fe + CuSO4 → FeSO4 + Cu
Cu sinh ra bám vào thanh Fe tạo cặp điện cực Fe-Cu tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hoa học.
Câu 18:
Trong các muối sau, muối nào dễ bị nhiệt phân?
 Xem đáp án
Xem đáp án
Trong các muối trên, muối KHCO3 dễ bị nhiệt phân:
KHCO3 → K2CO3 + CO2 + H2O
Câu 19:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Sai: Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
B. Sai, Al2O3 là một oxit lưỡng tính.
C. Sai, không có loại hợp chất gọi là “bazơ lưỡng tính”
D. Đúng
Câu 21:
Xà phòng hóa este X có công thức phân tử C4H8O2 bằng dung dịch NaOH dư thu được muối Y và ancol metylic. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
X là CH3CH2COOCH3:
CH3CH2COOCH3 + NaOH → CH3CH2COONa + CH3OH
Câu 22:
Hoà tan hết 14,6 gam hỗn hợp X gồm kim loại R (chỉ có hoá trị II) và oxit của kim loại R cần vừa đủ 400ml dung dịch HCl 1M, sau phản ứng hoàn toàn thu được 2,24 lít khí ở đktc. Kim loại R là
 Xem đáp án
Xem đáp án
nR = nH2 = 0,1
nHCl = 2nH2O + 2nH2 → nRO = nH2O = 0,1
mX = 0,1R + 0,1(R + 16) = 14,6
→ R = 65: R là Zn
Câu 23:
Cho 135 gam glucozơ lên men rượu với hiệu suất 80% thu được V lít khí CO2. Giá trị của V là
 Xem đáp án
Xem đáp án
C6H12O6 → 2C2H5OH + 2CO2
nC6H12O6 = 0,75 và H = 80% → nCO2 = 0,75.2.80% = 1,2
→ V = 26,88 lít
Câu 24:
Thủy phân hoàn toàn 7,4 gam este đơn chức X bằng dung dịch NaOH dư, đun nóng, thu được 8,2 gam muối Y và m gam ancol Z. Giá trị của m là
 Xem đáp án
Xem đáp án
mRCOOR’ < mRCOONa → R’ < Na = 23
→ R’ = 15: -CH3.
nCH3OH = nX = (8,2 – 7,4)/(23 – 15) = 0,1
→ mCH3OH = 3,2 gam
Câu 25:
Cho x mol axit glutamic tác dụng vừa đủ với dung dịch HBr 1,0 M, thu được dung dịch X. Dung dịch X tác dụng vừa đủ với dung dịch chứa y mol KOH. Biểu thức liên hệ giữa x và y là
 Xem đáp án
Xem đáp án
nHBr = nGlu = x
→ nKOH = nHBr + 2nGlu ⇔ y = 3x
Câu 26:
Nhúng thanh sắt lần lượt vào các dung dịch sau: CuSO4, AgNO3 dư, ZnSO4, Fe2(SO4)3, HCl, HNO3 loãng dư. Biết các thí nghiệm không tiếp xúc với không khí. Số trường hợp xảy ra phản ứng tạo hợp chất sắt (II) là
 Xem đáp án
Xem đáp án
Các trường hợp xảy ra phản ứng tạo hợp chất sắt (II) là: CuSO4, Fe2(SO4)3, HCl.
Câu 27:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, xenlulozơ có mạch không phân nhánh
B. Đúng
C. Sai, saccarozơ tạo bởi 1 gốc glucozơ + 1 gốc fructozơ
D. Sai, I2 + hồ tinh bột → màu xanh tím.
Câu 28:
Cho 3,48 gam hỗn hợp gồm Fe2O3, K2O tác dụng vừa đủ với 200ml dung dịch H2SO4 0,25M. Sau phản ứng thu được dung dịch chứa m gam hỗn hợp muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nH2O = nH2SO4 = 0,05
Bảo toàn khối lượng:
m muối = 3,48 + 0,05.98 – 0,05.18 = 7,48 gam
Câu 29:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, tơ tằm thuộc loại tơ thiên nhiên.
B. Sai, tơ xenlulozơ axetat thuộc loại tơ bán tổng hợp.
C. Sai, tơ poliamit kém bền do bị thủy phân trong môi trường kiềm hoặc axit.
D. Đúng, PVC được điều chế bằng phản ứng trùng hợp CH2=CH-Cl.
Câu 30:
Thực hiện các thí nghiệm sau:
(a) Đun sôi nước có tính cứng vĩnh cửu.
(b) Hòa tan phèn chua vào nước rồi thêm dung dịch NH3 dư.
(c) Cho dung dịch H2SO4 dư vào dung dịch Ba(AlO2)2.
(d) Cho mẩu nhỏ Na vào dung dịch gồm CaCl2 và NaHCO3.
(e) Cho nước vôi trong vào dung dịch KHCO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được có kết tủa là
 Xem đáp án
Xem đáp án
(a) Không phản ứng
(b) NH3 + H2O + Al3+ → Al(OH)3 + NH4+
(c) H2SO4 dư + Ba(AlO2)2 → BaSO4 + Al2(SO4)3 + H2O
(d) Na + H2O → Na+ + OH- + H2
OH- + HCO3- → CO32- + H2O
Ca2+ + CO32- → CaCO3
(e) Ca(OH)2 + KHCO3 → CaCO3 + K2CO3 + H2O
Câu 31:
Hỗn hợp T gồm hai triglixerit X và Y có tỉ lệ mol tương ứng là 2 : 3. Tiến hành các thí nghiệm sau:
• Thí nghiệm 1: Xà phòng hóa hoàn toàn T bằng dung dịch NaOH dư, thu được hỗn hợp muối gồm C15H31COONa, C17H31COONa và C17H33COONa.
• Thí nghiệm 2: Đốt cháy hoàn toàn m gam T, thu được 5,3 mol CO2 và 4,96 mol H2O.
• Thí nghiệm 3: Cho m gam T tác dụng với H2 dư (xúc tác Ni, t°) thì số mol H2 phản ứng tối đa là 0,14 mol. Phần phần trăm khối lượng của X trong m gam T là
 Xem đáp án
Xem đáp án
nT = [nCO2 – (nH2O + nH2)]/2 = 0,1
→ nX = 0,04; nY = 0,06 và nC3H5(OH)3 = 0,1
Đặt a, b, c là số mol C15H31COONa, C17H31COONa và C17H33COONa
→ n muối = a + b + c = 0,1.3
Bảo toàn C → 16a + 18b + 18c + 0,1.3 = 5,3
nH2 = 2b + c = 0,14
→ a = 0,2; b = 0,04; c = 0,06
X là (C17H31COO)(C15H31COO)2C3H5: 0,04
Y là (C17H33COO)(C15H31COO)2C3H5: 0,06
→ %X = 39,94%
Câu 32:
Cho các phát biểu sau:
(a) Khi cho dung dịch KOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu da cam sang màu vàng.
(b) Khi cho dung dịch NaOH dư vào dung dịch Ba(HCO3)2 thu được kết tủa.
(c) Ở nhiệt độ cao, tất cả kim loại kiềm thổ đều tác dụng với nước.
(d) Khi cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư thu được dung dịch chứa hai muối.
(e) Hỗn hợp gồm Al, Al2O3, Al(OH)3 không tan được hết trong dung dịch NaOH dư.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng: KOH + K2Cr2O7 (da cam) → K2CrO4 (vàng) + H2O
(b) Đúng: NaOH dư + Ba(HCO3)2 → BaCO3 + Na2CO3 + H2O
(c) Sai, Be không phản ứng
(d) Đúng, dung dịch chứa 2 muối Fe(NO3)3 và AgNO3 dư
(e) Sai, hỗn hợp gồm Al, Al2O3, Al(OH)3 tan hết trong dung dịch NaOH dư.
Câu 33:
Phân bón đa yếu tố NPK 4.12.7 (kí hiệu này cho biết tỉ lệ khối lượng N, P2O5, K2O trong phân) thân thiện với môi trường, quá trình tan trong nước không tự phân hủy sinh khí độc, sử dụng rất an toàn cho người, động vật và thực vật. Nếu chúng ta có 3 mẫu phân bón (NH4)2SO4, Ca(H2PO4)2 và KCl, đem trộn chúng lần lượt theo tỉ lệ khối lượng gần đúng nào để có loại phân bón NPK 4.12.7 nêu trên? (Xem phần trăm tạp chất trong phân không đáng kể.)
 Xem đáp án
Xem đáp án
Trong 100 gam phân bón có mN = 4, mP2O5 = 12 và mK2O = 7
Bảo toàn N → n(NH4)2SO4 = nN/2 = 1/7
Bảo toàn P → nCa(H2PO4)2 = nP2O5 = 6/71
Bảo toàn K → nKCl = 2nK2O = 7/47
→ m(NH4)2SO4 : mCa(H2PO4)2 : mKCl = 18,86 : 19,77 : 11,10 ≈ 1,70 : 1,78 : 1,00
Câu 34:
Cho các phát biểu sau:
(a) Dầu ăn và mỡ động vật có chứa nhiều triglixerit.
(b) Các polime thuộc loại tơ tổng hợp đều điều chế từ phản ứng trùng ngưng.
(c) Chất béo nhẹ hơn nước và không tan trong nước.
(d) Nhỏ dung dịch iot vào vết cắt quả chuối xanh, xuất hiện màu xanh tím.
(e) Trong phân tử peptit mạch hở Gly-Ala-Glu có 4 nguyên tử oxi.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, có thể điều chế từ phản ứng trùng hợp như tơ olon, nilon-6…
(c) Đúng
(d) Đúng, chuối xanh chứa nhiều tinh bột, tạo màu xanh tím với I2.
(e) Sai, số Oxi = 2 + 2 + 4 – 2 = 6 nguyên tử
Câu 35:
Khí Biogas là loại khí sinh học, thành phần chính gồm hỗn hợp khí metan (CH4 chiếm khoảng 50% - 60%), CO2 (>30%) và một số chất khác được phát sinh từ sự phân hủy hợp chất hữu cơ như hơi nước, N2, O2, H2S, CO. Muốn nâng nhiệt độ của 1 gam nước lên 1°C cần tiêu tốn 4,18 J và khi 1,00 gam metan cháy, nhiệt tỏa ra là 55,6 kJ. Thể tích tối thiểu khí biogas (lít) cần dùng để đun 2,5 lít nước (D = 1,00 g/ml) từ 25°C lên 100°C gần nhất với giá trị nào sau đây? (Giả sử có 65% lượng nhiệt sinh ra khi đốt cháy biogas được sử dụng để tăng nhiệt độ của nước)
 Xem đáp án
Xem đáp án
nCH4 = x, bảo toàn năng lượng:
16x.55,6.10³.65% = 2500.1.4,18(100 – 25)
→ x = 1,3554
→ V biogas tối thiểu = 1,3554.22,4/60% = 50,6 lít
Câu 36:
Cho sơ đồ chuyển hóa:
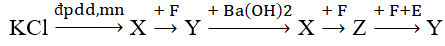
Biết: X, Y, Z, E, F là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học. Các chất Y, Z thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
X là KOH; F là CO2; Y là KHCO3; Z là K2CO3; Y là KHCO3, E là H2O
KCl + H2O → H2 + Cl2 + KOH
KOH + CO2 → KHCO3
KHCO3 + Ba(OH)2 → KOH + BaCO3 + H2O
KOH + CO2 → K2CO3 + H2O
K2CO3 + CO2 + H2O → KHCO3
Câu 37:
Chất hữu cơ E có công thức đơn giản nhất là CHO; chất hữu cơ F có cùng số nguyên tử cacbon với E. Tổng số nguyên tử trong E và F là 27. Khi cho 1 mol E hoặc 1 mol F tác dụng hết với Na dư đều thu được 1 mol khí H2. Từ E và F thực hiện các phản ứng sau:
(1) E + 2NaOH (t°) → X + 2H2O
(2) F + 2NaOH (t°) → 2Y + H2O
(3) Y + HCl → NaCl + T
Trong đó các chất X, Y, Z, T là các hợp chất hữu cơ. Cho các phát biểu sau:
(a) Chất E là axit cacboxylic và có hai đồng phân cấu tạo.
(b) F là hợp chất no, mạch hở.
(c) Phân tử chất F có chứa 3 loại nhóm chức.
(d) Đốt cháy hoàn toàn a mol E hoặc a mol X đều cho kết quả nCO2 - nH2O = 2a
(e) Trong công nghiệp, chất T điều chế trực tiếp từ metanol.
(g) Chất E cộng hợp Br2 trong CCl4 theo tỉ lệ mol 1 : 1.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(1) → E là axit 2 chức → E là C4H4O4, cấu tạo:
HOOC-CH=CH-COOH; HOOC-C(=CH2)-COOH
X dạng C2H2(COONa)2
F có 4C, kết hợp (2) → F là HO-CH2-COO-CH2-COOH
Y là HO-CH2-COONa
T là HO-CH2-COOH
(a) Đúng
(b) Đúng
(c) Đúng, F có chức ancol, este, axit
(d) Đúng, E và X đều có k = 3 nên nCO2 – nH2O = 2a
(e) Sai
(g) Đúng: C2H2(COOH)2 + Br2 → C2H2Br2(COOH)2
Câu 38:
Điện phân 200 ml dung dịch hỗn hợp Cu(NO3)2 xM, NaCl yM (điện cực trơ, màng ngăn) đến khi nước bắt đầu điện phân ở cả 2 điện cực thì dừng lại. Dung dịch sau điện phân có khối lượng giảm 14 gam so với dung dịch ban đầu và dung dịch này phản ứng tối đa 6,72 gam NaHCO3. Biết thời gian điện phân là 19300 giây. Giá trị x, y và cường độ dòng điện (Ampere) lần lượt là:
 Xem đáp án
Xem đáp án
nCu(NO3)2 = 0,2x; nNaCl = 0,2y; nNaHCO3 = 0,08
TH1: Chất phản ứng với NaHCO3 là H+ (0,08)
Catot: nCu = 0,2x
Anot: nCl2 = 0,1y và nO2 = nH+/4 = 0,02
Bảo toàn electron: 2.0,2x = 2.0,1y + 0,02.4
m giảm = 0,2x.64 + 0,1y.71 + 0,02.32 = 14
→ x = 0,6; y = 0,8
ne = 2.0,2x = It/F → I = 1,2A
TH2: Chất phản ứng với NaHCO3 là OH- (0,08)
Catot: nCu = 0,2x; nH2 = nOH-/2 = 0,04
Anot: nCl2 = 0,1y
Bảo toàn electron: 2.0,2x + 0,04.2 = 2.0,1y
m giảm = 0,2x.64 + 0,1y.71 + 0,04.2 = 14
→ x = 0,4104; y = 1,2207
ne = 2.0,1x = It/F → I = 1,2207A
Câu 39:
Hỗn hợp X gồm bốn este mạch hở, trong đó có một este đơn chức và ba este hai chức đồng phân. Tiến hành các thí nghiệm sau:
• Thí nghiệm 1: Đốt cháy hết m gam X cần 6,048 lít O2, thu được 5,152 lít CO2 và 3,24 gam H2O.
• Thí nghiệm 2: Đun nóng m gam X với 150 ml dung dịch NaOH 0,8M, cô cạn dung dịch sau phản ứng thu được chất rắn Y và phần hơi chỉ chứa một ancol Z. Cho toàn bộ Z vào bình đựng Na dư, khi phản ứng xong khối lượng bình tăng 2,25 gam. Nung toàn bộ Y với CaO (không có không khí), thu được 0,896 lít một hiđrocacbon duy nhất.
Biết các phản ứng đều xảy ra hoàn toàn, các khí đo ở đktc. Phần trăm khối lượng của este đơn chức trong X có giá trị gần nhất là
 Xem đáp án
Xem đáp án
nO2 = 0,27; nCO2 = 0,23; nH2O = 0,18 → mX = 4,72
Hỗn hợp gồm 1 este đơn chức và 3 este 2 chức là đồng phân nhưng khi xà phòng hóa chỉ thu được 1 ancol nên X gồm:
ACOOB (x mol)
R(COOB)2 (y mol)
Bảo toàn O: 2x + 4y + 0,27.2 = 0,23.2 + 0,18
→ x + 2y = 0,05 (1)
→ nNaOH phản ứng = 0,05
nNaOH ban đầu = 0,12 → nNaOH dư = 0,07
Y gồm ACOONa và R(COONa)2
ACOONa + NaOH → AH + Na2CO3
R(COONa)2 + 2NaOH → RH2 + 2Na2CO3
→ NaOH vẫn dư, các muối hết
nAH + nRH2 = x + y = 0,04 (2)
(1)(2) → x = 0,03 và y = 0,01
Phần ancol BOH (x + 2y = 0,05 mol) vào bình Na dư:
m bình tăng = 0,05(B + 17) – 0,05.2/2 = 2,25
→ B = 29 → C2H5OH
m este = 0,03(A + 73) + 0,01(R + 146) = 4,72
Do R = A – 1 (Vì chỉ thu được 1 hidrocacbon khi vôi tôi xút nên AH cũng là RH2) nên tính được:
A = 27 → A là CH2=CH-
Vậy các este là:
CH2=CH-COOC2H5 (0,03 mol)
C2H5-OOC-CH=CH-COO-C2H5 (Cis – Trans)
và C2H5-OOC-C(=CH2)-COO-C2H5
→ %CH2=CH-COOC2H5 = 63,56%
Câu 40:
Cho a gam hỗn hợp X gồm Fe, Fe3O4, Mg và MgO. Hòa tan hết a gam hỗn hợp X vào dung dịch H2SO4 đặc, nóng (dư 20% so với lượng phản ứng), thu được dung dịch Y và 0,672 lít khí SO2 (sản phẩm khử duy nhất của H2SO4). Cho Y tác dụng với dung dịch Ba(OH)2 dư, thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 39,352 gam chất rắn. Mặt khác, hòa tan a gam hết hỗn hợp X cần dùng 44,7 gam dung dịch HCl 15,52%, thu được 0,224 lít khí H2 và dung dịch E chỉ chứa các muối. Biết các khí đo ở đktc. Nồng độ phần trăm của FeCl2 trong E là
 Xem đáp án
Xem đáp án
nHCl = 44,7.15,52%/36,5 = 0,19
nH2 = 0,01; bảo toàn H → nH2O = 0,085
→ nO(X) = 0,085
nH2SO4 phản ứng = 2nSO2 + nO = 0,145
→ nH2SO4 dư = 0,145.20% = 0,029
Quy đổi X thành Mg (u), Fe (v), O (0,085)
Bảo toàn electron: 2u + 3v = 0,085.2 + 0,03.2
m rắn = 40u + 160v/2 + 233(0,145 + 0,029 – 0,03) = 39,352
→ u = 0,025; v = 0,06
mddE = mX + mddHCl – mH2 = 50 gam
E chứa MgCl2 (0,025), FeCl2 (x), FeCl3 (y)
Bảo toàn Fe → x + y = 0,06
Bảo toàn Cl → 0,025.2 + 2x + 3y = 0,19
→ x = 0,04; y = 0,02
→ C%FeCl2 = 127x/50 = 10,16%
