Thi Online (2023) Đề thi thử Hóa THPT Quốc Oai, Hà Nội (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Quốc Oai, Hà Nội (Lần 1) có đáp án
-
519 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
Chất nào sau đây vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl?
 Xem đáp án
Xem đáp án
Chọn B
Câu 3:
Anđehit mạch hở có công thức tổng quát CnH2n-2O thuộc loại
 Xem đáp án
Xem đáp án
CnH2n-2O có k = 2, gồm 1C=O và 1C=C —> CnH2n-2O thuộc loại anđehit đơn chức chứa một liên kết đôi trong gốc hiđrocacbon.
Chọn B
Câu 9:
Phát biểu nào sau đây không đúng:
 Xem đáp án
Xem đáp án
C không đúng, đây là cặp đồng phân vì có cùng CTPT là C7H8O, chúng thuộc 2 dãy đồng đẳng khác nhau: CH3C6H4OH thuộc dãy phenol và C6H5CH2OH thuộc dãy ancol thơm.
Chọn C
Câu 11:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Sai, muối mononatri của axit glutamic được dùng làm gia vị thức ăn (gọi là mì chính hay bột ngọt).
B. Sai, dung dịch glyxin trung tính, không làm đổi màu quỳ tím.
C. Sai, các amin đều độc.
D. Đúng
Chọn D
Câu 12:
Cặp ion nào sau đây không cùng tồn tại trong một dung dịch?
 Xem đáp án
Xem đáp án
Cặp ion Fe3+ và OH- không cùng tồn tại trong một dung dịch vì:
Fe3+ + OH- —> Fe(OH)3↓
Chọn D
Câu 14:
Khối lượng tinh bột cần dùng để khi lên men thu được 1 lít dung dịch ancol etylic 40° (khối lượng riêng của ancol etylic là 0,8 g/ml) với hiệu suất 80% là:
 Xem đáp án
Xem đáp án
nC2H5OH = 1000.40%.0,8/46 = 160/23 mol
(C6H10O5)n —> C6H12O6 —> 2C2H5OH
80/23…………………………….160/23
—> m tinh bột cần dùng = 162.80/23.80% = 704,35
Chọn D
Câu 15:
Thực hiện phản ứng nhiệt nhôm hoàn toàn hỗn hợp X gồm 8,1 gam Al và 16 gam Fe2O3 thu được m gam Al2O3. Giá trị của m bằng
 Xem đáp án
Xem đáp án
2Al + Fe2O3 —> Al2O3 + 2Fe
nAl = 0,3; nFe2O3 = 0,1 —> nAl2O3 = 0,1
—> mAl2O3 = 10,2 gam
Chọn A
Câu 16:
Cho sơ đồ phản ứng sau:
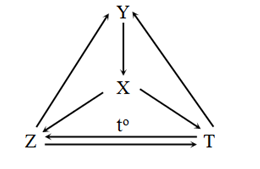
Biết rằng X là chất khí dùng nạp cho bình cứu hỏa, Y là khoáng sản dùng để sản xuất vôi sống. Vậy X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
X là chất khí dùng nạp cho bình cứu hỏa —> X là CO2
Y là khoáng sản dùng để sản xuất vôi sống —> Y là CaCO3
—> Chọn X, Y, Z, T lần lượt là CO2, CaCO3, Na2CO3, NaHCO3
Chọn D
Câu 17:
Thực hiện các thí nghiệm sau:
(a) Cho hỗn hợp Ba và Al (có tỉ lệ mol tương ứng 1 : 2) vào H2O dư.
(b) Cho hỗn hợp Cu và Fe3O4 (có tỉ lệ mol tương ứng 1 : 1) và dung dịch H2SO4 loãng dư.
(c) Cho hỗn hợp Cu và Fe(OH)3 (có tỉ lệ mol tương ứng 1 : 1) vào dung dịch HCl loãng, dư.
(d) Cho hỗn hợp Al, Fe (có tỉ lệ mol tương ứng 1 : 1) vào dung dịch HNO3 đặc nguội.
Có bao nhiêu thí nghiệm chất rắn bị hòa tan hết?
 Xem đáp án
Xem đáp án
(a) Ba + 2Al + 4H2O —> Ba(AlO2)2 + 4H2
(b) Cu + Fe3O4 + 4H2SO4 —> CuSO4 + 3FeSO4 + 4H2O
(c) Cu + 2Fe(OH)3 + 6HCl —> CuCl2 + 2FeCl2 + 6H2O
Cu còn dư.
(d) Không tan do Al, Fe bị thụ động trong dung dịch HNO3 đặc nguội.
Chọn A
Câu 18:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, tơ visco, tơ xenlulozơ axetat thuộc loại tơ bán tổng hợp (nhân tạo).
B. Sai, tơ nilon-6,6 được điều chế từ hexametylendiamin và axit adipic.
C. Đúng
D. Sai, polietilen và poli(vinyl clorua) là sản phẩm của phản ứng trùng hợp CH2=CH2 và CH2=CHCl tương ứng.
Chọn C
Câu 19:
Este A là hợp chất thơm có công thức C8H8O2. A có khả năng tráng bạc. Khi đun nóng 16,32 gam A với 240 ml dung dịch NaOH 1M thì NaOH phản ứng vừa hết. Số công thức của A thỏa mãn là
 Xem đáp án
Xem đáp án
nA = 0,12; nNaOH = 0,24 = 2nA nên A là este của phenol.
A có khả năng tráng bạc —> A có HCOO-
Cấu tạo của A: HCOOC6H4-CH3 (o, m, p)
Chọn A
Câu 20:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
A. Đúng, các bazơ tương ứng đều tan tốt nên các kim loại Na, K và Ba đều phản ứng mạnh với nước.
B. Sai, độ dẫn điện Ag > Cu > Au > Al > Fe…
C. Đúng
D. Đúng, Fe trong dung dịch CuSO4 có cả ăn mòn hóa học và điện hóa, trong đó ăn mòn điện hóa là chủ yếu.
Chọn B
Câu 21:
Đốt cháy hoàn toàn 11,84 gam một este X thu được 10,752 lit khí CO2 (đktc) và 8,64 gam nước. Mặt khác, cho X tác dụng 112 gam dung dịch KOH 10%, rồi cô cạn dung dịch sau phản ứng thu được 17,92 gam chất rắn khan và ancol Y. % khối lượng Cacbon trong Y là:
 Xem đáp án
Xem đáp án
nCO2 = nH2O = 0,48 —> X là este no, đơn chức, mạch hở
nX = (mX – mC – mH)/32 = 0,16
—> Số C = nCO2/nX = 3: X là C3H6O2
nKOH = 112.10%/56 = 0,2 —> Chất rắn gồm RCOOK (0,16) và KOH dư (0,04)
m rắn = 0,16(R + 83) + 0,04.56 = 17,92
—> R = 15: -CH3
X là CH3COOCH3 —> Y là CH3OH
%C(Y) = 37,50%
Chọn D
Câu 22:
Muối nào sau đây dễ bị phân hủy khi đun nóng?
 Xem đáp án
Xem đáp án
Muối Ca(HCO3)2 dễ bị phân hủy khi đun nóng:
Ca(HCO3)2 —> CaCO3 + CO2 + H2O
Chọn B
Câu 23:
Trong các polime sau: (1) poli (metyl metacrylat); (2) polistiren; (3) nilon-7; (4) poli (etylen- terephtalat); (5) nilon-6,6; (6) poli (vinyl axetat), các polime là sản phẩm của phản ứng trùng ngưng là
 Xem đáp án
Xem đáp án
Các polime là sản phẩm của phản ứng trùng ngưng là: (3), (4), (5).
Chọn C
Câu 24:
Cho hỗn hợp gồm Fe và Cu vào dung dịch chứa AgNO3 và Fe(NO3)3. Sau phản ứng thu được chất rắn X gồm 2 kim loại và dung dịch Y chỉ chứa một muối. Phát biểu nào đúng?
 Xem đáp án
Xem đáp án
X gồm 2 kim loại là Ag và Cu
Y chỉ chứa một muối —> Fe(NO3)2
Fe + 2AgNO3 —> Fe(NO3)2 + 2Ag
Fe + 2Fe(NO3)3 —> 3Fe(NO3)2
Chọn A
Câu 25:
Cho các phát biểu
(1) Thủy phân vinyl axetat bằng NaOH đun nóng, thu được natri axetat và fomanđehit.
(2) Ở điều kiện thường, anilin là chất lỏng.
(3) Tất cả các polipeptit đều có phản ứng với Cu(OH)2 tạo phức màu tím.
(4) Tripanmitin tham gia phản ứng cộng H2 (t°, Ni).
(5) Cao su sau khi được lưu hóa có tính đàn hồi và chịu nhiệt tốt hơn.
(6) Khi làm trứng muối (ngâm trứng trong dung dịch NaCl bão hòa) xảy ra hiện tượng đông tụ protein.
(7) Dầu thực vật và dầu nhớt bôi trơn máy đều có thành phần chính là chất béo.
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
(1) Sai: CH3COOCH=CH2 + NaOH —> CH3COONa + CH3CHO (axetandehit)
(2) Đúng.
(3) Đúng
(4) Sai, tripanmitin (C15H31COO)3C3H5 là chất béo no, không cộng H2.
(5) Đúng
(6) Đúng, protein bị đông tụ trong dung dịch muối.
(7) Sai, dầu bôi trơn có thành phần chính là hiđrocacbon.
Chọn B
Câu 26:
Cho 200 ml dung dịch Ca(OH)2 0,6M vào 100 ml dung dịch chứa KHCO3 2M và CaCl2 1M, sau các phản ứng hoàn toàn thu được a gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
nCa(OH)2 = 0,12; nKHCO3 = 0,2; nCaCl2 = 0,1
HCO3- + OH- —> CO32- + H2O
Ca2+ + CO32- —> CaCO3
—> nCaCO3 = 0,2 —> a = 20 gam
Chọn C
Câu 27:
Tiến hành các thí nghiệm sau:
(a) Cho 2 ml benzen vào ống nghiệm chứa 2 ml nước cất, sau đó lắc đều.
(b) Cho 1 ml C2H5OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm, lắc đều. Đun cách thủy 6 phút, làm lạnh và thêm vào 2 ml dung dịch NaCl bão hòa.
(c) Cho vào ống nghiệm 1 ml metyl axetat, sau đó thêm vào 4 ml dung dịch NaOH (dư), đun nóng.
(d) Cho 2 ml dung dịch NaOH vào ống nghiệm chứa 1 ml dung dịch phenylamoni clorua, đun nóng.
(e) Nhỏ 1 ml C2H5OH vào ống nghiệm chứa 4 ml nước cất.
Sau khi hoàn thành, có bao nhiêu thí nghiệm có hiện tượng chất lỏng phân lớp?
 Xem đáp án
Xem đáp án
(a) Có phân lớp, do C6H6 không tan
(b) Có phân lớp, do CH3COOC2H5 không tan
(c) Đồng nhất
(d) Có phân lớp, do C6H5NH2 không tan
(e) Đồng nhất
Chọn B
Câu 28:
Thực hiện các thí nghiệm sau:
(a) Cho thanh Mg vào dung dịch CuCl2
(b) Thả viên Zn vào dung dịch H2SO4 loãng
(c) Cho dây Ag vào dung dịch HCl
(d) Cho thanh Fe vào dung dịch FeCl3
(e) Trộn bột Fe với bột S rồi đun nóng
Số thí nghiệm xảy ra phản ứng là
 Xem đáp án
Xem đáp án
(a) Mg + CuCl2 —> MgCl2 + Cu
(b) Zn + H2SO4 —> ZnSO4 + H2
(c) Không phản ứng
(d) Fe + FeCl3 —> FeCl2
(e) Fe + S (t°) —> FeS
Chọn A
Câu 29:
Cho 4,6 gam Na tác dụng hết với 95,6 ml H2O thu được dung dịch X. Nồng độ % chất tan trong dung dịch X là
 Xem đáp án
Xem đáp án
2Na + 2H2O —> 2NaOH + H2
0,2……………………..0,2……0,1
mH2O = 95,6.1 = 95,6 gam
mddX = mNa + mH2O – mH2 = 100
—> C%NaOH = 0,2.40/100 = 8%
Chọn B
Câu 30:
Số đồng phân ancol thơm có công thức phân tử C8H10O khi tác dụng với CuO, đun nóng tạo anđehit là
 Xem đáp án
Xem đáp án
Để tạo anđehit thì ancol phải có nhóm -CH2OH. Các đồng phân thỏa mãn:
C6H5-CH2-CH2OH
CH3-C6H4-CH2OH (o, m, p)
Chọn C
Câu 31:
Đun nóng m gam hỗn hợp E chứa triglixerit X và các axit béo tự do với 200 ml dung dịch NaOH 1M (vừa đủ), thu được hỗn hợp Y chứa các muối có công thức chung C17HyCOONa. Đốt cháy 0,07 mol E thu được 1,845 mol CO2. Mặt khác m gam E tác dụng vừa đủ với 0,1 mol Br2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Các axit béo gọi chung là A. Các muối đều 18C nên X có 57C và A có 18C.
Số C = nCO2/nE = 369/14 —> nX : nA = 3 : 11
Trong phản ứng xà phòng hóa: nX = 3e và nA = 11e
—> nNaOH = 3.3e + 11e = 0,2 —> e = 0,01
Quy đổi E thành (C17H35COO)3C3H5 (3e), C17H35COOH (11e) và H2 (-0,1)
—> mE = 57,74
Chọn A
Câu 32:
Cho 0,03 mol hỗn hợp X gồm C và S tác dụng hết với lượng dư dung dịch H2SO4 đặc, nóng thu được V lít hỗn hợp khí Y gồm SO2 và CO2. Hấp thụ V/3 lít hỗn hợp Y vào 0,01 mol NaOH và 0,02 mol Ca(OH)2 thu được 2,3 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng S trong 0,03 mol X là:
 Xem đáp án
Xem đáp án
Đặt a, b là số mol C và S trong X —> a + b = 0,03 (1)
Bảo toàn electron: 4a + 6b = 2nSO2
—> nSO2 = 2a + 3b
nY = nCO2 + nSO2 = a + 2a + 3b = 0,09
Khi hấp thụ 1/3 lượng Y (ứng với 0,03 mol) vào kiềm:
nRO2 = 0,03 và nOH- = 0,05 —> nRO32- = 0,02; nHRO3- = 0,01
Dễ thấy nRO32- = nCa2+ nên Ca2+ đã kết tủa hết.
—> Kết tủa gồm CaCO3 (0,005) và CaSO3 (0,015)
Ta coi 2 khí SO2 và CO2 có khả năng tạo kết tủa như nhau —> a/(2a + 3b) = 0,005/0,015 (2)
(1)(2) —> a = 0,0225; b = 0,0075
—> %S = 47,06%
Chọn D
Câu 33:
Điện phân dung dịch X gồm CuSO4 và NaCl (tỉ lệ mol tương ứng là 5 : 4) với điện cực trơ, màng ngăn xốp, bằng dòng điện có cường độ không đổi 3,5A. Sau t giờ, thu được dung dịch Y có khối lượng giảm 27,3 gam so với khối lượng của X. Dung dịch Y hoà tan tối đa 2,7 gam Al. Bỏ qua sự hoà tan của chất khí trong nước và sự bay hơi nước, hiệu suất điện phân là 100%. Giá trị của t gần nhất với giá trị nào sau đây?.
 Xem đáp án
Xem đáp án
nCuSO4 = 5x và nNaCl = 4x
Y + Al (0,1 mol) —> Dung dịch chứa Na+ (4x), SO42- (5x), Al3+ (0,1)
Bảo toàn điện tích —> 4x + 0,1.3 = 2.5x
—> x = 0,05
Catot: nCu = 0,25 và nH2 = a
Anot: nCl2 = 0,1 và nO2 = b
Bảo toàn electron: 0,25.2 + 2a = 4b + 0,1.2
m giảm = 0,25.64 + 2a + 0,1.71 + 32b = 27,3
—> a = 0,1 và b = 0,125
ne = 0,25.2 + 2a = It/F
—> t = 19300s = 5,36h
Chọn C
Câu 34:
Cho m gam hỗn hợp X gồm Fe2O3, Fe3O4, Cu vào dung dịch H2SO4 loãng dư thấy có 0,25 mol axit phản ứng và còn lại 0,072m gam chất rắn không tan. Mặt khác, khử hoàn toàn m gam hỗn hợp X ở nhiệt độ cao bằng khí CO dư, thu được 16,0 gam chất rắn. Phần trăm khối lượng của Cu trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đặt a, b, c là số mol Fe2O3, Fe3O4, Cu
—> nH2SO4 phản ứng = nO = 3a + 4b = 0,25 (1)
m kim loại = 56(2a + 3b) + 64c = 16 (2)
—> m = 16 + 0,25.16 = 20
Chất rắn không tan là Cu dư (0,072m/64 = 0,0225 mol), bảo toàn electron:
2a + 2b = 2(c – 0,0225) (3)
(1)(2)(3) —> a = 0,3; b = 0,04; c = 0,0925
—> %Cu = 64c/20 = 29,6%
Chọn A
Câu 35:
Hỗn hợp X gồm metan, etilen, propin và vinyl axetilen có tỉ khối so với hiđro bằng 17. Đốt cháy hoàn toàn 0,05 mol X rồi cho toàn bộ sản phẩm hấp thụ vào 500 ml dung dịch Ca(OH)2 0,2M sau phản ứng thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Các chất đều 4H —> X là CxH4
MX = 12x + 4 = 17.2 —> x = 2,5
nX = 0,05 —> nCO2 = 0,05x = 0,125
nCa(OH)2 = 0,1 —> nCaCO3 = 0,075
—> mCaCO3 = 7,5 gam
Chọn D
Câu 36:
Có hai dung dịch X và Y chứa các ion khác nhau. Mỗi dung dịch chứa đúng hai loại cation và hai loại anion trong số các ion sau:
|
Ion |
Na+ |
Mg2+ |
NH4+ |
H+ |
Cl- |
SO42- |
NO3- |
CO32- |
|
Số mol |
0,2 |
0,15 |
0,25 |
0,3 |
0,4 |
0,1 |
0,25 |
0,1 |
Biết X hòa tan được Cu(OH)2. Khối lượng chất tan có trong Y gần nhất với giá trị nào sau đây ?
 Xem đáp án
Xem đáp án
Hai ion có phản ứng với nhau sẽ không nằm trong cùng 1 dung dịch.
X hòa tan được Cu(OH)2 —> X chứa H+ —> Y chứa CO32- —> X chứa Mg2+
Mỗi dung dịch chứa đúng hai loại cation và hai loại anion nên đã xác định được:
X chứa H+, Mg2+
Y chứa Na+, NH4+, CO32-
Bảo toàn điện tích cho Y thấy còn thiếu 0,25 mol điện tích 1- —> Chọn NO3- cho vào Y, hai ion âm còn lại cho vào X.
Vậy Y chứa Na+, NH4+, CO32-, NO3- —> m = 30,6 gam
Chọn B
Câu 37:
Hỗn hợp X gồm các chất Y (C5H14N2O4) và chất Z (C4H8N2O3); trong đó Y là muối của axit đa chức, Z là đipeptit mạch hở. Cho 21,5 gam X tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,1 mol hỗn hợp khí đều làm xanh quỳ tím ẩm, tỉ khối của mỗi khí so với không khí đều lớn hơn 1. Mặt khác 21,5 gam X tác dụng với dung dịch HCl dư đun nóng thu được m gam chất hữu cơ. Giá trị của m là
 Xem đáp án
Xem đáp án
Z là Gly-Gly, không tạo khí với NaOH, vậy hỗn hợp khí đều tạo ra từ Y.
M khí > 29 nên không có NH3. Vậy Y là:
CH3NH3-OOC-COO-NH3-C2H5
n khí = 0,1 —> nCH3NH2 = nC2H5NH2 = 0,05
—> nY = 0,05
—> nZ = 0,1
CH3NH3-OOC-COO-NH3-C2H5 + 2HCl —> HOOC-COOH + CH3NH3Cl + C2H5NH3Cl
Gly-Gly + H2O + 2HCl —> 2GlyHCl
—> m hữu cơ = mX + mH2O + mHCl = 34,25 gam
Chọn D
Câu 38:
Cho E (C3H6O3) và F (C4H6O4) là hai chất hữu cơ mạch hở đều tạo từ axit cacboxylic và ancol. Từ E và F thực hiện sơ đồ các phản ứng sau:
(1) E + NaOH → X + Y
(2) F + NaOH → X + Y
(3) X + HCl → Z + NaCl
Biết X, Y, Z là các chất hữu cơ, trong đó phân tử Y không có nhóm -CH3. Cho các phát biểu sau:
(a) Chất E và F đều là các este đa chức.
(b) Có hai công thức cấu tạo phù hợp với chất E.
(c) Chất X có khả năng tham gia phản ứng tráng bạc.
(d) Nhiệt độ sôi của chất Z cao hơn nhiệt độ sôi của ancol etylic.
(e) Cho a mol chất E tác dụng với Na dư thu được a mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
E, F tạo sản phẩm giống nhau khi tác dụng với NaOH và Y không có nhóm -CH3 nên:
E là HCOO-CH2-CH2-OH
F là (HCOO)2C2H4
(3) —> X là muối HCOONa —> Z là HCOOH
Y là C2H4(OH)2
(a) Sai, E là hợp chất tạp chức, F là este đa chức.
(b) Sai, E có cấu tạo duy nhất.
(c) Đúng, X là NaO-CHO nên có tráng bạc.
(d) Đúng, Z có liên kết H liên phân tử bền hơn C2H5OH nên Z có nhiệt độ sôi của ancol etylic.
(e) Sai: HCOOCH2CH2OH + Na —> HCOOCH2CH2ONa + 0,5H2
Chọn B
Câu 39:
Cho m gam X gồm Fe, Fe3O4, Mg và MgO vào dung dịch H2SO4 đặc (lấy dư 50% so với lượng phản ứng) đun nóng đến phản ứng hoàn toàn, thu được dung dịch Y và 2,688 lít khí SO2 (sản phẩm khử duy nhất của S+6). Cho Ba(OH)2 dư vào Y thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi, thu được 197,95 gam chất rắn. Mặt khác, hòa tan hết m gam X bằng dung dịch chứa 0,76 mol HCl, thu được 896 ml H2 và dung dịch E chỉ chứa các muối. Cô cạn E thu được hỗn hợp muối khan T. Phần trăm khối lượng muối có phân tử khối nhỏ nhất trong T là
 Xem đáp án
Xem đáp án
nHCl = 0,76; nH2 = 0,04
Bảo toàn H —> nH2O = 0,34 —> nO(X) = 0,34
Quy đổi X thành Mg (a), Fe (b) và O (0,34)
Bảo toàn electron: 2a + 3b = 2.0,34 + 0,12.2 (1)
nH2SO4 phản ứng = a + 1,5b + 0,12 = 0,58
—> nH2SO4 dư = 0,58.50% = 0,29
—> nSO42-(Y) = a + 1,5b + 0,29
m rắn = 40a + 160b/2 + 233(a + 1,5b + 0,29) = 197,95 (2)
(1)(2) —> a = 0,1; b = 0,24
T gồm MgCl2 (0,1), FeCl2 (u) và FeCl3 (v)
Bảo toàn Cl —> 0,1.2 + 2u + 3v = 0,76
Bảo toàn Fe —> u + v = 0,24
—> u = 0,16; v = 0,08
Muối có M nhỏ nhất: %MgCl2 = 22,19%
Chọn A
