Thi Online (2023) Đề thi thử Hóa THPT Bạch Đằng, Hải Phòng (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Bạch Đằng, Hải Phòng (Lần 1) có đáp án
-
518 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Dung dịch nào sau đây làm phenolphtalein đổi màu?
 Xem đáp án
Xem đáp án
Các dung dịch có môi trường kiềm làm phenolphtalein đổi màu, các dung dịch có môi trường trung tính hoặc axit không làm phenolphtalein đổi màu.
—> Metylamin (CH3NH2) có môi trường kiềm làm phenolphtalein đổi màu hồng.
Chọn A
Câu 2:
Dung dịch nào sau đây có pH < 7?
 Xem đáp án
Xem đáp án
Dung dịch HCl có pH < 7.
Còn lại, dung dịch KOH (pH > 7) và K2SO4, NaCl (pH = 7)
Chọn C
Câu 3:
Ở điều kiện thường, chất nào sau đây tồn tại ở thể rắn, có cấu tạo ion lưỡng cực?
 Xem đáp án
Xem đáp án
Chọn B
Câu 4:
Chất nào sau đây có khả năng làm mềm nước cứng vĩnh cửu?
 Xem đáp án
Xem đáp án
Na3PO4 có khả năng làm mềm nước cứng vĩnh cửu do loại bỏ được Ca2+, Mg2+ ra khỏi dung dịch:
Ca2+ + PO43- —> Ca3(PO4)2
Mg2+ + PO43- —> Mg3(PO4)2
Chọn A
Câu 8:
Vật liệu tổng hợp X có dạng sợi dài, mảnh và giữ nhiệt tốt, thường dùng để dệt vải may quần áo ấm hoặc dệt thành sợi (len) đan áo rét. X bền với nhiệt, bền trong môi trường axit và bazơ.Vật liệu X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 9:
Dung dịch muối nào sau đây bị phân hủy khi đun nóng?
 Xem đáp án
Xem đáp án
Dung dịch muối Ca(HCO3)2 bị phân hủy khi đun nóng:
Ca(HCO3)2 —> CaCO3 + CO2 + H2O
Chọn A
Câu 10:
Kim loại X là kim loại cứng nhất, được sử dụng để mạ các dụng cụ kim loại, chế tạo các loại thép chống gỉ, không gỉ…Kim loại X là?
 Xem đáp án
Xem đáp án
Chọn D
Câu 12:
Không thể điều chế kim loại nào sau đây bằng phương pháp thủy luyện?
 Xem đáp án
Xem đáp án
Không thể điều chế kim loại K bằng phương pháp thủy luyện vì K+ không bị khử trong nước (ngược lại, K khử được H2O ở điều kiện thường).
Chọn A
Câu 14:
Thủy phân hoàn toàn tetrapeptit Ala-Gly-Ala-Val bằng enzim, thu được bao nhiêu loại amino axit?
 Xem đáp án
Xem đáp án
Thủy phân hoàn toàn tetrapeptit Ala-Gly-Ala-Val bằng enzim, thu được 3 loại amino axit là: Gly, Ala, Val
Chọn C
Câu 15:
Kim loại nào sau đây khử được ion Zn2+?
 Xem đáp án
Xem đáp án
Kim loại Mg khử được ion Zn2+:
Mg + Zn2+ —> Mg2+ + Zn
Các kim loại còn lại có tính khử yếu hơn Zn nên không khử được Zn2+.
Chọn D
Câu 16:
Thí nghiệm Cu tác dụng với axit HNO3 đặc, giải phóng khí NO2 rất độc. Để loại bỏ NO2, sau khi cho Cu vào ống nghiệm, người ta nút ống nghiệm bằng bông tẩm dung dịch chất X. Công thức của X là
 Xem đáp án
Xem đáp án
Để loại bỏ NO2 người ta nút ống nghiệm bằng bông tẩm dung dịch NaOH vì:
NO2 + NaOH —> NaNO3 + NaNO2 + H2O
Chọn B
Câu 18:
Muối mono natri của amino axit nào sau đây được dùng làm bột ngọt (mì chính)?
 Xem đáp án
Xem đáp án
Chọn C
Câu 19:
Các este thường có mùi thơm đặc trưng, etyl propionat có mùi dứa. Công thức cấu tạo thu gọn của etyl propionat là
 Xem đáp án
Xem đáp án
Chọn A
Câu 20:
Chất X làm cho nước biển có vị mặn, được sử dụng phổ biến như là gia vị và chất bảo quản thực phẩm. Công thức của X là
 Xem đáp án
Xem đáp án
Công thức của X là NaCl.
Chọn D
Câu 21:
Đốt cháy hoàn toàn m gam glyxin trong O2 thu được N2, H2O và 2,24 lít CO2 (ở đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
nCO2 = 0,1 —> nGly = 0,05 —> mGly = 3,75 gam
Chọn A
Câu 22:
Đun nóng 14,6 gam Gly-Ala với lượng dư dung dịch NaOH. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Gly-Ala + 2NaOH —> GlyNa + AlaNa + H2O
—> nGlyNa = nAlaNa = nGly-Ala = 0,1
—> m muối = mGlyNa + mAlaNa = 20,8 gam
Chọn A
Câu 23:
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3. Hai kim loại X, Y lần lượt là
 Xem đáp án
Xem đáp án
X là kim loại phản ứng được với dung dịch H2SO4 loãng, Y là kim loại tác dụng được với dung dịch Fe(NO3)3 —> X là Fe, Y là Cu:
Fe + H2SO4 —> FeSO4 + H2
Cu + Fe2(SO4)3 —> 2FeSO4 + CuSO4
Chọn C
Câu 24:
Thực hiện phản ứng tráng gương 36 gam dung dịch fructozơ 10% với lượng dung dịch AgNO3 trong NH3, nếu hiệu suất phản ứng 40% thì khối lượng bạc kim loại thu được là
 Xem đáp án
Xem đáp án
nC6H12O6 = 36.10%/180 = 0,02
H = 40% —> nAg = 0,02.2.40% = 0,016
—> mAg = 1,728 gam
Chọn C
Câu 25:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai, ăn mòn hóa học không phát sinh dòng điện.
B. Đúng, Ca(HCO3)2 thể hiện tính axit (nhường proton) với NaOH, thể hiện tính bazơ (nhận proton) với HCl.
C. Đúng, do có cặp điện cực Zn-Cu (Cu tạo ra do Zn khử Cu2+) tiếp xúc với môi trường điện li nên có ăn mòn điện hóa.
D. Đúng: KHCO3 —> K2CO3 + CO2 + H2O
Chọn A
Câu 26:
Chất X được dùng làm thuốc tăng lực cho người già, trẻ nhỏ và người ốm. Trong công nghiệp, X dùng làm nguyên liệu để điều chế chất Y. Y được dùng để sản xuất xăng E5. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Chất X được dùng làm thuốc tăng lực cho người già, trẻ nhỏ và người ốm —> X là glucozơ.
X dùng làm nguyên liệu để điều chế chất Y. Y được dùng để sản xuất xăng E5 —> Y là ancol etylic.
—> B sai, MY = 46
Chọn B
Câu 27:
Thủy phân hoàn toàn hỗn hợp metyl axetat và metyl acrylat trong dung dịch NaOH, thu được sản phẩm gồm
 Xem đáp án
Xem đáp án
CH3COOCH3 + NaOH —> CH3COONa + CH3OH
CH2=CHCOOCH3 + NaOH —> CH2=CHCOONa + CH3OH
—> Sản phẩm gồm 2 muối và 1 ancol.
Chọn C
Câu 28:
Cho 11,6 gam Fe vào 100 ml dung dịch CuSO4 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được m gam hỗn hợp kim loại. Giá trị của m là
 Xem đáp án
Xem đáp án
nFe = 11,6/56 > nCu2+ = 0,1 nên Cu2+ bị khử hết.
m = 11,6 – 0,1.56 + 0,1.64 = 12,4 gam
Chọn C
Câu 29:
Cho các phát biểu sau:
(a) Đun chất béo với dung dịch Ca(OH)2 trong thùng kín ở nhiệt độ cao, thu được xà phòng.
(b) Túi nilon làm từ nhựa polietilen rất khó bị phân hủy, gây ô nhiễm cho môi trường.
(c) Đipeptit Glu-Lys tác dụng với dung dịch HCl theo tỉ lệ mol 1 : 2.
(d) Dung dịch alanin tạo kết tủa trắng với nước brom.
(e) Tơ tằm kém bền trong môi trường axit và môi trường kiềm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, xà phòng là muối natri hoặc kali của axit béo. Muối canxi của axit béo không tan, không thuộc loại xà phòng.
(b) Đúng
(c) Sai, Glu-Lys có 3N nên tác dụng với dung dịch HCl theo tỉ lệ mol 1 : 3.
(d) Sai, alanin không phản ứng với Br2.
(e) Đúng, tơ tằm chứa -CONH- dễ bị thủy phân trong môi trường axit và môi trường kiềm.
Chọn B
Câu 30:
Cho 6,2 gam hợp chất hữu cơ X có công thức phân tử là C3H12O3N2 tác dụng vừa đủ với 100 ml dung dịch NaOH 1M, thu được một chất hữu cơ ở thể khí có thể tích là V lít (ở đktc) và dung dịch Z chỉ chứa các chất vô cơ, cô cạn dung dịch Z thu được m gam chất rắn khan. Giá trị của m và V lần lượt là:
 Xem đáp án
Xem đáp án
(CH3NH3)2CO3 + 2NaOH —> Na2CO3 + 2CH3NH2 + 2H2O
nX = 0,05; nNaOH = 0,1 —> nCH3NH2 = 0,1 —> V = 2,24 lít
Z chứa Na2CO3 (0,05) —> m = 5,3 gam
Chọn D
Câu 31:
Cho sơ đồ chuyển hóa:
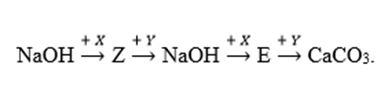
Biết: X, Y, Z, E là các hợp chất khác nhau và khác CaCO3; mỗi mũi tên ứng với một phương trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Các chất X, Y thỏa mãn sơ đồ trên lần lượt là Ca(HCO3)2, Ca(OH)2; Z là NaHCO3, E là Na2CO3
NaOH + Ca(HCO3)2 —> NaHCO3 + CaCO3 + H2O
NaHCO3 + Ca(OH)2 —> CaCO3 + NaOH + H2O
2NaOH + Ca(HCO3)2 —> Na2CO3 + CaCO3 + 2H2O
Na2CO3 + Ca(OH)2 —> CaCO3 + 2NaOH
Chọn C
Câu 32:
Tiến hành các thí nghiệm sau:
(a) Dẫn 2a mol CO2 vào dung dịch chứa a mol Ba(OH)2 và a mol NaOH.
(b) Cho dung dịch Ba(NO3)2 vào dung dịch NaHCO3.
(c) Cho hỗn hợp bột Cu và Fe2(SO4)3 (tỉ lệ mol 1:1) vào nước dư.
(d) Cho 5a mol Mg vào dung dịch chứa 2a mol FeCl3.
(e) Cho dung dịch AgNO3 vào dung dịch FeCl3.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
(a) nOH-/nCO2 = 1,5 —> Tạo CO32-, HCO3- —> Có BaCO3
(b) Không phản ứng
(c) Cu + Fe2(SO4)3 —> CuSO4 + 2FeSO4
(d) 2nMg > nFe3+ nên có tạo Fe.
(e) AgNO3 + FeCl3 —> Fe(NO3)3 + AgCl
Chọn A
Câu 33:
Tiến hành thí nghiệm theo các bước sau:
- Bước 1: Cho 5 giọt dung dịch CuSO4 0,5% vào ống nghiệm sạch.
- Bước 2: Thêm 1 ml dung dịch NaOH 10% vào ống nghiệm, lắc đều; gạn phần dung dịch, giữ lại kết tủa.
- Bước 3: Thêm tiếp 2 ml dung dịch glucozơ 1% vào ống nghiệm, lắc đều.
Cho các phát biểu sau:
(a) Sau bước 2 thu được kết tủa màu đỏ.
(b) Nếu thay dung dịch NaOH ở bước 2 bằng dung dịch KOH thì hiện tượng ở bước 3 vẫn tương tự.
(c) Sau bước 3, kết tủa đã bị hòa tan, thu được dung dịch màu tím.
(d) Ở bước 3, nếu thay glucozơ bằng saccarozơ thì hiện tượng xảy ra vẫn tương tự.
(e) Thí nghiệm trên chứng minh glucozơ có tính chất của anđehit.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, thu được kết tủa màu xanh là Cu(OH)2
(b) Đúng, OH- tham gia các phản ứng nên NaOH hay KOH đều cho hiện tượng giống nhau.
(c) Sai, kết tủa bị hòa tan tạo dung dịch xanh lam.
(d) Đúng, saccarozơ cũng có nhiều OH kề nhau nên thể hiện tính chất của ancol đa chức giống glucozơ.
(e) Sai, thí nghiệm chứng minh glucozơ có tính chất của ancol đa chức.
Chọn A
Câu 34:
Cho 4,536 gam hỗn hợp chất rắn X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó, nguyên tố oxi chiếm 28,57% về khối lượng hỗn hợp) vào dung dịch chứa 0,018 mol HNO3 và 0,246 mol KHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 36,198 gam và hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Phần trăm về số mol của N2 trong Z là
 Xem đáp án
Xem đáp án
Dung dịch muối chứa Mg2+ (u), NH4+ (v), K+ (0,246), SO42- (0,246)
m muối = 24u + 18v + 0,246.39 + 0,246.96 = 36,198
Bảo toàn điện tích: 2u + v + 0,246 = 0,246.2
—> u = 0,12 và v = 0,006
Đặt x, y, z là số mol Mg, MgCO3 và Mg(NO3)2
—> mX = 24x + 84y + 148z = 4,536
nO = 3y + 6z = 4,536.28,57%/16 = 0,081
Bảo toàn Mg —> x + y + z = 0,12
—> x = 0,102; y = 0,009; z = 0,009
Vậy nN2O = nCO2 = 0,009
Đặt nN2 = a và nH2 = b
—> nH+ = 12a + 2b + 0,006.10 + 0,009.10 + 0,009.2 = 0,018 + 0,246
Bảo toàn H —> nH2O = 0,12 – b
Bảo toàn O —> 0,081 + 0,018.3 = 0,009 + 0,009.2 + 0,12 – b
—> a = 0,006 và b = 0,012
—> %nN2 = 16,67%
Chọn A
Câu 35:
Hỗn hợp hơi X chứa butan, butylamin, isopropyl axetat. Đốt cháy hoàn toàn m gam (tương ứng với 0,15 mol) gồm valin và X cần dùng 0,9975 mol O2, thu được CO2, H2O và N2. Mặt khác, m gam hỗn hợp valin và X phản ứng vừa hết với 60 ml dung dịch NaOH 1M. Giá trị của m là
 Xem đáp án
Xem đáp án
C4H9NH2 = C4H10 + NH
CH3COOCH(CH3)2 = C4H10 + CO2
Val = C4H10 + CO2 + NH
nCO2 = nNaOH = 0,06
Quy đổi hỗn hợp thành C4H10 (0,15), NH (x) và CO2 (0,06)
nO2 = 0,15.6,5 + 0,25x = 0,9975 —> x = 0,09
—> m = 12,69 gamCâu 36:
Cho sơ đồ phản ứng theo đúng tỉ lệ mol như sau:
(1) X + 2NaOH → 2X1 + X2
(2) X1 + HCl → X3 + NaCl
(3) X2 + 2AgNO3 + 3NH3 + H2O → X4 + 2NH4NO3 + 2Ag↓
Biết X mạch hở, có công thức phân tử là C6H8O5; X1 có hai nguyên tử cacbon trong phân tử. Cho các phát biểu sau:
(a) Đốt cháy 1,2 mol X1 cần vừa đủ 1,8 mol O2 (hiệu suất phản ứng 100%).
(b) X3 là hợp chất hữu cơ tạp chức.
(c) Phân tử khối của X1 là 82.
(d) Phân tử X4 có bảy nguyên tử hiđro.
(e) X2 là axetanđehit.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
X1 có 2C nên X2 cũng có 2C
X là HO-CH2-COO-CH2-COO-CH=CH2
X1 là HO-CH2-COONa
X2 là CH3CHO
X3 là HO-CH2-COOH
X4 là CH3COONH4
(a) Đúng:
2C2H3O3Na + 3O2 —> Na2CO3 + 3CO2 + 3H2O
(b) Đúng, X3 có chức -OH, -COOH.
(c) Sai, MX1 = 98
(d)(e) Đúng
Chọn A
Câu 37:
Đun nóng m gam hỗn hợp E chứa triglixerit X và các axit béo tự do với 300 ml dung dịch KOH 1M (vừa đủ), thu được glixerol và hỗn hợp Y chứa các muối có công thức chung C17HyCOOK. Đốt cháy 0,14 mol E, thu được 3,69 mol CO2. Mặt khác, m gam E tác dụng vừa đủ với 0,25 mol Br2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Số C = nCO2/nE = 369/14
Đặt nX = x và n axit béo tổng = y
—> nC = 57x + 18y = 369(x + y)/14
nKOH = 3x + y = 0,3
—> x = 0,045; y = 0,165
Quy đổi E thành (C17H35COO)3C3H5 (0,045), C17H35COOH (0,165) và H2 (-0,25)
—> mE = 86,41 gam
Chọn C
Câu 38:
Hỗn hợp X chứa ba este thuần chức, mạch hở gồm một este đơn chức và hai este hai chức. Đun nóng 0,2 mol X với dung dịch NaOH vừa đủ, thu được 26,32 gam muối duy nhất và hỗn hợp Y gồm ba ancol no, trong đó có hai ancol hơn kém nhau một nguyên tử cacbon. Đốt cháy hoàn toàn Y cần dùng 0,545 mol O2, thu được 10,62 gam H2O. Phần trăm khối lượng của este hai chức có khối lượng phân tử lớn trong X là
 Xem đáp án
Xem đáp án
nY = 0,2; nH2O = 0,59
nY = nH2O – nCO2 —> nCO2 = 0,39
—> Số C = nCO2/nY = 1,95
—> Y chứa CH3OH (a) và CnH2n+2O2 (b)
nY = a + b = 0,2
Bảo toàn O —> a + 2b + 0,545.2 = 0,39.2 + 0,59
—> a = 0,12 và b = 0,08
—> nCO2 = 0,12 + 0,08n = 0,39
—> n = 3,375
—> C3H8O2 (0,05) và C4H10O2 (0,03)
n muối = a + 2b = 0,28 —> M muối = 94: C2H3COONa
X gồm:
C2H3COOCH3 (0,12)
(C2H3COO)2C3H6 (0,05)
(C2H3COO)2C4H8 (0,03) —> % = 23,33%
Chọn C
Câu 39:
Dẫn từ từ đến dư khí CO2 vào dung dịch chứa 0,2 mol Ba(OH)2. Sự phụ thuộc của số mol kết tủa (a mol) vào số mol khí CO2 tham gia phản ứng (b mol) được biểu diễn như đồ thị sau:
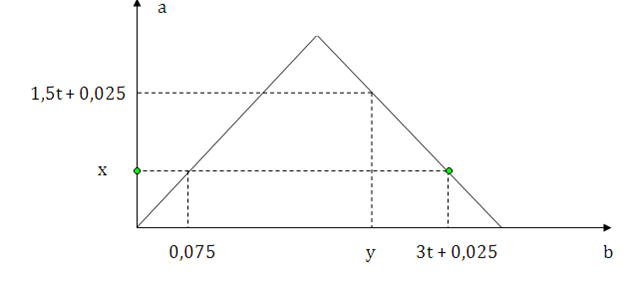
Tỉ lệ y : x là
 Xem đáp án
Xem đáp án
Đoạn 1: CO2 + Ba(OH)2 —> BaCO3 + H2O
—> x = 0,075
Đoạn 2: CO2 + H2O + BaCO3 —> Ba(HCO3)2
+ Khi nCO2 = y thì nBaCO3 = 1,5t + 0,025
Bảo toàn Ba —> nBa(HCO3)2 = 0,175 – 1,5t
Bảo toàn C —> (1,5t + 0,025) + 2(0,175 – 1,5t) = y (1)
+ Khi nCO2 = 3t + 0,025 thì nBaCO3 = 0,075
Bảo toàn Ba —> nBa(HCO3)2 = 0,125
Bảo toàn C —> 0,075 + 2.0,125 = 3t + 0,025 (2)
(1)(2) —> y = 0,225; t = 0,1
—> y : x = 3
Chọn C
Câu 40:
Nung nóng hỗn hợp X gồm metan, etilen, propin, vinyl axetilen và a mol H2 có Ni xúc tác (chỉ xảy ra phản ứng cộng H2), thu được 0,4 mol hỗn hợp Y (gồm các hiđrocacbon) có tỉ khối so với H2 là 18. Biết 0,1 mol Y phản ứng tối đa với 0,05 mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Y có dạng CnH2n+2-2k với k = nBr2/nY = 0,5
MY = 14n + 2 – 2k = 18.2
—> n = 2,5 —> Y là C2,5H6
Phản ứng cộng H2 không làm thay đổi số C nên các hiđrocacbon trong X có dạng C2,5H4.
C2,5H4 + H2 —> C2,5H6
—> nH2 = nY = 0,4
Chọn C
