Thi Online (2023) Đề thi thử Hóa THPT Nghèn, Hà Tĩnh (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Nghèn, Hà Tĩnh (Lần 1) có đáp án
-
550 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
Thủy phân hoàn toàn 1 mol peptit mạch hở X chỉ thu được 3 mol Gly và 1 mol Ala. Số liên kết peptit trong phân tử X là
 Xem đáp án
Xem đáp án
X là (Gly)3(Ala) —> X có 3 liên kết peptit.
Chọn C
Câu 3:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai, kim loại dẫn điện tốt nhất là Ag
B. Đúng, Al thụ động trong H2SO4 đặc nguội nên có thể dùng thùng nhôm đựng axit sunfuric đặc, nguội.
C. Đúng: Hg + S —> HgS
D. Đúng
Chọn A
Câu 6:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Đúng
B. Sai, tơ nilon-6,6 thuộc loại tơ tổng hợp.
C. Sai, tơ poliamit có nhóm amit -CONH- bị thủy phân trong môi trường axit.
D. Sai, tơ nitron được điều chế bằng phản ứng trùng hợp CH2=CH-CN.
Chọn A
Câu 11:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A. Sai, tinh bột và xenlulozơ có số mắt xích khác nhau nên CTPT khác nhau.
B. Đúng
C. Sai, saccarozơ là đường mía, glucozơ là đường nho.
D. Sai, thủy phân saccarozơ thu được glucozơ và fructozơ.
Chọn B
Câu 12:
Trường hợp nào sau đây không xảy ra phản ứng?
 Xem đáp án
Xem đáp án
A. Fe + Fe2(SO4)3 —> FeSO4
B. Fe + CuSO4 —> FeSO4 + Cu
C. Cu + HNO3 —> Cu(NO3)2 + NO + H2O
D. Không phản ứng\
Chọn D
Câu 13:
Cây xanh được coi là "lá phổi của trái đất" vì trong quá trình quang hợp của cây xanh làm giảm nồng độ CO2 và tạo ra khí
 Xem đáp án
Xem đáp án
Chọn C
Câu 14:
Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch, lắc nhẹ, sau đó nhỏ từ từ từng giọt dung dịch NH3 2M cho đến khi kết tủa sinh ra bị hòa tan hết. Nhỏ tiếp 3 - 5 giọt dung dịch X, sau đó ngâm ống nghiệm chứa hỗn hợp phản ứng vào cốc nước nóng (khoảng 70 - 80°C) trong vài phút. Trên thành ống nghiệm xuất hiện lớp bạc sáng. Chất X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 15:
Vào mùa đông, nhiều gia đình sử dụng bếp than đặt trong phòng kín để sưởi ấm gây ngộ độc khí, có thể dẫn tới tử vong. Nguyên nhân gây ngộ độc là do khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A
Câu 16:
Oxit nào sau đây bị oxi hóa khi phản ứng với dung dịch HNO3 loãng?
 Xem đáp án
Xem đáp án
Fe3O4 bị oxi hóa khi tác dụng với HNO3 loãng (số oxi hóa của Fe tăng từ +8/3 lên +3):
Fe3O4 + HNO3 —> Fe(NO3)3 + NO + H2O
Chọn A
Câu 21:
Chất X là chất dinh dưỡng, được dùng làm thuốc tăng lực cho người già, trẻ nhỏ và người ốm. Tương tự chất X, chất Y bị oxi hoá bởi dung dịch AgNO3 trong amoniac. Đây là phản ứng của nhóm anđehit xuất hiện do trong môi trường bazơ, chất Y chuyển thành chất X. Tên gọi của Y, X lần lượt là
 Xem đáp án
Xem đáp án
Chất X là chất dinh dưỡng, được dùng làm thuốc tăng lực cho người già, trẻ nhỏ và người ốm —> X là glucozơ.
Y chuyển thành chất X trong môi trường bazơ nên Y là fructozơ.
Chọn A
Câu 22:
Cho 38,1 gam hỗn hợp X gồm CH3COOC6H5 (phenyl axetat) và Val-Gly-Ala (tỉ lệ mol 1:1) tác dụng với lượng dư dung dịch NaOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
nCH3COOC6H5 = nVal-Gly-Ala = x
—> 136x + 245x = 38,1
—> x = 0,1
—> nNaOH = 2x + 3x = 0,5 và nH2O = x + x = 0,2
Bảo toàn khối lượng —> m muối = 54,5
Chọn B
Câu 23:
Bốn kim loại Na, Al, Fe và Cu được ấn định không theo thứ tự X, Y, Z, T. Biết rằng:
- X, Y được điều chế bằng phương pháp điện phân nóng chảy;
- X đẩy được kim loại T ra khỏi dung dịch muối;
- Z tác dụng được với dung dịch H2SO4 loãng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội.
Các chất X, Y, Z, T theo thứ tự là:
 Xem đáp án
Xem đáp án
X và Y được điều chế bằng phương pháp điện phân nóng chảy —> X, Y là Na, Al
X đẩy được kim loại T ra khỏi dung dịch muối —> X là Al —> Y là Na
Z tác dụng được với dung dịch H2SO4 loãng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội —> Z là Fe
—> Còn lại T là Cu
Các kim loại X, Y, Z, và T theo thứ tự là Al, Na, Fe, và Cu
Chọn C
Câu 24:
Cho hỗn hợp X gồm amino axit Y (H2NCxHyCOOH) và 0,01 mol H2NC3H5(COOH)2 tác dụng với 50 ml dung dịch HCl 1M, thu được dung dịch Z. Dung dịch Z tác dụng vừa đủ với dung dịch chứa 0,04 mol NaOH và 0,05 mol KOH, thu được dung dịch chứa 8,135 gam muối. Phân tử khối của Y là
 Xem đáp án
Xem đáp án
Muối chứa:
NH2-R-COO-: y mol
NH2-C3H5(COO-)2: 0,01 mol
Cl-: 0,05 mol
Na+: 0,04
K+: 0,05
Bảo toàn điện tích —> y = 0,02
m muối = 8,135 —> R = 42
—> MY = 103
Chọn D
Câu 25:
Đun nóng 3,0 gam CH3COOH với 3,2 gam CH3OH (có H2SO4 làm xúc tác, hiệu suất phản ứng este hoá bằng 60%). Khối lượng este tạo thành là
 Xem đáp án
Xem đáp án
CH3COOH + CH3OH ⇔ CH3COOCH3 + H2O
nCH3COOH = 0,05; nCH3OH = 0,1
H = 60% —> nCH3COOCH3 = 0,05.60% = 0,03
—> mCH3COOCH3 = 2,22 gam
Chọn C
Câu 26:
Đốt cháy hoàn toàn m gam hỗn hợp X gồm glucozơ, saccarozơ, tinh bột, xenlulozơ cần dùng 1,2 mol O2 thu được CO2 và H2O. Thuỷ phân hoàn toàn m gam X rồi cho toàn bộ sản phẩm thu được tác dụng với dung dịch AgNO3 trong môi trường NH3, sau phản ứng thu được a gam kết tủa bạc. Giá trị của a là
 Xem đáp án
Xem đáp án
Các chất đều có dạng Cn(H2O)m nên nC = nO2 = 1,2
—> nC6 = 1,2/6 = 0,2
—> nAg = 2nC6 = 0,4 —> mAg = 43,2 gam
Chọn C
Câu 27:
Hòa tan hoàn toàn 13,8 gam hỗn hợp X gồm Al, Fe vào dung dịch H2SO4 loãng, thu được 10,08 lít khí (đktc). Phần trăm về khối lượng của Al trong X là
 Xem đáp án
Xem đáp án
Đặt a, b là số mol Al, Fe
mX = 27a + 56b = 13,8
nH2 = 1,5a + b = 0,45
—> a = 0,2 và b = 0,15
—> %Al = 27a/13,8 = 39,13%
Chọn A
Câu 28:
Ở bên dưới là hình ảnh trên bao phân đạm Hà Bắc. Thông tin trên bao ghi: Nitơ 46,3%, khối lượng tịnh 50kg. Biết thành phần chính của đạm ure là (NH2)2CO. Khối lượng (NH2)2CO ít nhất có trong một bao phân đạm ure Hà Bắc là
 Xem đáp án
Xem đáp án
nN = 50.46,3%/14 = 1,6536 kmol
—> n(NH2)2CO = nN/2 = 0,8268 kmol
—> m(NH2)2CO = 49,608 kg
Chọn A
Câu 29:
Cho các sơ đồ phản ứng theo đúng tỉ lệ mol:
(a) X + 2NaOH → X1 + X2 + H2O (đun nóng)
(b) X1 + H2SO4 → X3 + Na2SO4
(c) nX3 + nX4 → Poli(etilen terephtalat) + 2nH2O (đun nóng, xúc tác)
(d) X3 + 2X2 ↔ X5 + 2H2O (đun nóng, H2SO4 đặc xúc tác)
Cho biết: X là hợp chất hữu cơ có công thức phân tử C9H8O4; X1, X2, X3, X4, X5 là các hợp chất hữu cơ khác nhau. Phân tử khối của X5 là:
 Xem đáp án
Xem đáp án
(b), (c) —> X1 là C6H4(COONa)2; X3 là C6H4(COOH)2, X4 là C2H4(OH)2
(a) có H2O nên X chứa chức axit
—> X là CH3-OOC-C6H4-COOH
và X2 là CH3OH
(d) —> X5 là C6H4(COOCH3)2
—> MX5 = 194
Chọn D
Câu 30:
Cho các dung dịch: glixerol, anbumin, saccarozơ, glucozơ, tinh bột. Số dung dịch phản ứng với Cu(OH)2 trong môi trường kiềm là
 Xem đáp án
Xem đáp án
Trừ tinh bột, 4 chất còn lại có phản ứng với Cu(OH)2 trong môi trường kiềm, trong đó glixerol, saccarozơ, glucozơ thể hiện tính chất của poliancol (tạo phức xanh lam), anbumin có phản ứng màu biure (tạo phức màu tím).
Chọn B
Câu 31:
Cho các phát biểu sau:
(a) Cho khí H2 dư qua hỗn hợp bột Fe2O3 và CuO nung nóng, thu được Fe và Cu.
(b) Cho kim loại Ba tác dụng với dung dịch CuSO4, thu được kim loại Cu.
(c) Cho AgNO3 tác dụng với dung dịch FeCl3, thu được kim loại Ag.
(d) Để gang trong không khí ẩm lâu ngày có xảy ra ăn mòn điện hóa học.
(e) Dùng bột lưu huỳnh để xử lí thủy ngân khi nhiệt kế bị vỡ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng:
Fe2O3 + H2 —> Fe + H2O
CuO + H2 —> Cu + H2O
(b) Sai, Ba khử H2O trước:
Ba + H2O —> Ba(OH)2 + H2
Ba(OH)2 + CuSO4 —> BaSO4 + Cu(OH)2
(c) Sai: FeCl3 + AgNO3 —> Fe(NO3)3 + AgCl
(d) Đúng, cặp điện cực Fe – C, môi trường điện li là không khí ẩm nên khi chúng tiếp xúc với nhau sẽ có ăn mòn điện hòa
(e) Đúng: Hg + S —> HgS xảy ra ở điều kiện thường, sản phẩm HgS ở thể rắn, không bay hơi, dễ thu gom và ít độc hơn.
Chọn C
Câu 32:
Nung nóng a mol hỗn hợp X gồm propen, axetilen và hiđro với xúc tác Ni trong bình kín (chỉ xảy ra phản ứng cộng hiđro), thu được hỗn hợp khí Y có tỉ khối so với H2 là 17. Đốt cháy hết Y thu được 0,84 mol CO2 và 1,08 mol H2O. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
 Xem đáp án
Xem đáp án
mY = mC + mH = 12,24 —> nY = 0,36
Dễ thấy nY > nH2O – nCO2 nên H2 đã phản ứng hết.
X gồm C2H2 (x), C3H6 (y), H2 (z)
nY = x + y = 0,36
nCO2 = 2x + 3y = 0,84
nH2O = x + 3y + z = 1,08
—> x = 0,24; y = 0,12; z = 0,48
—> a = x + y + z = 0,84
Chọn C
Câu 33:
Hỗn hợp E gồm ba este mạch hở X, Y và Z, trong đó có một este hai chức và hai este đơn chức; MX < MY < MZ. Đốt cháy hết 27,26 gam E cần vừa đủ 1,195 mol O2, thu được H2O và 1,1 mol CO2. Mặt khác, thủy phân hoàn toàn 27,26 gam E trong dung dịch NaOH dư, thu được hỗn hợp các muối của axit cacboxylic no và 14,96 gam hỗn hợp hai ancol kế tiếp nhau trong dãy đồng đẳng. Khối lượng của Y trong 27,26 gam E là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng —> nH2O = 0,95
—> nO(E) = (mE – mC – mH)/16 = 0,76
—> nAncol = nNaOH = nO(E)/2 = 0,38
—> M ancol = 39,37
—> Ancol gồm CH3OH (0,18) và C2H5OH (0,2)
nEste đôi = nCO2 – nH2O = 0,15
Bảo toàn O —> nEste đơn = 0,08
Quy đổi muối thành HCOONa (0,08), (COONa)2 (0,15) và CH2
Bảo toàn khối lượng —> m muối = 27,5 —> nCH2 = 0,14
Dễ thấy nCH2 < n(COONa)2 nên muối đôi không có thêm CH2.
E gồm CH3OOC-COOC2H5 (0,15) —> Các este đơn: HCOOCH3.kCH2 (0,03), HCOOC2H5.gCH2 (0,05)
—> nCH2 = 0,03k + 0,05g = 0,14
—> k = 3 và g = 1 là nghiệm duy nhất.
X là CH3COOC2H5 (0,05)
Y là C3H7COOCH3 (0,03) —> mY = 3,06 gam
Chọn A
Câu 34:
Xà phòng hóa hoàn toàn m gam hỗn hợp E gồm triglixerit X và các axit béo tự do bằng 200 ml dung dịch NaOH 1M vừa đủ, thu được hỗn hợp Y chứa các muối có công thức chung C17HyCOONa. Đốt cháy hoàn toàn 0,07 mol E, thu được 1,845 mol CO2. Mặt khác, cho m gam E tác dụng tối đa với 0,1 mol Br2 trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Các axit béo gọi chung là A. Các muối đều 18C nên X có 57C và A có 18C.
Số C = nCO2/nE = 369/14 —> nX : nA = 3 : 11
Trong phản ứng xà phòng hóa: nX = 3e và nA = 11e
—> nNaOH = 3.3e + 11e = 0,2 —> e = 0,01
Quy đổi E thành (C17H35COO)3C3H5 (3e), C17H35COOH (11e) và H2 (-0,1)
—> mE = 57,74
Chọn C
Câu 35:
Dung dịch X gồm AgNO3 và Cu(NO3)2 với tỉ lệ mol tương ứng là 4 : 3. Cho 6 gam Mg vào X, thu được 16,08 gam chất rắn Y gồm ba kim loại. Hòa tan hoàn toàn Y vào dung dịch HNO3 loãng, thu được dung dịch chỉ chứa 48,33 gam muối và V lít khí NO (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
nAgNO3 = 4x, nCu = 3x —> nMg phản ứng = 5x
mY = 6 – 24.5x + 108.4x + 64.3x = 16,08
—> x = 0,02
Y gồm Ag (0,08), Cu (0,06), Mg dư (0,15)
m muối = 0,08.170 + 0,06.188 + 0,15.148 + mNH4NO3 = 48,33
—> nNH4NO3 = 1/64
Bảo toàn electron: nAg + 2nCu + 2nMg dư = 8nNH4NO3 + 3nNO
—> nNO = 0,125 —> V = 2,8 lít
Chọn B
Câu 36:
Cho 7,76 gam hỗn hợp X gồm Fe và Cu (tỉ lệ số mol Fe : Cu = 7 : 6) tác dụng với dung dịch chứa 0,4 mol HNO3 thu được dung dịch Y và khí NO (sản phẩm khử duy nhất của N+5). Tiến hành điện phân dung dịch Y với điện cực trơ, cường độ dòng điện không đổi I = 9,65A trong thời gian t giây, thấy khối lượng catot tăng 4,96 gam (kim loại sinh ra bám hết vào catôt). Giá trị của t là
 Xem đáp án
Xem đáp án
X gồm Fe (0,07) và Cu (0,06)
nHNO3 = 0,4 —> nNO max = nH+/4 = 0,1
Dễ thấy 2nFe + 2nCu < 3nNO < 3nFe + 2nCu nên kim loại và axit đều hết, sản phẩm gồm Fe3+ (u), Fe2+ (v) và Cu2+ (0,06)
—> u + v = 0,07
và 3u + 2v + 0,06.2 = 0,1.3
—> u = 0,04 và v = 0,03
Catot tăng 4,96 gam gồm Cu (0,06) và Fe (0,02)
—> ne = nFe3+ + 2nFe + 2nCu = 0,2
ne = It/F —> t = 2000s
Chọn D
Câu 37:
Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là C2H3O. Các chất E, F tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
(1) E + NaOH (t°) → X1 + X2
(2) F + 2NaOH (t°) → X1 + X3 + X4
(3) X1 + HCl → X5 + NaCl
(4) X3 + HCl → X6 + NaCl
(5) X6 (H2SO4, 170°C) → X5 + H2O
Biết rằng ME < MF < 200. Cho các phát biểu sau:
(a) Có hai công thức cấu tạo phù hợp với chất F.
(b) Từ các chất X2, X4 điều chế trực tiếp được axit axetic.
(c) Oxi hóa X4 bằng CuO, thu được anđehit axetic.
(d) Nung chất X1 với NaOH và CaO ở nhiệt độ cao, thu được khí metan.
(e) Cho a mol chất X6 tác dụng với Na dư, thu được a mol khí H2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
ME < MF < 200 và E, F đều có số H chẵn nên E là C4H6O2 và F là C8H12O4
(3)(4) —> X1, X3 đều chứa COONa
(5) —> X6 có nhóm OH (để tách H2O tạo X5) —> X5, X6 cùng C và ít nhất 3C
E là CH2=CH-COOCH3
X1 là CH2=CH-COONa; X2 là CH3OH
F là:
CH2=CH-COO-CH2CH2COO-C2H5
CH2=CH-COO-CH(CH3)-COO-C2H5
X3 là HOCH2CH2COONa hoặc HOCH(CH3)COONa
X4 là C2H5OH.
X5 là CH2=CH-COOH
X6 là HOCH2CH2COOH hoặc HOCH(CH3)COOH
(a) Đúng
(b) Đúng:
CH3OH + CO —> CH3COOH
C2H5OH + O2 —> CH3COOH + H2O
(c) Đúng: C2H5OH + CuO —> CH3CHO + Cu + H2O
(d) Sai: CH2=CH-COONa + NaOH —> CH2=CH2 + Na2CO3
(e) Đúng: HOCH2CH2COOH + 2Na —> NaOCH2CH2COONa + H2
HOCH(CH3)COOH + 2Na —> NaOCH(CH3)COONa + H2
Chọn C
Câu 38:
Cho các phát biểu sau:
(a) Sau khi mổ cá, có thể dùng giấm ăn để giảm mùi tanh.
(b) Dầu thực vật và dầu nhớt bôi trơn máy đều có thành phần chính là chất béo.
(c) Cao su sau khi được lưu hóa có tính đàn hồi và chịu nhiệt tốt hơn.
(d) Khi làm trứng muối (ngâm trứng trong dung dịch NaCl bão hòa) xảy ra hiện tượng đông tụ protein.
(e) Thành phần chính của bông nõn là xenlulozơ.
(g) Để giảm đau nhức khi bị kiến đốt, có thể bôi vôi tôi vào vết đốt.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, mùi tanh do amin nên dùng giấm (CH3COOH) sẽ giảm mùi tanh.
(b) Sai, dầu thực vật là chất béo, dầu bôi trơn máy là hiđrocacbon.
(c) Đúng
(d) Đúng
(e) Đúng
(g) Đúng, nọc độc của kiến có HCOOH, dùng vôi tôi (Ca(OH)2) sẽ hạn chế độc tính
Chọn B
Câu 39:
Cho sơ đồ chuyển hóa:
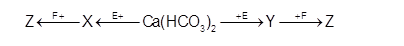
Biết: X, Y, Z, E, F là các hợp chất khác nhau, mỗi mũi tên ứng với một phương trình hóa học của phản ứng xảy ra giữa hai chất tương ứng. Các chất E, F thỏa mãn sơ đồ trên lần lượt là
A. NaOH, CO2. B. NaOH, BaCl2.
C. KOH, NaHSO4. D. Ba(OH)2, Na2CO3.
 Xem đáp án
Xem đáp án
Xét A, B: X, Y nằm trong số CaCO3, Na2CO3, NaHCO3, H2O nên không có 2 chất nào phản ứng với CO2 hoặc BaCl2 tạo cùng sản phẩm Z, loại.
Xét C: X, Y nằm trong số CaCO3, K2CO3, KHCO3, H2O, tồn tại 2 chất tác dụng với NaHSO4 tạo cùng sản phẩm Z —> Chọn C.
X là K2CO3, Y là KHCO3, Z là Na2SO4, K2SO4, CO2 hoặc H2O
Xét D: X, Y nằm trong số CaCO3, BaCO3, H2O. Không có chất nào tác dụng được với Na2CO3 nên loại.
Chọn C
Câu 40:
Hòa tan hết a gam hỗn hợp Na2CO3 và KHCO3 vào nước thu được dung dich X. Cho từ từ 100ml dung dich HCl 1,5 M vào dung dich X, thu được dung dich Y và 1,008 lít khí (ở đktc). Thêm dung dich Ba(OH)2 dư vào Y thu được 29,55 gam kết tủa. Giá trị của a là:
 Xem đáp án
Xem đáp án
nNa2CO3 = x và nKHCO3 = y
nHCl = 0,15; nCO2 = 0,045
CO32- + H+ —> HCO3-
x………….x…………..x
HCO3- + H+ —> CO2 + H2O
0,045…..0,045…….0,045
—> nH+ = x + 0,045 = 0,15 —> x = 0,105
nHCO3- dư = x + y – 0,045 = y + 0,06
—> nBaCO3 = y + 0,06 = 0,15 —> y = 0,09
—> a = 20,13
Chọn D
