(2023) Đề thi thử Hóa THPT theo đề minh họa của Bộ Giáo dục có đáp án (Đề 40)
(2023) Đề thi thử Hóa THPT theo đề minh họa của Bộ Giáo dục có đáp án (Đề 40)
-
229 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 4:
Kim loại M bị ăn mòn điện hóa học khi tiếp xúc với Fe trong không khí ẩm. Kim loại M có thể là
 Xem đáp án
Xem đáp án
Chọn D
Câu 6:
Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch nào sau đây sinh ra muối sắt(II) ?
 Xem đáp án
Xem đáp án
Chọn D
Câu 9:
Điện phân dung dịch muối nào sau đây không có nước tham gia trong quá trình điện phân
 Xem đáp án
Xem đáp án
Chọn D
Câu 19:
Kim loại nào sau đây tác dụng với HCl có phản ứng xảy ra mãnh liệt và gây nổ
 Xem đáp án
Xem đáp án
Chọn C
Câu 20:
Chuẩn bị 4 mẫu vật liệu: màng mỏng PE, ống nhựa dẫn nước làm bằng PVC, sợi len, vải sợi xenlulozơ được đánh số ngẫu nhiên 1, 2, 3, 4. Hơ nóng lần lượt các mẫu gần ngọn lửa vài phút, kết quả thí nghiệm được ghi ở bảng dưới đây:
|
Mẫu vật liệu |
Hiện tượng quan sát và mùi của các mẫu vật liệu |
|
1 |
Bị chảy ra thành chất lỏng, mới cháy cho khí, có một ít khói đen. |
|
2 |
Bị chảy ra trước khi cháy, cho nhiều khói đen, khí thoát ra có mùi xốc khó chịu. |
|
3 |
Cháy có mùi khét |
|
4 |
Cháy mạnh không có mùi |
Các mẫu vật liệu 1, 2, 3, 4 lần lượt là
 Xem đáp án
Xem đáp án
Chọn A
+ PVC cháy theo phản ứng: (C2H3Cl)n + 5n/2O2 2nCO2 + nH2O + nHCl.
Phản ứng cho khí HCl nên có mùi xốc.
+ PE cháy theo PTHH: (C2H2)n + 3nO2 2nCO2 + 2nH2O.
Phản ứng cho khí CO2 nên không có mùi xốc.
+ Vải sợi xenlulozơ cháy theo phản ứng: (C6H10O5)n + 6nO2 6nCO2 + 5nH2O.
Khí thoát ra là CO2 không có mùi.
+ Sợi len là sợi bán tổng hợp hay tổng hợp trong đó có chứa nitơ, khi cháy trong không khí thì có mùi khét.
Câu 21:
Dẫn khí CO dư qua ống sứ đựng 11,6 gam bột Fe3O4 nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào dung dịch nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn A
Câu 24:
Đun nóng m gam glucozơ với lượng dư AgNO3 trong NH3 thu được 54 gam Ag. Biết hiệu suất của phản ứng là 75%. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn D
Câu 25:
Cho 5,9 gam propylamin (C3H7NH2) tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là
 Xem đáp án
Xem đáp án
Chọn C
Câu 26:
Nhỏ dung dịch iot lên chuối xanh thấy xuất hiện màu xanh tím là do chuối xanh có chứa
 Xem đáp án
Xem đáp án
Chọn B
Câu 27:
Khi nhúng thanh Mg có khối lượng m gam vào dung dịch hỗn hợp X chứa a mol Cu(NO3)2 và b mol HCl ta có đồ thị biểu diễn sự phụ thuộc của khối lượng Mg vào thời gian phản ứng được biểu diễn như hình vẽ dưới đây:
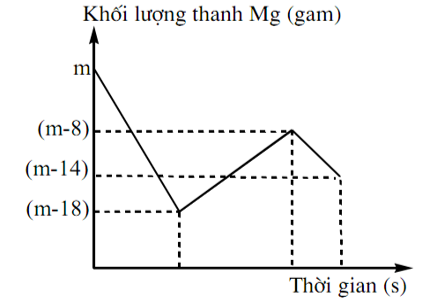
Sau khi phản ứng xảy ra hoàn toàn rút thanh Mg ra, thu được NO là sản phẩm khử duy nhất của N+5. Tỉ lệ a : b là
A. 1 : 8. B. 1 : 12. C. 1 : 10. D. 1 : 6.
 Xem đáp án
Xem đáp án
Chọn C
Câu 28:
Xà phòng hóa este X có công thức phân tử C4H6O2 bằng dung dịch NaOH dư thu được muối Y và anđehit Z. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
Chọn A
Câu 29:
Cho 4 dung dịch riêng biệt: ZnSO4, HNO3 loãng, HCl và Ni(NO3)2. Số dung dịch phản ứng được với kim loại Fe tạo ra muối sắt (II) là
 Xem đáp án
Xem đáp án
Chọn D
Câu 30:
Cho 0,1 mol phenylaxetat tác dụng hết với 300 ml dung dịch NaOH 1M. Kết thúc phản ứng, cô cạn dung dịch thì khối lượng chất rắn khan thu được là
 Xem đáp án
Xem đáp án
Chọn D
Câu 31:
Cho các phát biểu sau:
(a) Thủy phân chất béo trong môi trường kiềm luôn thu được glixerol.
(b) Triolein làm mất màu nước brom.
(c) Chất béo không tan trong nước và nhẹ hơn nước.
(d) Benzyl axetat là este có mùi chuối chín.
(e) Đốt cháy etyl axetat thu được số mol nước bằng số mol cacbonic.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn C
a. Chất béo là trieste của glixerol và các axit béo.
b. Axit oleic có công thức C17H33COOH có một nối đôi nên triolein có 3 nối đôi nên có thể làm mất màu nước brom.
c. Tính chất vật lí của chất béo.
e. Etyl axetat có công thức C4H8O2 nên khi đốt cháy số mol CO2 bằng số mol nước.
Câu 32:
Thực hiện các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Dẫn khí H2 dư qua bột MgO nung nóng.
(c) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(d) Nhiệt phân Hg(NO3)2.
(e) Cho Na vào dung dịch MgSO4.
Số thí nghiệm tạo thành kim loại là
 Xem đáp án
Xem đáp án
Chọn A
Câu 33:
Trong một ca sản xuất ở nhà máy, 784 m3 không khí (đktc) được thổi vào lò chứa than nung đỏ, toàn bộ lượng than trong lò đã phản ứng, thu được hỗn hợp khí than khô X gồm CO, CO2, O2 và N2. Tỉ khối của X so với H2 bằng 14,28. Lấy 4,48 lít (đktc) hỗn hợp X sục vào nước vôi trong (dư), thu được 0,6 gam kết tủa. Giả thiết: than chứa 84% cacbon về khối lượng (còn lại là tạp chất trơ), thành phần không khí gồm 20% O2 và 80% N2 về thể tích. Nếu giá than là 24.000 đồng/kg thì nhà máy đã đầu tư bao nhiêu tiền than cho ca sản xuất trên?
 Xem đáp án
Xem đáp án
Chọn D
Câu 34:
Cho 35,36 gam một triglixerit X tác dụng với dung dịch NaOH vừa đủ, thu được glixerol và 36,48 gam muối. Cho 35,36 gam X tác dụng với a mol H2 (Ni, to), thu được hỗn hợp chất béo Y. Đốt cháy hoàn toàn Y cần vừa đủ 3,2375 mol O2 thu được 2,28 mol CO2. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A
Câu 35:
Một loại khí thiên nhiên có thành phần phần trăm về thể tích như sau: 80% metan, 15% etan, còn lại là tạp chất không cháy. Biết nhiệt lượng tỏa ra khi đốt hoàn toàn 1 mol metan là 880 kJ, 1 mol etan là 1560 kJ và nâng nhiệt độ của 1 gam nước lên 1oC cần cung cấp 4,2 J nhiệt lượng. Để nâng nhiệt độ của 3 lít nước từ 25oC lên 100oC cần đốt cháy vừa đủ V lít khí thiên nhiên ở trên. Biết khối lượng riêng của nước là 1 g/ml và lượng nhiệt tổn hao là 10%. Giá trị gần nhất của V là:
 Xem đáp án
Xem đáp án
Chọn C
Để nâng nhiệt độ của 3 lít nước từ 25oC lên 100oC
® Cần đốt cháy vừa đủ x mol khí thiên nhiên gồm
Câu 36:
Nung nóng m gam hỗn hợp X gồm Al và một oxit sắt trong khí trơ, thu được hỗn hợp Y. Trộn đều Y rồi chia thành hai phần. Phần một phản ứng tối đa với dung dịch chứa 0,13 mol NaOH, thu được 0,015 mol khí H2. Hòa tan hoàn toàn phần hai trong dung dịch chứa 2,16 mol H2SO4 đặc (đun nóng), thu được dung dịch Z chỉ chứa các muối trung hòa và 0,72 mol SO2 (sản phẩm khử duy nhất). Dung dịch Z phản ứng vừa đủ với 0,06 mol KMnO4 trong lượng dư dung dịch H2SO4 loãng. Biết các phản ứng đều xảy ra hoàn toàn. Phần trăm khối lượng của Al trong X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
Phần 1: nNaOH = 0,13 → nAl ban đầu = 0,13
nH2 = 0,015 → nAl dư = 0,01
→ nAl phản ứng = 0,12 → nO = 0,18
Phần 2: nH2SO4 = 2nSO2 + nO → nO = 0,72
Dễ thấy 0,72/0,18 = 4 lần nên phần 2 gấp 4 lần phần 1.
Phần 2 gồm Al (0,13.4 = 0,52), O (0,72) và Fe. Bảo toàn electron:
3nAl + 3nFe = 2nO + 2nSO2 + 5nKMnO4
→ nFe = 0,54
%Al trong X = %Al trong phần 2 = 25,16%
Câu 37:
Cho các hợp chất hữu cơ no, mạch hở sau: X và Y (có cùng số mol) là hai axit cacboxylic đơn chức, kế tiếp nhau trong dãy đồng đẳng, Z là ancol ba chức (số nguyên tử cacbon nhỏ hơn 5). Đun 5 mol hỗn hợp E gồm X, Y, Z với xúc tác H2SO4 đặc (giả sử chỉ xảy ra phản ứng este hóa với hiệu suất 50% được tính theo 2 axit X và Y) thu được 3,5 mol hỗn hợp F gồm X, Y, Z và các sản phẩm hữu cơ (chỉ chứa nhóm chức este). Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho a mol F tác dụng với Na dư, sau phản ứng hoàn toàn thu được 0,6 mol H2.
Thí nghiệm 2: Đốt cháy hoàn toàn (a + 0,35) mol F cần dùng vừa đủ 5,925 mol khí O2 thu được CO2 và H2O.
Phần trăm khối lượng của các este trong F gần nhất với
 Xem đáp án
Xem đáp án
Câu 38:
Trộn 13,05 gam hỗn hợp gồm CuSO4 và NaCl với dung dịch chứa x mol HCl ta được dung dịch Y. Tiến hành điện phân dung dịch Y với điện cực trơ, màng ngăn xốp, cường độ dòng điện 0,5A, hiệu suất điện phân là 100%. Lượng khí sinh ra từ bình điện phân và lượng kim loại Cu sinh ra ở catot theo thời gian điện phân được cho ở bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 11580 |
3,8t |
|
Lượng khí sinh ra từ bình điện phân (mol) |
a |
a + 0,04 |
5,4a |
|
Lượng kim loại Cu sinh ra ở catot (mol) |
0,025 |
0,045 |
0,045 |
Giá trị của x là:
 Xem đáp án
Xem đáp án
Chọn C
Trong 11580s (tính từ t đến t + 11580) có ne = 0,06
Catot: nCu = 0,045 – 0,025 = 0,02 → nH2 = 0,01
n khí anot = 0,04 – 0,01 = 0,03 → Chỉ có Cl2 → a = 0,025
nCuSO4 = 0,045 → nNaCl = 0,1
ne lúc t giây = 0,025.2 = 0,05 → ne lúc 3,8t giây = 0,19
Catot: nCu = 0,045 → nH2 = 0,05
Anot: nCl2 = u và nO2 = v
→ u + v + 0,05 = 5,4.0,025 và ne = 2u + 4v = 0,19
→ u = 0,075; v = 0,01
Bảo toàn Cl → nHCl = x = 2u – nNaCl = 0,05
Câu 39:
Cho sơ đổ chuyển hoá sau:
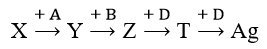
Chất X là thành phần chính của quặng giàu sắt nhất nhưng hiếm gặp trong tự nhiên; Y, Z, T, A, B, D là các chất khác nhau; mỗi mũi tên ứng với một phương trình hoá học của phản ứng giữa hai chất, số oxi hóa của Fe trong Y thấp hơn Fe trong X. Phát biểu nào sau đây không chính xác?
 Xem đáp án
Xem đáp án
Chọn A
Chất X là thành phần chính của quặng giàu sắt nhất nhưng hiếm gặp trong tự nhiên → X là Fe3O4
A là CO, H2, Al…
B là HCl, HBr
Y là Fe hoặc FeO
Z là FeCl2 hoặc FeBr2
D là AgNO3
T là Fe(NO3)2
→ A không chính xác.
Câu 40:
Cho E và F là hai chất hữu cơ mạch hở. Từ E, F thực hiện sơ đồ các phản ứng sau theo đúng tỉ lệ mol:
(1) E + 2NaOH (t°) → 2X + Y
(2) F + NaOH (t°) → X + Y
(3) Y + CO (xt, t°) → Z
(4) X + HCl → T + NaCl
Biết X, Y, Z, T đều là các hợp chất hữu cơ và đều phản ứng với Na sinh khí; Z và T có cùng số nguyên tử cacbon; F có công thức phân tử là C3H6O3. Cho các phát biểu sau:
(a) Chất F là hợp chất hữu cơ tạp chức.
(b) Công thức phân tử của E là C5H10O5.
(c) Từ C2H5OH có thể điều chế trực tiếp chất Z.
(d) Ở điều kiện thường, Y là chất lỏng, tan vô hạn trong nước.
(đ) 1 mol chất T phản ứng với lượng dư Na, thu được 1 mol khí H2.
Số phát biểu đúng là :
 Xem đáp án
Xem đáp án
Chọn B
(3) → Y là CH3OH, Z là CH3COOH
(2) → F là HO-CH2-COOCH3
→ X là HO-CH2-COONa, T là HO-CH2-COOH
(1) → E là HO-CH2-COO-CH2-COO-CH3
(a) Đúng, F chứa chức ancol và chức este.
(b) Sai, E là C5H8O5
(c) Đúng: C2H5OH + O2 → CH3COOH (lên men giấm)
(d) Đúng
(đ) Đúng: HO-CH2-COOH + 2Na → NaO-CH2-COONa + H2
