Thi Online (2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Bắc Ninh (Lần 2) có đáp án
Thi Online (2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Bắc Ninh (Lần 2) có đáp án
-
487 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Kim loại Mg tác dụng với dung dịch H2SO4 loãng, sản phẩm thu được gồm MgSO4 và chất nào sau đây?
 Xem đáp án
Xem đáp án
Kim loại Mg tác dụng với dung dịch H2SO4 loãng, sản phẩm thu được gồm MgSO4 và H2:
Mg + H2SO4 loãng → MgSO4 + H2
Câu 2:
Cho 6,5 gam bột Zn tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được m gam kim loại Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
nZn = 0,1 → nAg = 0,2 → mAg = 21,6 gam
Câu 3:
Kim loại dẫn điện tốt nhất là
 Xem đáp án
Xem đáp án
Độ dẫn điện: Ag > Cu > Au > Al > Fe → Kim loại dẫn điện tốt nhất là Ag.
Câu 4:
Ở trạng thái cơ bản, số electron ngoài cùng của nguyên tử kim loại kiềm thổ là
 Xem đáp án
Xem đáp án
Chọn D
Câu 7:
Cho 270 gam dung dịch glucozơ 1% vào lượng dư dung dịch AgNO3 trong NH3, đun nóng nhẹ đến phản ứng hoàn toàn thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
nC6H12O6 = 270.1%/180 = 0,015
→ nAg = 2nC6H12O6 = 0,03 → mAg = 3,24 gam
Câu 14:
Cho dãy các chất sau: Glucozơ, fructozơ, saccarozơ, xenlulozơ. Số chất trong dãy có khả năng tham gia phản ứng tráng bạc là
 Xem đáp án
Xem đáp án
Có 2 chất trong dãy có khả năng tham gia phản ứng tráng bạc là: glucozơ, fructozơ
Câu 15:
Cho thanh kim loại Ni vào dung dịch chất nào sau đây sẽ xảy ra hiện tượng ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Cho thanh kim loại Ni vào dung dịch AgNO3 sẽ xảy ra hiện tượng ăn mòn điện hóa học:
Ni + AgNO3 → Ni(NO3)2 + Ag
Ag sinh ra bám vào thanh Ni tạo cặp điện cực Ni-Ag cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hóa.
Câu 16:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Sai, Ag có tính khử yếu hơn Cu.
B. Đúng: Zn + HCl → ZnCl2 + H2
C. Đúng: CuSO4 + H2O → Cu (catot) + O2 (anot) + H2SO4
D. Đúng: Fe + Cl2 → FeCl3
Câu 17:
Thủy phân hoàn toàn m gam etyl fomat bằng dung dịch NaOH đun nóng thu được 10,2 gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
HCOOC2H5 + NaOH → HCOONa + C2H5OH
nHCOOC2H5 = nHCOONa = 0,15 → m = 11,1 gam
Câu 18:
Cho mẩu nhỏ giấy quỳ tím vào dung dịch X thấy quỳ tím đổi màu. X không thể là chất nào sai đây?
 Xem đáp án
Xem đáp án
Chọn B
Câu 19:
Trong khí thải do đốt nhiên liệu hóa thạch có chất khí X không màu mùi hắc. Khi khuếch tán vào bầu khí quyển, X là nguyên nhân chủ yếu gây hiện tượng “mưa axit”. X là
 Xem đáp án
Xem đáp án
X không màu mùi hắc, là nguyên nhân chủ yếu gây hiện tượng “mưa axit” → X là SO2.
Câu 21:
Muối nào sau đây dễ bị nhiệt phân khi đun nóng?
 Xem đáp án
Xem đáp án
Muối NaHCO3 dễ bị nhiệt phân khi đun nóng:
NaHCO3 → Na2CO3 + CO2 + H2O
Câu 22:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
B sai, tơ nitron được điều chế bằng phản ứng trùng hợp CH2=CH-CN.
Câu 25:
Chất nào sau đây tác dụng với dung dịch Ba(HCO3)2 sinh ra chất kết tủa và chất khí?
 Xem đáp án
Xem đáp án
H2SO4 tác dụng với dung dịch Ba(HCO3)2 sinh ra chất kết tủa và chất khí:
H2SO4 + Ba(HCO3)2 → BaSO4↓ + CO2↑ + H2O
Câu 26:
Thủy phân hoàn toàn 9,4 gam Ala-Val trong 150ml dung dịch NaOH 1M. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Ala-Val + 2NaOH → AlaNa + ValNa + H2O
nAla-Val = 0,05; nNaOH = 0,15 → NaOH còn dư và nH2O = 0,05
Bảo toàn khối lượng → m rắn = 14,5 gam
Câu 27:
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Trong công nghiệp, kim loại Na được điều chế bằng phương pháp điện phân nóng chảy muối NaCl:
2NaCl điện phân nóng chảy → 2Na + Cl2
Câu 28:
Este X có công thức phân tử C4H8O2. Thủy phân X trong dung dịch H2SO4 loãng, đun nóng thu được sản phẩm gồm axit axetic và chất hữu cơ Y. Công thức của Y là
 Xem đáp án
Xem đáp án
X (C4H8O2) thủy phân tạo CH3COOH → X là CH3COOC2H5
→ Y là C2H5OH.
Câu 29:
Nung 7,5 gam hỗn hợp X gồm Mg và Al trong oxi dư thu được 13,1 gam hỗn hợp Y chỉ chứa các oxit. Hòa tan Y cần vừa đủ dung dịch chứa x mol HCl. Giá trị của x là
 Xem đáp án
Xem đáp án
nH2O = nO = (m oxit – m kim loại)/16 = 0,35
→ nHCl = x = 2nH2O = 0,7 mol
Câu 31:
Dẫn 1,2 mol hỗn hợp X (gồm khí CO2 và hơi nước) qua than nung đỏ thu được 1,4a mol hỗn hợp khí Y (gồm CO2, CO và H2) trong đó có y mol CO2. Hấp thụ từ từ toàn bộ khí CO2 trong Y vào dung dịch có chứa 0,06b mol Ca(OH)2, khối lượng kết tủa phụ thuộc vào số mol khí CO2 được ghi ở bảng sau:
|
Số mol khí CO2 (mol) |
x |
x + 0,4 |
y |
|
Khối lượng kết tủa (gam) |
5b |
3b |
2b |
Giá trị của a có thể là
 Xem đáp án
Xem đáp án
TH1: Khi nCO2 = x thì kết tủa chưa bị hòa tan.
→ x = 0,05b (1)
Khi nCO2 = x + 0,4 thì nCaCO3 = 0,03b và nCa(HCO3)2 = 0,03b
→ x + 0,4 = 0,03b + 0,03b.2 (2)
(1)(2) → x = 0,5; b = 10
Khi nCO2 = y mol thì nCaCO3 = 0,2 và nCa(HCO3)2 = 0,4
Bảo toàn C → nCO2 = 1
nC = nY – nX = 1,4a – 1,2
Bảo toàn electron: 4nC = 2nCO + 2nH2
→ nCO + nH2 = 2,8a – 2,4
→ nY = 2,8a – 2,4 + 1 = 1,4a
→ a = 1
TH2: Khi nCO2 = x thì kết tủa đã bị hòa tan (Bạn đọc tự làm)
Câu 32:
Dung dịch X chứa CuSO4, H2SO4 và NaCl. Điện phân dung dịch X (điện cực trơ, có màng ngăn xốp, hiệu suất điện phân là 100%), lượng khí sinh ra từ quá trình điện phân và khối lượng Al kim loại bị hòa tan tối đa trong dung dịch sau điện phân ứng với mỗi thí nghiệm được cho ở bảng dưới đây
|
|
Thí nghiệm 1 |
Thí nghiệm 2 |
Thí nghiệm 3 |
|
Thời gian điện phân (giây) |
t |
2t |
3t |
|
Lượng khí sinh ra từ bình điện phân (mol) |
a |
0,80 |
1,18 |
|
Khối lượng Al bị hòa tan tối đa (gam) |
4,32 |
0 |
b |
Biết tại catot ion Cu2+ điện phân hết thành Cu trước khi ion H+ điện phân thành khí H2; trong a mol khí đã có khí H2; cường độ dòng điện bằng nhau và không đổi trong các thí nghiệm. Kết thúc điện phân (sau 3t giây), thu được dung dịch Y có khối lượng giảm m gam so với dung dịch X ban đầu. Giá trị của m là
 Xem đáp án
Xem đáp án
Lúc 2t giây dung dịch không hòa tan được Al chứng tỏ không có H+ hay OH-, lúc 3t giây dung dịch lại hòa tan được Al nên lúc 2t vẫn còn NaCl.
Lúc t giây:
Catot: nCu = x và nH2 = y
Anot: nCl2 = x + y
→ n khí tổng = a = x + y + y (1)
nAl = 0,16 → nH+ dư = 0,48
→ nH2SO4 ban đầu = y + 0,24
Lúc 2t giây: ne = 4x + 4y
Catot: nCu = x và nH2 = x + 2y
Anot: nCl2 = 2x + 2y
→ n khí tổng = 0,8 = 2x + 2y + x + 2y (2)
Lúc này H+ vừa hết nên: y + 0,24 = x + 2y (3)
(1)(2)(3) → x = 0,16; y = 0,08; a = 0,32
Lúc 3t giây: ne = 6x + 6y = 1,44
Catot: nCu = 0,16 → nH2 = 0,56
Anot: nCl2 = u và nO2 = v
→ 2u + 4v = 1,44 và u + v + 0,56 = 1,18
→ u = 0,52; v = 0,1
m giảm = mCu + mH2 + mCl2 + mO2 = 51,48
Câu 33:
Xăng sinh học E5 (chứa 5% etanol về thể tích, còn lại là xăng, giả thiết chỉ là octan). Khi được đốt cháy hoàn toàn, 1 mol etanol tỏa ra lượng nhiệt là 1365,0 kJ và 1 mol octan tỏa ra lượng nhiệt là 5928,7 kJ. Trung bình, một chiếc xe máy di chuyển được 1km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 211,8 kJ. Nếu xe máy đó đã sử dụng 4,5 lit xăng E5 ở trên thì quãng đường di chuyển được là bao nhiêu km, biết hiệu suất sử dụng nhiên liệu của đông cơ là 25%; khối lượng riêng của etanol là 0,8 g/ml, của octan là 0,7 g/ml.
 Xem đáp án
Xem đáp án
nC2H5OH = 4500.5%.0,8/46 = 3,91304 mol
nC8H18 = 4500.95%.0,7/114 = 26,25 mol
Quãng đường xe đi được là x km. Bảo toàn năng lượng:
(1365.3,91304 + 5928,7.26,25).25% = 211,8x
→ x = 190 km
Câu 34:
Cho các phát biểu sau:
(a) Dung dịch metylamin làm quỳ tím hóa xanh.
(b) Thủy phân saccarozơ trong môi trường axit chỉ thu được glucozơ.
(c) Muối đinatri gluconat được ứng dụng làm mì chính (bột ngọt).
(d) Ở điều kiện thường, triolein là chất lỏng.
(e) Tơ nilon-6,6 được điều chế bằng phản ứng trùng hợp.
(f) Khi làm đậu phụ từ sữa đậu nành có xảy ra sự đông tụ protein.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, metylamin CH3NH2 có tính bazơ mạnh hơn NH3 nên dung dịch của nó làm quỳ tím hóa xanh.
(b) Sai, thủy phân saccarozơ thu được glucozơ và fructozơ.
(c) Sai, muối mononatri glutamat được ứng dụng làm mì chính (bột ngọt).
(d) Đúng, triolein (C17H33COO)3C3H5 là chất béo không no, thể lỏng điều kiện thường.
(e) Sai, tơ nilon-6,6 được điều chế bằng phản ứng trùng ngưng.
(f) Đúng, sữa đầu nành chứa protein hòa tan, khi đông tụ lại sẽ thành đậu phụ.
Câu 35:
Một loại phân bón tổng hợp trên bao bì ghi tỉ lệ NPK là 10-20-15, được sản xuất bằng cách trộn ba loại hóa chất Ca(NO3)2, KH2PO4, KNO3 và một lượng chất độn không chứa N, P, K. Trong phân bón trên, Ca(NO3)2 chiếm x% về khối lượng. Giá trị của x là
 Xem đáp án
Xem đáp án
Lấy 100 gam phân, gồm Ca(NO3)2 (a mol), KH2PO4 (b mol) và KNO3 (c mol) và các tạp chất.
nN = 2a + c = 100.10%/14
nK = b + c = 2.100.15%/94
nP = b = 2.100.20%/142
→ a = 0,3384; b = 0,2817; c = 0,0375
%Ca(NO3)2 = 164a/100 = 55,5%
Câu 36:
Thực hiện các thí nghiệm sau:
(a) Cho kim loại Na vào dung dịch CuCl2.
(b) Cho hỗn hợp Cu và Fe2O3 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
(c) Đun nóng nước có tính cứng toàn phần.
(d) Cho dung dịch (NH4)2HPO4 vào nước vôi trong dư.
(e) Cho dung dịch KOH vào dung dịch Ca(HCO3)2.
(f) Nhỏ từ từ dung dịch NH3 đến dư vào dung dịch Al2(SO4)3.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được chất kết tủa là
 Xem đáp án
Xem đáp án
(a) Na + H2O → NaOH + H2
NaOH + CuCl2 → Cu(OH)2 + NaCl
(b) Cu + Fe2O3 + 6HCl → CuCl2 + 2FeCl2 + 3H2O
(c) M(HCO3)2 → MCO3 + CO2 + H2O
(d) (NH4)2HPO4 + Ca(OH)2 dư → Ca3(PO4)2 + NH3 + H2O
(e) KOH + Ca(HCO3)2 → CaCO3 + K2CO3 + H2O
(f) NH3 + H2O + Al2(SO4)3 → Al(OH)3 + (NH4)2SO4.
Câu 37:
Chất béo X gồm các triglixerit. Phần trăm khối lượng của cacbon và hidro trong X lần lượt là 77,25% và 11,75%. Xà phòng hóa hoàn toàn m gam X bằng dung dịch NaOH dư, đun nóng thu được a gam muối. Mặt khác, cứ 0,1m gam X phản ứng tối đa với 7,68 gam Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
%O = 100% – 77,25% – 11,75% = 11%
nCO2 = nC = 77,25%m/12
nH2O = nH/2 = 11,75%m/2
nX = nO/6 = 11%m/(16.6)
m gam X phản ứng tối đa nBr2 = 76,8/160 = 0,48
nX = [nCO2 – (nH2O + nBr2)]/2
⇔ 11%m/(16.6) = [77,25%m/12 – (11,75%m/2 + 0,48)]/2
→ m = 144
→ nX = 0,161 → nNaOH phản ứng = 0,495 và nC3H5(OH)3 = 0,161
Bảo toàn khối lượng:
m + mNaOH = a + mC3H5(OH)3 → a = 148,62 gam
Câu 38:
Cho hai chất hữu cơ mạch hở E, F có cùng công thức đơn giản nhất là C3H4O2. Các chất E, F, X,Z tham gia phản ứng theo đúng tỉ lệ mol như sơ đồ dưới đây:
(1) E + NaOH → X + Y (2) F + NaOH → Z + T
(3) X + HCl → J + NaCl (4) Z + HCl → G + NaCl
Biết X, Y, Z, T, J, G là các chất hữu cơ, trong đó T là hợp chất đa chức; MT > 88 và ME < MF < 146.
Cho các phát biểu sau:
(a) Chất J có nhiều trong nọc độc con kiến.
(b) Từ Y có thể điều chế trực tiếp axit axetic.
(c) Ở nhiệt độ thường, T tác dụng với Cu(OH)2 tạo thành dung dịch xanh lam.
(d) E và F đều tạo kết tủa khi cho tác dụng với dung dịch AgNO3 trong dung dịch NH3.
(e) Nung nóng chất rắn Z với hỗn hợp vôi tôi xút thu được khí etilen.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
ME < MF < 146 và E, F có cùng công thức đơn giản nhất là C3H4O2 → E là C3H4O2 và F là C6H8O4
E + NaOH tạo 2 sản phẩm hữu cơ nên E là HCOOCH=CH2
→ X là HCOONa; Y là CH3CHO và J là HCOOH
F tác dụng với NaOH theo tỉ lệ mol 1 : 1 và tạo 2 sản phẩm hữu cơ nên F chứa 1 chức este.
T là chất hữu cơ đa chức nên F là CH≡C-COO-CH2-CHOH-CH2OH
Z là CH≡C-COONa và T là C3H5(OH)3
(a) Đúng
(b) Đúng: CH3CHO + O2 → CH3COOH
(c) Đúng
(d) Đúng, E tạo Ag và F tạo CAg≡C-COO-CH2-CHOH-CH2OH
(e) Sai, Z + NaOH → C2H2 + Na2CO3
Câu 39:
Hỗn hợp T gồm ba este mạch hở X (đơn chức), Y (hai chức), Z (ba chức) đều được tạo thành từ axit cacboxylic và ancol. Đốt cháy hoàn toàn m gam T, thu được H2O và 1,0 mol CO2. Xà phòng hóa hoàn toàn m gam T bằng dung dịch NaOH vừa đủ, thu được hỗn hợp E gồm hai ancol (có cùng số nguyên tử cacbon trong phân tử) và 26,96 gam hỗn hợp muối F. Cho E tác dụng hết với Na kim loại dư, thu được 0,2 mol H2. Đốt cháy toàn bộ F, thu được H2O, Na2CO3 và 0,2 mol CO2. Khối lượng của Y trong m gam T là
 Xem đáp án
Xem đáp án
nH2 = 0,2 → nNaOH = nO(E) = 0,4
→ nNa2CO3 = 0,2
nC(F) = nNa2CO3 + nCO2 = 0,4
Dễ thấy nC(F) = nNa(F) nên F gồm HCOONa (0,16) và (COONa)2 (0,12)
nC(Ancol) = 1 – nC(F) = 0,6
E chứa 2 ancol cùng C → Số C ≥ 2
nE > 0,4/3 = 0,1333 → Số C < 0,6/0,1333 = 4,5
→ Ancol cùng 2C, 3C hoặc 4C.
Xét ancol gồm C2H5OH (0,2) và C2H4(OH)2 (0,1)
X là HCOOC2H5 (x mol)
n(COONa)2 > nC2H4(OH)2 nên Y là (COOC2H5)2 (y mol)
Z là HCOO-CH2-CH2-OOC-COO-C2H5 (z mol)
nC2H5OH = x + 2y + z = 0,2
nHCOONa = x + z = 0,16
n(COONa)2 = y + z = 0,12
→ x = 0,06; y = 0,02; z = 0,1
→ mY = 2,92
Câu 40:
Cho sơ đồ chuyển hóa:
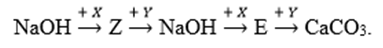
Biết X, Y, Z, E là các hợp chất khác nhau và khác CaCO3; mỗi mũi tên ứng với một phương trình hóa học của phản ứng giữa hai chất tương ứng. Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Các chất X, Y thỏa mãn sơ đồ trên lần lượt là Ca(HCO3)2, Ca(OH)2; Z là NaHCO3, E là Na2CO3
NaOH + Ca(HCO3)2 → NaHCO3 + CaCO3 + H2O
NaHCO3 + Ca(OH)2 → CaCO3 + NaOH + H2O
2NaOH + Ca(HCO3)2 → Na2CO3 + CaCO3 + 2H2O
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
