Thi Online (2023) Đề thi thử Hóa Sở GD Lạng Sơn (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa Sở GD Lạng Sơn (Lần 1) có đáp án
-
518 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Hidrocacbon nào sau đây tác dụng với dung dịch AgNO3 trong NH3 tạo thành kết tủa?
 Xem đáp án
Xem đáp án
But-1-in tác dụng với dung dịch AgNO3 trong NH3 tạo thành kết tủa:
C2H5-C≡CH + AgNO3 + NH3 → C2H5-C≡CAg↓ + NH4NO3
Chọn A
Câu 7:
Lysin là amino axit thiết yếu giúp trẻ em phát triển chiều cao, được cung cấp chủ yếu từ thực phẩm như trứng, thịt, đậu nành, pho mát. Số nhóm amino và cacboxyl trong phân tử lysin lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
Câu 10:
Số nguyên tử cacbon có trong phân tử tripanmitin là
 Xem đáp án
Xem đáp án
Tripanmitin (C15H31COO)3C3H5 có 51C.
Chọn A
Câu 11:
Dung dịch muối X tác dụng với dung dịch NaOH, thu được kết tủa màu xanh. Muối X là
 Xem đáp án
Xem đáp án
A. MgSO4 + NaOH —> Mg(OH)2 (trắng) + Na2SO4
B. Fe2(SO4)3 + NaOH —> Fe(OH)3 (nâu đỏ) + Na2SO4
C. Không phản ứng.
D. CuSO4 + NaOH —> Cu(OH)2 (xanh) + Na2SO4
Chọn D
Câu 12:
Tiến hành phản ứng khử oxit X thanh kim loại bằng khí H2 (dư) theo sơ đồ hình vẽ dưới đây
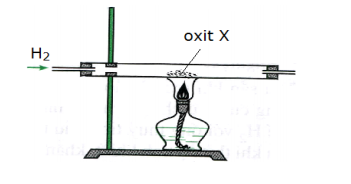
Oxit X là
 Xem đáp án
Xem đáp án
Oxit X bị H2 khử thành kim loại —> X là CuO:
CuO + H2 —> Cu + H2O
Chọn A
Câu 13:
Tơ nitron dai, bền với nhiệt và giữ nhiệt tốt, nên thường được dùng để dệt vải may quần áo ấm hoặc bện thành sợi "len" đan áo rét. Thành phần nguyên tố có trong tơ nitron là
 Xem đáp án
Xem đáp án
Chọn C
Câu 14:
Cho dãy các kim loại: Al, Cu, Fe, Ag. Số kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là
 Xem đáp án
Xem đáp án
Có 2 kim loại trong dãy phản ứng được với dung dịch H2SO4 loãng là Al và Fe:
Al + H2SO4 —> Al2(SO4)3 + H2
Fe + H2SO4 —> FeSO4 + H2
Chọn D
Câu 15:
Chất nào sau đây là chất điện li yếu?
 Xem đáp án
Xem đáp án
CH3COOH là chất điện li yếu vì khi tan trong nước, nó chỉ phân li một phần thành ion:
CH3COOH ⇌ CH3COO- + H+.
Chọn B
Câu 16:
Chất nào sau đây không bị thủy phân trong môi trường axit?
 Xem đáp án
Xem đáp án
Fructozơ là monosaccarit nên không bị thủy phân khi đun nóng trong môi trường axit.
Chọn C
Câu 17:
Baking soda (thuốc muối, bột nở) là tên gọi hay dùng trong ngành thực phẩm của hợp chất sodium bicarbonate (tiếng Việt là natri hidrocacbonat hay natri bicacbonat). Công thức hóa học của Baking soda là
 Xem đáp án
Xem đáp án
Chọn A
Câu 18:
Chất nào sau đây là đồng phân của propylamin?
 Xem đáp án
Xem đáp án
Trimetylamin là đồng phân của propylamin vì chúng có cùng công thức phân tử là C3H9N.
Chọn A
Câu 19:
Muối nào sau đây tạo kết tủa khi tác dụng với dung dịch NaOH?
 Xem đáp án
Xem đáp án
Ca(HCO3)2 tạo kết tủa khi tác dụng với dung dịch NaOH:
Ca(HCO3)2 + 2NaOH —> CaCO3 + Na2CO3 + 2H2O
Chọn D
Câu 20:
Nung 6,0 gam hỗn hợp Al và Fe trong không khí, thu được 8,4 gam hỗn hợp X chỉ chứa các oxit. Hòa tan hoàn toàn X cần vừa đủ V ml dung dịch HCl 1M. Giá trị V là
 Xem đáp án
Xem đáp án
nH2O = nO = (8,4 – 6)/16 = 0,15
Bảo toàn H —> nHCl = 2nH2O = 0,3 —> V = 300 ml
Chọn C
Câu 21:
Cho 7,12 gam alanin tác dụng với dung dịch chứa 0,1 mol NaOH. Sau phản ứng xảy ra hoàn toàn, cô cạn dung dịch, khối lượng chất rắn khan thu được là
 Xem đáp án
Xem đáp án
H2N-CH(CH3)-COOH + NaOH —> H2N-CH(CH3)-COONa + H2O
nAla = 0,08; nNaOH = 0,1 —> nH2O = 0,08
Bảo toàn khối lượng —> m rắn = 9,68 gam
Chọn D
Câu 22:
Cho 2,7 gam kim loại Al tác dụng với dung dịch NaOH dư, sau phản ứng hoàn toàn thu được V lít khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
2Al + 2NaOH + 2H2O —> 2NaAlO2 + 3H2
nAl = 0,1 —> nH2 = 0,15 —> V = 3,36 lít
Chọn A
Câu 23:
Cho dung dịch Ba(OH)2 đến dư lần lượt vào các dung dịch sau: NaHCO3, AlCl3, NaHSO4, NH4Cl, FeCl3, Na2SO4 và Na3PO4. Số trường hợp thu được kết tủa sau khi kết thúc thí nghiệm là
 Xem đáp án
Xem đáp án
NaHCO3 + Ba(OH)2 —> BaCO3 + NaOH + H2O
AlCl3 + Ba(OH)2 —> Ba(AlO2)2 + BaCl2 + H2O
NaHSO4 + Ba(OH)2 —> BaSO4 + NaOH + H2O
NH4Cl + Ba(OH)2 —> BaCl2 + NH3 + H2O
FeCl3 + Ba(OH)2 —> BaCl2 + Fe(OH)3
Na2SO4 + Ba(OH)2 —> NaOH + BaSO4
Na3PO4 + Ba(OH)2 —> NaOH + Ba3(PO4)2
Chọn A
Câu 24:
Để xà phòng hoá 2,22 gam một este no, đơn chức, mạch hở X cần dùng 30 ml dung dịch NaOH 1M. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
nX = nNaOH = 0,03
—> MX = 74: X là C3H6O2
Chọn B
Câu 25:
Tiến hành thí nghiệm theo các bước sau đây:
Bước 1: Lấy 3 ống nghiệm, mỗi ống đựng khoảng 3 ml dung dịch HCl loãng.
Bước 2: Cho 3 mẫu kim loại có kích thước tương đương là Al, Fe, Cu vào 3 ống nghiệm.
Bước 3: Quan sát, so sánh lượng bọt khí hiđro thoát ra ở các ống nghiệm trên.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Al + HCl —> AlCl3 + H2
Fe + HCl —> FeCl2 + H2
Cu không phản ứng. Al có tính khử mạnh hơn Fe nên khí H2 thoát ra từ Al mạnh hơn từ Fe.
—> C sai.
Chọn C
Câu 26:
Đốt cháy hoàn toàn m gam hỗn hợp X chứa các triglixerit tạo bởi từ cả 3 axit panmitic, oleic, stearic thu được 48,4 gam CO2 và 18,72 gam H2O. Nếu xà phòng hóa hoàn toàn m gam X bằng dung dịch KOH vừa đủ sẽ thu được a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
X là các đồng phân của (C15H31COO)(C17H33COO)(C17H35COO)C3H5
nCO2 = 1,1 —> nX = nCO2/55 = 0,02
Muối gồm C15H31COOK (0,02, C17H33COOK (0,02) và C17H35COOK (0,02)
—> m muối = 18,72 gam
Chọn D
Câu 27:
Thí nghiệm nào sau đây không tạo ra đơn chất?
 Xem đáp án
Xem đáp án
A. Na + H2O —> NaOH + H2
NaOH + FeCl2 —> Fe(OH)2 + NaCl
B. Al + H2O + NaOH —> NaAlO2 + H2
C. Cu + AgNO3 —> Cu(NO3)2 + Ag
D. FeCl3 + AgNO3 —> AgCl + Fe(NO3)3
Chọn D
Câu 28:
Nung nóng hoàn toàn hỗn hợp CaCO3, Ba(HCO3)2, MgCO3, Mg(HCO3)2 đến khối lượng không đổi, thu được sản phẩm chất rắn gồm
 Xem đáp án
Xem đáp án
CaCO3 —> CaO + CO2
Ba(HCO3)2 —> BaO + CO2 + H2O
MgCO3 —> MgO + CO2
Mg(HCO3)2 —> MgO + CO2 + H2O
—> Sản phẩm chất rắn gồm: CaO, BaO, MgO.
Chọn B
Câu 29:
Phát biểu nào sau đây đúng
 Xem đáp án
Xem đáp án
A. Sai, poli(etylen terephtalat) được điều chế bằng phản ứng trùng ngưng C2H4(OH)2 và p-C6H4(COOH)2.
B. Đúng, poli(metyl metacrylat) được điều chế bằng phản ứng trùng hợp CH2=C(CH3)-COOCH3.
C. Sai, trùng ngưng axit adipic với hexametylendiamin thu được nilon-6,6.
D. Sai, trùng ngưng axit ε-aminocaproic thu được policaproamit.
Chọn B
Câu 30:
Nung nóng hỗn hợp X gồm metan, etilen, propin, vinyl axetilen và a mol H2 có Ni xúc tác (chỉ xảy ra phản ứng cộng H2) thu được 0,1 mol hỗn hợp Y (gồm các hiđrocacbon) có tỉ khối so với H2 là 17,4. Biết 0,1 mol Y phản ứng tối đa với 0,04 mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Y có dạng CnH2n+2-2k với k = nBr2/nY = 0,4
MY = 14n + 2 – 2k = 17,4.2 —> n = 2,4
—> Y là C2,4H6
Phản ứng cộng H2 không làm thay đổi số C nên các hiđrocacbon trong X có dạng C2,4H4.
C2,4H4 + H2 —> C2,4H6
—> nH2 = nY = 0,1
Chọn A
Câu 31:
Đốt cháy hoàn toàn x gam hỗn hợp gồm xenlulozơ, tinh bột, glucozơ và saccarozơ cần V lít O2 (đktc), sản phẩm thu được dẫn qua bình H2SO4 đặc thấy bình tăng y gam. Biết rằng x - y = 2,4. Giá trị của V là
 Xem đáp án
Xem đáp án
Quy đổi hỗn hợp thành C (a mol), H2O (b mol)
—> 12a + 18b – 18b = 2,4 —> a = 0,2
—> nO2 = 0,2 —> V = 4,48 lít
Chọn D
Câu 32:
Cho dãy các chất: phenyl axetat, metyl axetat, etyl fomat, tripanmitin, vinyl axetat, metyacrylat. Số chất trong dãy khi thủy phân trong dung dịch NaOH loãng, đun nóng sinh ra ancol là
 Xem đáp án
Xem đáp án
phenyl axetat
CH3COOC6H5 + 2NaOH → CH3COONa + C6H5ONa + H2O
metyl axetat
CH3COOCH3 + NaOH → CH3COONa + CH3OH
etyl fomat
HCOOC2H5 + NaOH → HCOONa + C2H5OH
tripanmitin
(C15H31COO)3C3H5 + 3NaOH → 3C15H31COONa + C3H5(OH)3
vinyl axetat
CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO
metyacrylat
CH2=CH-COOCH3 + NaOH → CH2=CH-COONa + CH3OH
Chọn D
Câu 33:
Cho 5,956 gam hỗn hợp chất rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,24 mol HCl và 0,02 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,03 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,01 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 35,52 gam kết tủa. Phần trăm khối lượng Fe3O4 trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Thêm AgNO3 vào Y thấy xuất hiện khí NO chứng tỏ Y chứa Fe2+, H+ dư và không có NO3-.
nAgCl = 0,24 —> nAg = 0,01
Bảo toàn electron: nFe2+ = 3nNO + nAg = 0,04
nH+ dư = 4nNO = 0,04
Dung dịch Y chứa Fe2+ (0,04), H+ dư (0,04), Cl- (0,24), bảo toàn điện tích —> nFe3+ = 0,04
Ban đầu đặt a, b, c là số mol Fe, Fe3O4 và Fe(NO3)2
mX = 56a + 232b + 180c = 5,956 (1)
nFe = a + 3b + c = 0,04 + 0,04 (2)
Bảo toàn H —> nH2O = 0,11
Bảo toàn O:
4b + 6c + 0,02.3 = 0,03 + 0,11 (3)
(1)(2)(3) —> a = 0,0445; b = 0,0095; c = 0,007
—> %Fe3O4 = 37,00%
Chọn C
Câu 34:
Cho các phát biểu sau:
(a) Trong giấm ăn có chứa axit axetic.
(b) Trong một phân tử triolein có 3 liên kết π.
(c) Khi tham gia phản ứng hiđro hóa, andehit axetic bị khử thành ancol etylic.
(d) Thủy phân hoàn toàn tinh bột hoặc xenlulozơ trong môi trường kiềm, đều thu được glucozơ.
(e) Có thể tiêu hủy túi nilon và đồ nhựa bằng cách đốt cháy vì không gây ô nhiễm môi trường.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, trong một phân tử triolein có 6 liên kết π (3C=C và 3C=O)
(c) Đúng: CH3CHO + H2 —> CH3CH2OH
(d) Sai, tinh bột và xenlulozơ không bị thủy phân trong môi trường kiềm.
(e) Sai, quá trình đốt cháy tạo nhiều khói độc và tro độc.
Chọn C
Câu 35:
Cho các phát biểu sau:
(a) Cho dung dịch NH3 vào dung dịch AlCl3 có xuất hiện kết tủa.
(b) Nhiệt phân hoàn toàn Cu(NO3)2 tạo thành Cu.
(c) Hỗn hợp Na2O và Al (tỉ lệ mol 1:1) tan hết trong nước dư.
(d) Trong công nghiệp dược phẩm, NaHCO3 được dùng để điều chế thuốc đau dạ dày.
(e) Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy AlCl3.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng.
3NH3 + 3H2O + AlCl3 —> Al(OH)3 + 3NH4Cl
(b) Sai: 2Cu(NO3)2 —> 2CuO + 4NO2 + O2
(c) Đúng:
Na2O + H2O —> 2NaOH
Al + NaOH + H2O —> NaAlO2 + 1,5H2
(d) Đúng
(e) Sai, điện phân nóng chảy Al2O3.
Chọn D
Câu 36:
Cho m gam hỗn hợp E (gồm este đơn chức X và este hai chức Y mạch hở) tác dụng vừa đủ với dung dịch NaOH, thu được hỗn hợp Z chứa hai muối và một ancol T duy nhất. Đốt cháy hoàn toàn Z cần vừa đủ 1,19 mol O2, thu được 14,84 gam Na2CO3; tổng số mol CO2 và H2O bằng 1,58 mol. Cho T tác dụng với Na dư, thoát ra 1,792 lít khí (đktc). Biết để đốt cháy hết m gam E cần vừa đủ 1,51 mol O2. Phần trăm khối lượng của Y trong E có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
nNa2CO3 = 0,14 —> nNaOH = 0,28
nH2 = 0,08 —> nOH trong ancol = 0,16
—> X là este của phenol và nX = (0,28 – 0,16)/2 = 0,06
X là RCOOP (0,06); Y là (RCOO)2A (0,08)
Muối gồm RCOONa (0,22) và PONa (0,06). Đốt muối —> nCO2 = u và nH2O = v
—> u + v = 1,58
Bảo toàn O —> 2u + v + 0,14.3 = 0,22.2 + 0,06 + 1,19.2
—> u = 0,88 và v = 0,7
Bảo toàn khối lượng:
mZ = 0,22(R + 67) + 0,06(P + 39) = mCO2 + mH2O + mNa2CO3 – mO2
—> 11R + 3P = 550
Do R ≥ 1 và P ≥ 77 —> R = 29 và P = 77 là nghiệm duy nhất.
Muối gồm C2H5COONa và C6H5ONa.
nO2 đốt T = nO2 đốt E – nO2 đốt Z = 0,32
T có dạng CxHyO2 (0,08 mol)
CxHyO2 + (x + 0,25y – 1)O2 —> xCO2 + 0,5yH2O
nO2 = 0,08(x + 0,25y – 1) = 0,32
—> 4x + y = 20
Do y ≤ 2x + 2 nên x = 3 và y = 8 là nghiệm duy nhất. T là C3H6(OH)2.
X là C2H5COO-C6H5 (0,06)
Y là (C2H5COO)2C3H6 (0,08)
—> %Y = 62,56%
Chọn B
Câu 37:
Dẫn 0,32 mol hỗn hợp gồm khí CO2 và hơi nước qua cacbon nung đỏ thu được 0,54 mol hỗn hợp X gồm CO, H2 và CO2. Cho toàn bộ X vào dung dịch chứa 0,12 mol NaOH và a mol Ba(OH)2, sau phản ứng hoàn toàn thu được m gam kết tủa và dung dịch Y. Nhỏ từ từ từng giọt đến hết Y vào 100 ml dung dịch HCl 0,6M thu được 0,02 mol khí CO2. Giá trị của m là
 Xem đáp án
Xem đáp án
nC phản ứng = 0,54 – 0,32 = 0,22
Bảo toàn electron: 4nC phản ứng = 2nCO + 2nH2
—> nCO + nH2 = 0,44 —> nCO2 = 0,54 – 0,44 = 0,1
nHCl = 0,06 < nNaOH nên HCl hết.
nHCl > 2nCO2 nên Y chứa Na2CO3 và NaOH dư
nNa2CO3 phản ứng = nCO2 = 0,02
nHCl = 2nNa2CO3 phản ứng + nNaOH phản ứng
—> nNaOH phản ứng = 0,02
—> Y chứa Na2CO3 (x) và NaOH dư (x)
nNaOH ban đầu = 2x + x = 0,12 —> x = 0,04
Bảo toàn C —> nBaCO3 = 0,1 – x = 0,06
—> mBaCO3 = 11,82 gam
Chọn D
Câu 38:
Cho sơ đồ sau (các chất phản ứng theo đúng tỉ lệ mol):
(1) X + NaOH (t°) → X1 + X2
(2) X1 + NaOH (CaO, t°) → X3 + Na2CO3
(3) X2 (H2SO4 đặc, 170°C) → X4 + H2O
(4) X2 + O2 (men giấm) → X5 + H2O
(5) 2X3 (1500°C, làm lạnh nhanh) → X6 + 3H2
(6) X6 + H2O (HgSO4, 80°C) → X7
(7) X7 + H2 (Ni, t°) → X2
Trong số các phát biểu sau:
(a) Trong phân tử X có 4 nguyên tử cacbon.
(b) Tổng số liên kết giữa các nguyên tử trong phân tử X2 là 8.
(c) X4 làm mất màu dung dịch Br2.
(d) X6 có phản ứng với AgNO3/NH3 dư, tạo thành kết tủa màu trắng bạc.
(e) Cho đá vôi vào dung dịch X5 sẽ có khí bay ra.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(4) —> X2 là C2H5OH; X5 là CH3COOH
(5) —> X3 là CH4; X6 là C2H2
(6) —> X7 là CH3CHO
(3) —> X4 là C2H4
(2) —> X1 là CH3COONa
(1) —> X là CH3COOC2H5
(a) Đúng, X là C4H8O2.
(b) Đúng, CH3CH2OH có 8 liên kết (5C-H, 1C-C, 1C-O, 1O-H)
(c) Đúng: C2H4 + Br2 —> C2H4Br2
(d) Sai, X6 + AgNO3 + NH3 —> C2Ag2 (↓ vàng) + NH4NO3
(e) Đúng: CH3COOH + CaCO3 —> (CH3COO)2Ca + CO2 + H2O
Chọn C
Câu 39:
Cho sơ đồ các phản ứng sau:
(a) X1 + H2O → X2 + X3↑ + H2↑ (Điện phân dung dịch có màng ngăn).
(b) X2 + X4 → CaCO3 + Na2CO3 + H2O
(c) X2 + X3 → X1 + X5 + H2O.
(d) X4 + X6 → CaSO4 + Na2SO4 + CO2 + H2O.
Các chất X5, X6 thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
(a) NaCl + H2O —> NaOH + Cl2 + H2
(b) 2NaOH + Ca(HCO3)2 —> CaCO3 + Na2CO3 + 2H2O
(c) NaOH + Cl2 —> NaCl + NaClO + H2O
(d) Ca(HCO3)2 + 2NaHSO4 —> CaSO4 + Na2SO4 + 2CO2 + 2H2O.
—> X5, X6 là NaClO, NaHSO4.
Chọn D
Câu 40:
Điện phân dung dịch chứa đồng thời NaCl và CuSO4 (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi nước) với cường độ dòng điện không đổi. Kết quả của thí nghiệm được ghi ở bảng sau:
|
Thời gian (s) |
Khối lượng catot tăng |
Anot |
Khối lượng dung dịch giảm |
|
t1 = 1544 |
m (gam) |
Một khí duy nhất |
5,4 (gam) |
|
t2 = 4632 |
3m (gam) |
Hỗn hợp khí |
15,1 (gam) |
|
t |
4,5m (gam) |
Hỗn hợp khí |
20,71 (gam) |
Giá trị của t là
 Xem đáp án
Xem đáp án
Trong 1544 giây: nCu = nCl2 = a
—> m giảm = 64a + 71a = 5,4 —> a = 0,04
—> m = 64a = 2,56
ne trong 1544s = 2nCu = 0,08 (1)
Trong 4632 giây: nCu = 3a = 0,12; nCl2 = u và nO2 = v
m giảm = 0,12.64 + 71u + 32v = 15,1
Bảo toàn electron —> 0,12.2 = 2u + 4v
—> u = 0,1 và v = 0,01
Trong t giây: nCu = 4,5a = 0,18; nH2 = x; nCl2 = 0,1 và nO2 = y
m giảm = 0,18.64 + 2x + 0,1.71 + 32y = 20,71
Bảo toàn electron —> 0,18.2 + 2x = 0,1.2 + 4y
—> x = 0,045; y = 0,0625
—> ne trong t giây = 0,18.2 + 2x = 0,45 (2)
(1)(2) —> 1544.0,45 = 0,08t
—> t = 8685s
Chọn B
