Thi Online (2023) Đề thi thử Hóa Sở giáo dục đào tạo Hà Tĩnh (Đề 2) có đáp án
Thi Online (2023) Đề thi thử Hóa Sở giáo dục đào tạo Hà Tĩnh (Đề 2) có đáp án
-
527 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Trong công nghiệp, kim loại Na được điều chế bằng phương pháp điện phân nóng chảy muối NaCl:
2NaCl điện phân nóng chảy → 2Na + Cl2
Câu 2:
Cho kim loại Natri phản ứng với dung dịch axit clohidric (dư) thu được khí H2 và sản phẩm nào sau đây?
 Xem đáp án
Xem đáp án
Cho kim loại Natri phản ứng với dung dịch axit clohidric (dư) thu được khí H2 và NaCl:
Na + HCl → NaCl + H2
Câu 6:
Kim loại nào sau đây dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Độ dẫn điện: Ag > Cu > Au > Al > Fe → Kim loại dẫn điện tốt nhất là Ag.
Câu 7:
Trường hợp nào sau đây kim loại bị ăn mòn điện hóa?
 Xem đáp án
Xem đáp án
A. Không có ăn mòn điện hóa do không có cặp điện cực.
B. Không có ăn mòn điện hóa do không có cặp điện cực và môi trường điện li.
C. Không có ăn mòn điện hóa do không có cặp điện cực.
D. Có ăn mòn điện hóa do có cặp điện cực Zn-Cu (Cu tạo ra so Zn khử Cu2+) và môi trường điện li là dung dịch CuSO4.
Câu 8:
Cho NH4Cl vào dung dịch nào sau đây sẽ thu được chất khí?
 Xem đáp án
Xem đáp án
Cho NH4Cl vào dung dịch Ca(OH)2 sẽ thu được chất khí:
NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O
Câu 11:
Một trong những nguyên nhân gây tử vong trong nhiều vụ cháy là do nhiễm độc khí X. Khi vào cơ thể, khí X kết hợp với hemoglobin, làm giảm khả năng vận chuyển oxi của máu. Khí X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 13:
Kim loại nào sau đây phản ứng được với dung dịch FeSO4 và dung dịch H2SO4 đặc, nguội?
 Xem đáp án
Xem đáp án
Chọn C
Câu 14:
Hợp chất Al(OH)3 tan được trong dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Hợp chất Al(OH)3 tan được trong dung dịch NaOH:
Al(OH)3 + NaOH → NaAlO2 + H2O
Câu 20:
Nung Fe(OH)3 trong không khí đến khối lượng không đổi, thu được chất rắn là
 Xem đáp án
Xem đáp án
Nung Fe(OH)3 trong không khí đến khối lượng không đổi, thu được chất rắn là Fe2O3:
Fe(OH)3 → Fe2O3 + H2O
Câu 21:
Este X công thức phân tử C8H8O2 tác dụng với dung dịch NaOH thu được dung dịch chứa hai muối. Biết X có tham gia phản ứng tráng gương. Công thức cấu tạo thu gọn của X là
 Xem đáp án
Xem đáp án
X đơn chức, tạo 2 muối nên X là este của phenol.
X có tham gia phản ứng tráng gương → X có HCOO-
→ X là HCOO-C6H4-CH3
Câu 22:
Cho sơ đồ chuyển hóa sau:
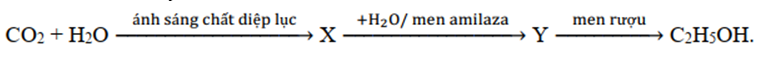
Các chất X, Y thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Các chất X, Y thỏa mãn sơ đồ trên lần lượt là tinh bột, glucozơ:
6nCO2 + 5nH2O → (C6H10O5)n + 6nO2 (quang hợp)
(C6H10O5)n + nH2O → nC6H12O6 (men amilaza)
C6H12O6 → 2C2H5OH + 2CO2 (men rượu)
Câu 23:
Cho 9 gam một amin X (đơn chức, bậc 1) tác dụng với dung dịch HCl vừa đủ, thu được 16,3 gam muối. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
X đơn chức nên nX = nHCl = (m muối – mX)/36,5 = 0,2
→ MX = 9/0,2 = 45: C2H7N
X bậc 1 nên có cấu tạo: C2H5NH2
Câu 24:
Cho 4 dung dịch riêng biệt: CuCl2, FeCl3, HCl và NaHCO3. Số dung dịch có khả năng phản ứng được với kim loại Ba tạo kết tủa là
 Xem đáp án
Xem đáp án
Có 3 dung dịch phản ứng được với kim loại Ba tạo kết tủa là: CuCl2, FeCl3 và NaHCO3
Ba + H2O → Ba(OH)2 + H2
CuCl2 + Ba(OH)2 → BaCl2 + Cu(OH)2
FeCl3 + Ba(OH)2 → BaCl2 + Fe(OH)3
NaHCO3 + Ba(OH)2 → BaCO3 + NaOH + H2O
Câu 25:
Este X no, đơn chức, mạch hở. Cho 14,28 gam X tác dụng hoàn toàn với 200 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được 15,84 gam chất rắn khan. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
nNaOH = 0,2, bảo toàn khối lượng → mAncol = 6,44
nRCOOR’ = nR’OH
⇔ 14,28/(R + R’ + 44) = 6,44/(R’ + 17)
→ Chọn R = 29; R’ = 29, X là C2H5COOC2H5
Câu 26:
Cho m gam hỗn hợp CuO và Fe2O3 vào dung dịch HCl (dư), sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X chứa 2 muối có tỉ lệ mol 1 : 1. Phần trăm khối lượng của CuO là
 Xem đáp án
Xem đáp án
Tự chọn nCuCl2 = nFeCl3 = 1
Bảo toàn Cu, Fe → nCuO = 1 và nFe2O3 = 0,5
→ %mCuO = 50%
Câu 27:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Đúng
B. Sai, tơ visco, tơ xenlulozơ axetat đều thuộc loại tơ bán tổng hợp.
C. Sai, nilon–6,6 được điều chế từ hexametylen điamin và axit adipic.
D. Sai, polietilen và poli(vinyl clorua) là sản phẩm của phản ứng trùng hợp.
Câu 28:
Cho 20,4 gam oxit của kim loại M tác dụng với dung dịch H2SO4 1,5M thì cần vừa đủ 340 ml. Oxit đó là
 Xem đáp án
Xem đáp án
nO = nH2O = H2SO4 = 0,51
Oxit dạng MxOy (0,51/y mol)
→ Mx + 16y = 20,4y/0,51
→ M = 24y/x
Chọn x = y = 1, M = 24: M là Mg, oxit là MgO.
Câu 29:
Đun nóng dung dịch chứa m gam glucozơ với dung dịch AgNO3 trong NH3 (dư), thu được 32,4 gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
nAg = 0,3 → nC6H12O6 = 0,15 → mC6H12O6 = 27 gam
Câu 30:
Có V lít dung dịch NaOH 0,60M. Thí nghiệm nào sau đây làm pH của dung dịch đó tăng lên?
 Xem đáp án
Xem đáp án
pH tăng khi [OH-] tăng; [OH-] ban đầu = 0,6
A. pH tăng vì 0,67 > 0,6 nên sau khi pha trộn [OH-] sẽ tăng lên.
B. pH giảm vì 0,4 < 0,6 nên sau khi pha trộn [OH-] sẽ giảm xuống.
C. pH giảm vì [OH-] giảm do nOH- không đổi và thể tích tăng.
D. pH giảm vì [OH-] giảm do nOH- giảm (bị trung hòa) và thể tích tăng.
Câu 31:
Tiến hành điện phân dung dịch X chứa FeCl3 (0,15 mol), CuCl2 (0,05 mol), KCl (0,05) và HCl (0,2 mol) (điện cực trơ) với I = 3A trong thời gian 17370 giây. Cho dung dịch sau điện phân tác dụng hoàn toàn với lượng dư dung dịch AgNO3 thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
nCl- (X) = 0,8; ne = It/F = 0,54
Anot: nCl2 = ne/2 = 0,27
Catot:
Fe3+ + 1e → Fe2+
Cu2+ + 2e → Cu
2H+ + 2e → H2
Fe2+ + 2e → Fe
Dung dịch sau điện phân chứa Fe2+ (0,105), K+ (0,05), Cl- (0,26)
→ nAg = 0,105 và nAgCl = 0,26 → m = 48,65
Câu 32:
Cho sơ đồ các phản ứng theo đúng tỉ lệ mol:
(a) X (t°) → Y + CO2
(b) Y + H2O → Z
(c) T + Z → R + X + H2O
(d) 2T + Z → Q + X + 2H2O
Các chất R, Q thỏa mãn sơ đồ trên lần lượt là:
 Xem đáp án
Xem đáp án
(a) X (t°) → Y + CO2
CaCO3 → CaO + CO2
(b) Y + H2O → Z
CaO + H2O → Ca(OH)2
(c) T + Z → R + X + H2O
NaHCO3 + Ca(OH)2 → NaOH + CaCO3 + H2O
(d) 2T + Z → Q + X + 2H2O
2NaHCO3 + Ca(OH)2 → Na2CO3 + CaCO3 + 2H2O
Các chất R, Q thỏa mãn sơ đồ trên lần lượt là NaOH, Na2CO3
Câu 33:
Hỗn hợp E gồm axit panmitic, axit linoleic và triglixerit X, trong đó cacbon chiếm 75,9825% về khối lượng. Cho m gam E phản ứng vừa đủ với dung dịch NaOH, thu được 34,32 gam hỗn hợp chỉ gồm 2 muối. Đốt cháy m gam E thu được 1,93 mol H2O. Mặt khác 48,09 gam E phản ứng tối đa a mol Br2. Giá trị của a là
 Xem đáp án
Xem đáp án
nC15H31COONa = x; nC17H31COONa = y; nC3H5(OH)3 = z; nCO2 = t
m muối = 278x + 302y = 34,32 (1)
Bảo toàn C → 16x + 18y + 3z = t (2)
nNaOH = x + y = 3nC3H5(OH)3 + H2O (trung hòa axit)
→ nH2O (trung hòa axit) = x + y – 3z
Bảo toàn khối lượng:
12t/75,9825% + 40(x + y) = 34,32 + 92z + 18(x + y – 3z) (3)
Bảo toàn H:
1,93.2 + x + y = 31x + 31y + 8z + 2(x + y – 3z) (4)
(1)(2)(3)(4) → x = 0,08; y = 0,04; z = 0,01; t = 2,03
→ mE = 12t/75,9825% = 32,06 và nBr2 = 2y = 0,08
Khi mE = 48,09 thì nBr2 = a = 48,09.0,08/32,06 = 0,12
Câu 34:
Để có 100 kg NPK 12 – 5 – 10 một kỹ sư nông nghiệp đã tiến hành phối trộn các muối khan (NH4)2SO4, Ca(H2PO4)2, KCl và x kg mùn hữu cơ (chất phụ gia). Giá trị của x gần nhất với
 Xem đáp án
Xem đáp án
Đặt a, b, c là số mol (NH4)2SO4, Ca(H2PO4)2, KCl
mN = 12 = 14.2a → a = 0,4286
mP2O5 = 5 = 142b → b = 0,0352
mK2O = 10 = 94.0,5c → c = 0,2128
→ x = 100 – (132a + 234b + 74,5c) = 19,3 kg
Câu 35:
Cho E (C5H6O3) và F (C7H8O4) là hai chất hữu cơ mạch hở đều tạo từ axit cacboxylic và ancol. Từ E và F thực hiện sơ đồ các phản ứng sau:
(1) E + NaOH (t°) → X + Y
(2) F + 2NaOH (t°) → X + Y + Z
(3) X + HCl → J + NaCl
(4) Z + HCl → G + NaCl
Biết X, Y, Z là các chất hữu cơ, Y và Z đều có 2 nguyên tử cacbon. Cho các phát biểu sau:
(a) Chất F là hợp chất hữu cơ tạp chức.
(b) Chất Y và chất J đều hòa tan được Cu(OH)2 ở nhiệt độ thường.
(c) Từ Metanol điều chế trực tiếp được chất G.
(d) Đốt cháy hoàn toàn 1 mol Z thu được 2 mol CO2.
(e) X có phân tử khối bằng 94.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(3)(4) → X và Z chứa Na
E và F đều tạo từ axit cacboxylic và ancol; Y và Z đều có 2C nên:
E là CH≡C-COO-CH2-CH2-OH
X là CH≡C-COONa và Y là C2H4(OH)2
F là CH≡C-COO-CH2-CH2-OOC-CH3
Z là CH3COONa
J là CH≡C-COOH; G là CH3COOH
(a) Sai, F là hợp chất đa chức (este 2 chức)
(b) Đúng:
C2H4(OH)2 + Cu(OH)2 → (C2H5O2)2Cu + H2O
CH≡C-COOH + Cu(OH)2 → (CH≡C-COO)2Cu + H2O
(c) Đúng: CH3OH + CO → CH3COOH
(d) Sai, đốt 1 mol Z thu 1,5 mol CO2
2CH3COONa + 4O2 → 3CO2 + 3H2O + Na2CO3
(e) Sai, MX = 92
Câu 36:
Đốt cháy hoàn toàn 0,5 mol hỗn hợp E gồm ba chất hữu cơ mạch hở X, Y, Z (Chỉ chứa nhóm chức este, MX < MY < MZ) cần dùng 3,15 mol O2, thu được 3,3 mol CO2 và 2 mol H2O. Mặt khác hiđro hóa hoàn toàn 0,5 mol E bằng lượng H2 vừa đủ (xúc tác Ni, t°), thu được hỗn hợp F gồm hai hợp chất hữu cơ. Đun nóng toàn bộ F với dung dịch NaOH vừa đủ, thu được hỗn hợp G gồm 3 muối của 3 axit cacboxylic đơn chức và hỗn hợp H gồm hai ancol no hơn kém nhau một nguyên tử cacbon. Tỉ khối hơi của H so với H2 bằng 35,5. Phần trăm khối lượng của X trong hỗn hợp E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng → mE = 80,4
Bảo toàn O → nO(H) = nO(E) = 2,3 → nNaOH = 1,15
Các muối cacboxylat đơn chức nên n(H) = nF = nE = 0,5
→ Số O trung bình của H = 1,15/0,5 = 2,3
H dạng CnH2n+2O2,3 → MH = 14n + 38,8 = 35,5.2
→ n = 2,3 → H gồm C2H4(OH)2 (0,35) và C3H5(OH)3 (0,15)
F gồm 2 este với số C là x, y tương ứng với 2 ancol kể trên.
→ nCO2 = 0,35x + 0,15y = 3,3 → 7x + 3y = 66
Với x ≥ 4; y ≥ 6 → x = 6, y = 8 là nghiệm duy nhất
→ F gồm C6H10O4 (0,35) và C8H12O6 (0,15) → mF = 81,7
→ nH2 = (mF – mE)/2 = 0,65
Từ F tạo 3 muối nên có 2 trường hợp:
TH1: F gồm:
(CH3COO)2C2H4: 0,35
(HCOO)2(C2H5COO)C3H5: 0,15
E gồm:
X là (CH3COO)2C2H4: 0,35
Z là (HCOO)2(C2H3COO)C3H5: u
Y là (HCOO)2(C2HCOO)C3H5: v
→ u + v = 0,15 và nH2 = u + 2v = 0,65
→ Vô nghiệm, loại.
TH2: F gồm:
(HCOO)(C2H5COO)C2H4: 0,35
(HCOO)(CH3COO)2C3H5: 0,15
E gồm:
Y là (HCOO)(C2H3COO)C2H4: u
X là (HCOO)(C2HCOO)C2H4: v
Z là (HCOO)(CH3COO)2C3H5: 0,15
→ u + v = 0,35 và nH2 = u + 2v = 0,65
→ u = 0,05; v = 0,3
→ %X = 0,3.142/80,4 = 52,99%
Câu 37:
Xăng E5 là một loại xăng sinh học, được tạo thành khi trộn 5 thể tích etanol (cồn) với 95 thể tích xăng truyền thống, giúp thay thế một phần nhiên liệu hóa thạch, phù hợp với xu thế phát triển chung trên thế giới và góp phần đảm bảo an ninh năng lượng quốc gia. Một loại xăng E5 có tỉ lệ số mol như sau: 5% etanol, 35% heptan, 60% octan. Khi được đốt cháy hoàn toàn, 1 mol etanol sinh ra một lượng năng lượng là 1367kJ; 1 mol heptan sinh ra một lượng năng lượng là 4825 kJ và 1 mol octan sinh ra một lượng năng lượng là 5460 kJ, năng lượng giải phóng ra có 20% thải vào môi trường, các phản ứng xảy ra hoàn toàn. Một xe máy chạy 1 giờ cần một năng lượng là 37688 kJ. Nếu xe máy chạy 3,5 giờ với tốc độ trung bình như trên thì số kg xăng E5 cần sử dụng gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Có 20% năng lượng thải vào môi trường nên có 80% năng lượng sinh công.
Năng lượng cần thiết để xe chạy 3,5h là 37688.3,5/80% = 164885 kJ
Năng lượng trên được cung cấp bởi x mol xăng E5, gồm nC2H5OH = 0,05x; nC7H16 = 0,35x; nC8H18 = 0,6x
Bảo toàn năng lượng:
1367.0,05x + 4825.0,35x + 5460.0,6x = 164885
→ x = 32,76
→ m xăng = 46.0,05x + 100.0,35x + 114.0,6x = 3453,22 gam ≈ 3,453 kg
Câu 38:
Tiến hành các thí nghiệm sau:
(a) Cho nước cứng tạm thời vào lượng dư dung dịch BaCl2.
(b) Cho dung dịch NH3 dư vào dung dịch AlCl3.
(c) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
(d) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol 1 : 1) vào nước dư.
(e) Cho Ure vào dung dịch CaCl2.
(g) Cho hỗn hợp bột Cu và Fe3O4 (tỉ lệ mol 1 : 1) vào dung dịch HCl dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm có kết tủa là
 Xem đáp án
Xem đáp án
(a) Không phản ứng
(b) NH3 + H2O + AlCl3 → Al(OH)3 + NH4Cl
(c) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
(d) Na2O + Al2O3 → 2NaAlO2
(e) (NH2)2CO + H2O + CaCl2 → CaCO3 + NH4Cl
(g) Cu + Fe3O4 + 8HCl → CuCl2 + 3FeCl2 + 4H2O
Câu 39:
Nung m gam hỗn hợp rắn X gồm FeCO3, FeS2, CuO, Fe2O3 (trong đó lưu huỳnh chiếm 2,5% về khối lượng) trong bình kín chứa không khí (dư). Sau khi các phản ứng xảy ra hoàn toàn, đưa bình về nhiệt độ ban đầu nhận thấy áp suất khí trong bình trước và sau phản ứng bằng nhau. Mặt khác, nếu cho m gam X tác dụng hoàn toàn với H2SO4 đặc, nóng dư thì thu được 5,04 lít (đktc) hỗn hợp khí Y (gồm SO2 và CO2) và dung dịch Z chứa (m + 86,2) gam muối. Phần trăm khối lượng của CuO trong X có giá trị gần nhất với
 Xem đáp án
Xem đáp án
Đặt u, v là số mol FeS2, FeCO3
Bảo toàn electron → nO2 phản ứng = (11u + v)/4
Áp suất không đổi nên số mol khí không thay đổi
→ nSO2 + nCO2 = nO2 phản ứng
⇔ 2u + v = (11u + v)/4 (1)
Với H2SO4 đặc nóng, bảo toàn electron:
→ nSO2 = (15u + v)/2
→ n hỗn hợp khí = (15u + v)/2 + v = 0,225 (2)
(1)(2) → u = v = 0,025
→ mX = 32.2u/2,5% = 64 gam
Đặt x, y là số mol CuO và Fe2O3
m = 80x + 160y + 0,025.120 + 0,025.116 = 64
m muối = 160x + 400(2y + 0,025 + 0,025)/2 = 64 + 86,2
→ x = 0,12625; y = 0,3
→ %CuO = 15,78%
Câu 40:
Cho các phát biểu sau:
(a) Tinh bột, tripanmitin đều bị thủy phân trong môi trường kiềm, đun nóng.
(b) Nhiệt độ nóng chảy của glyxin thấp hơn etyl axetat.
(c) Phenol là một axit yếu nhưng có tính axit mạnh hơn axit cacbonic.
(d) Các este khi thủy phân trong môi trường kiềm đều tạo muối và ancol.
(e) Tripeptit Gly-Gly-Glu có 6 nguyên tử oxi trong phân tử.
(g) Mật ong có khả năng phản ứng với dung dịch nước brom.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, tinh bột không bị thủy phân trong môi trường kiềm, đun nóng.
(b) Sai, glyxin tồn tại dạng ion lưỡng cực nên có nhiều tính chất vật lí giống hợp chất ion như nhiệt độ nóng chảy cao, cao hơn nhiều so với etyl axetat.
(c) Sai, phenol có tính axit yếu, yếu hơn cả H2CO3:
C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
(d) Sai, có nhiều este không tạo ancol như HCOOC6H5, CH3COOCH=CH2…
(e) Đúng, số O = 2 + 2 + 4 – 2 = 6
(g) Đúng, mật ong chứa nhiều glucozơ nên làm mất màu Br2.
