Thi Online (2023) Đề thi thử Hóa THPT Gang Thép, Thái Nguyên (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Gang Thép, Thái Nguyên (Lần 1) có đáp án
-
338 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 3:
Thủy phân este X bằng dung dịch NaOH thu được CH3COONa và C2H5OH. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
X là CH3COOCH2CH3:
CH3COOCH2CH3 + NaOH —> CH3COONa + C2H5OH
Chọn A
Câu 4:
Thuốc thử được dùng để phân biệt Gly-Ala-Gly với Gly-Ala là
 Xem đáp án
Xem đáp án
Thuốc thử được dùng để phân biệt Gly-Ala-Gly với Gly-Ala là Cu(OH)2/OH-: Gly-Ala-Gly tạo màu tím, Gly-Ala không tạo màu tím (đipeptit không có phản ứng màu biurê)
Chọn B
Câu 7:
Hòa tan hoàn toàn 2,43 gam hỗn hợp gồm Mg và Zn vào một lượng vừa đủ dung dịch H2SO4 loãng, sau phản ứng thu được 1,12 lít H2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là
 Xem đáp án
Xem đáp án
nSO42- = nH2SO4 = nH2 = 0,05
—> m muối = m kim loại + mSO42- = 7,23 gam.
Chọn A
Câu 10:
Xà phòng hoá hoàn toàn m gam chất béo X cần vừa đủ dung dịch chứa 1,68 moi NaOH. Cô cạn dung dịch sau phản ứng thu được 514,08 gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
nC3H5(OH)3 = nNaOH/3 = 0,56
Bảo toàn khối lượng:
mX + mNaOH = m muối + mC3H5(OH)3 —> mX = 498,4 gam
Chọn D
Câu 11:
Thủy phân 71,28 gam tinh bột với hiệu suất của phản ứng là 80%, khối lượng glucozơ thu được là
 Xem đáp án
Xem đáp án
(C6H10O5)n + nH2O —> nC6H12O6
mC6H12O6 = 80%.71,28.180/162 = 63,36 gam
Chọn B
Câu 12:
Khử hoàn toàn 3,48 gam Fe3O4 bằng CO dư ở nhiệt độ cao, khối lượng Fe thu được sau phản ứng là
 Xem đáp án
Xem đáp án
Fe3O4 + 4CO —> 3Fe + 4CO2
nFe3O4 = 0,015 —> nFe = 0,045 —> mFe = 2,52 gam
Chọn C
Câu 16:
Tơ nilon-6,6 được điều chế từ axit adipic và hexametylenđiamin bằng phản ứng
 Xem đáp án
Xem đáp án
Chọn A
Câu 17:
Cho 18 gam glyxin tác dụng hết với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
H2NCH2COOH + KOH —> H2NCH2COOK + H2O
nH2NCH2COOK = nGly = 0,24
—> mH2NCH2COOK = 27,12 gam
Chọn C
Câu 18:
Tất cả các kim loại Fe, Al, Cu, Ag đều tác dụng được với dung dịch
 Xem đáp án
Xem đáp án
A. HCl: Fe, Al phản ứng.
B. HNO3 loãng: tất cả phản ứng.
C. KOH: Al phản ứng.
D. H2SO4 loãng: Fe, Al phản ứng.
Chọn B
Câu 20:
Glucozơ trong máu tăng cao vượt ngưỡng bình thường nếu không được điều chỉnh kịp thời sẽ dẫn đến bệnh lý đái tháo đường, làm tổn thương tim mạch, mắt, hoặc có thể dẫn tới tử vong. Khi bị bệnh đái tháo đường, người bệnh thường thấy mệt mỏi, thèm ăn (nhất là đồ ngọt), khát nước nhiều, gầy sút cân, đi tiểu nhiều, nước tiểu có thể có kiến hoặc ruồi bu. Vậy công thức phân tử của glucozơ là
 Xem đáp án
Xem đáp án
Chọn D
Câu 21:
Dưới đáy chai hoặc các vật dụng bằng nhựa thường có kí hiệu các con số. Số 6 là kí hiệu của nhựa polistiren (PS). Loại nhựa này đang được sử dụng để sản xuất đồ nhựa như cốc, chén dùng một lần hoặc hộp đựng thức ăn mang về. Ở nhiệt độ cao, nhựa PS bị phân hủy sinh ra các chất có hại cho sức khỏe. Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
A. Đúng, vì ở nhiệt độ cao, nhựa PS bị phân hủy sinh ra các chất có hại cho sức khỏe.
B. Đúng, vì trong lò vi sóng khi hoạt động có nhiệt độ cao.
C. Đúng: C6H5-CH=CH2 —> (-CH2-CH(C6H5)-)n
D. Sai, PS thuộc loại polime tổng hợp.
Chọn D
Câu 22:
Cho 9 gam C2H5NH2 tác dụng vừa đủ với axit HCl. Khối lượng muối thu được là
 Xem đáp án
Xem đáp án
C2H5NH2 + HCl —> C2H5NH3Cl
n muối = nC2H5NH2 = 0,2 —> m muối = 16,3 gam
Chọn C
Câu 24:
Nhiệt phân hoàn toàn 7,84 gam Cu(OH)2 thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Cu(OH)2 —> CuO + H2O
nCuO = nCu(OH)2 = 0,08 —> mCuO = 6,4 gam
Chọn B
Câu 25:
Số liên kết peptit trong phân tử Ala-Gly-Ala-Gly-Val là
 Xem đáp án
Xem đáp án
Peptit mạch hở Ala-Gly-Ala-Gly-Val có 5 mắt xích —> Có 4 liên kết peptit.
Chọn B
Câu 26:
Trong quá trình đốt than, sinh ra 1 khí X không màu, không mùi, rất độc. X là khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 27:
Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào mặt ngoài của vỏ tàu (phần ngâm dưới nước) những khối
 Xem đáp án
Xem đáp án
Để bảo vệ vỏ tàu biển làm bằng thép (thành phần chính là Fe) người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại Zn vì Zn có tính khử mạnh hơn Fe nên Zn là cực âm và bị ăn mòn, Fe là cực dương và được bảo vệ.
Chọn B
Câu 28:
Chất tham gia phản ứng trùng hợp tạo ra polime là
 Xem đáp án
Xem đáp án
Chất tham gia phản ứng trùng hợp tạo ra polime là CH2=CH-CH3:
nCH2=CH-CH3 —> (-CH2-CH(CH3)-)n
Chọn B
Câu 29:
Cho sơ đồ chuyển hoá:
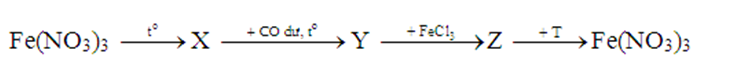
Các chất X và T lần lượt là
 Xem đáp án
Xem đáp án
Fe(NO3)3 —> Fe2O3 + NO2 + O2
Fe2O3 + CO dư —> Fe + CO2
Fe + FeCl3 —> FeCl2
FeCl2 + AgNO3 dư —> Fe(NO3)3 + AgCl + Ag
Các chất X và T lần lượt là Fe2O3 và AgNO3
Chọn C
Câu 30:
Cho 1 mol chất X (C9H8O4, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 2 mol chất Y, 1 mol chất Z và 1 mol H2O. Chất Z tác dụng với dung dịch H2SO4 loãng thu được chất hữu cơ T. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
X là H-COO-C6H4-CH2-OOC-H (o, m, p)
Y là HCOONa
Z là NaO-C6H4-CH2OH
T là HO-C6H4-CH2OH
A. Sai: HO-C6H4-CH2OH + NaOH —> NaO-C6H4-CH2OH + H2O
B. Đúng, Y có dạng NaO-CHO nên có tráng bạc.
C. Đúng
D. Đúng: H-COO-C6H4-CH2-OOC-H + 3NaOH —> 2HCOONa + NaO-C6H4-CH2OH + H2O
Chọn A
Câu 31:
Nhiệt phân hoàn toàn m gam hỗn hợp KNO3, Fe(NO3)2, Cu(NO3)2 trong đó số mol Cu(NO3)2 gấp đôi số mol Fe(NO3)2 trong điều kiện không có oxi, sau phản ứng thu được V lít hỗn hợp khí (đktc). Cho V lít hỗn hợp khí trên vào nước thu được 1,2 lít dung dịch Y có pH = 1 (trong Y chỉ chứa 1 chất tan duy nhất), không có khí bay ra. Giá trị của m là
 Xem đáp án
Xem đáp án
pH = 1 —> [H+] = 0,1 —> nH+ = 0,12
nFe(NO3)2 = x —> nCu(NO3)2 = 2x
Bảo toàn N —> nHNO3 = 2x + 2.2x = 0,12 —> x = 0,02
Bảo toàn electron: 2nKNO3 = nFe(NO3)2
—> nKNO3 = 0,01
—> m = 12,13 gam
Chọn A
Câu 32:
Hỗn hợp E gồm chất X (CnH2n+4O4N2) và chất Y (CmH2m+3O2N) đều là các muối amoni của axit cacboxylic với amin. Cho 0,12 mol E tác dụng vừa đủ với dung dịch chứa 0,19 mol NaOH, đun nóng, thu được sản phẩm hữu cơ gồm 18,24 gam một muối và 7,15 gam hỗn hợp hai amin. Phần trăm khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
nE = nX + nY = 0,12
nNaOH = 2nX + nY = 0,19
—> nX = 0,07; nY = 0,05
Theo chất Y thì muối hữu cơ duy nhất sẽ đơn chức.
—> n muối = nNaOH = 0,19 —> M muối = 96
Muối là C2H5COONa.
—> X dạng (C2H5COONH3)2A và Y là C2H5COONH3B
—> Amin gồm A(NH2)2 (0,07) và BNH2 (0,05)
mAmin = 0,07(A + 32) + 0,05(B + 16) = 7,15
—> 7A + 5B = 411
—> A = 28; B = 43 là nghiệm duy nhất.
X là (C2H5COONH3)2C2H4 và Y là C2H5COONH3C3H7
—> %Y = 31,35%
Chọn A
Câu 33:
Thực hiện các thí nghiệm sau:
(a) Cho Mg dư vào dung dịch FeCl3.
(b) Đốt dây Fe trong khí clo dư.
(c) Cho bột Fe3O4 vào dung dịch H2SO4 đặc, nóng, dư.
(d) Cho Fe vào dung dịch AgNO3 dư.
(e) Cho bột Fe dư vào dung dịch HNO3 loãng.
(f) Cho bột FeO vào dung dịch KHSO4.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được muối sắt (II) là
 Xem đáp án
Xem đáp án
(a) Mg dư + FeCl3 —> Fe + MgCl2
(b) Fe + Cl2 —> FeCl3
(c) Fe3O4 + H2SO4 đặc nóng —> Fe2(SO4)3 + SO2 + H2O
(d) Fe + AgNO3 dư —> Fe(NO3)3 + Ag
(e) Fe dư + HNO3 loãng —> Fe(NO3)2 + NO + H2O
(f) FeO + KHSO4 —> FeSO4 + K2SO4 + H2O
Chọn D
Câu 34:
Nung hỗn hợp X gồm: metan, etilen, propin, vinylaxetilen và a mol H2 có Ni xúc tác (chỉ xảy ra phản ứng cộng H2) thu được 0,1 mol hỗn hợp Y (gồm các hidrocacbon) có tỷ khối so với H2 là 14,4. Biết 0,1 mol Y phản ứng tối đa với 0,06 mol Br2 trong dung dịch. Giá trị của a là:
 Xem đáp án
Xem đáp án
Y có dạng CnH2n+2-2k với k = nBr2/nY = 0,6
MY = 14n + 2 – 2k = 14,4.2
—> n = 2
—> Y là C2H4,8
Phản ứng cộng H2 không làm thay đổi số C nên các hiđrocacbon trong X có dạng C2H4.
C2H4 + 0,4H2 —> C2H4,8
—> nH2 = 0,4nY = 0,04
Chọn C
Câu 35:
Cho các phát biểu sau:
(a) Tơ nilon-6,6 có thể điều chế bằng phản ứng trùng hợp hoặc trùng ngưng.
(b) Thủy tinh hữu cơ được ứng dụng làm cửa kính phương tiện giao thông
(c) Trong tinh bột amilozơ thường chiếm tỉ lệ cao hơn amilopectin.
(d) Nhỏ dung dịch I2 vào lát cắt của củ khoai lang thì xuất hiện màu xanh tím.
(e) Oligopeptit gồm các peptit có từ 2 đến 10 liên kết peptit trong phân tử.
(f) Sau khi lưu hóa cao su chịu nhiệt và đàn hồi tốt hơn.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, tơ nilon-6,6 chỉ điều chế bằng phản ứng đồng trùng ngưng hexametylenđiamin và axit adipic.
(b) Đúng
(c) Sai, amilozơ chiếm tỉ lệ thấp hơn (20% đến 30% khối lượng tinh bột, còn lại là amilopectin).
(d) Đúng, khoai lang chứa tinh bột nên có phản ứng màu với I2.
(e) Sai, oligopeptit có từ 2 đến 10 gốc α-amino axit trong phân tử.
(f) Đúng
Chọn C
Câu 36:
Trong số các tơ sau: tơ nitron; tơ visco; tơ tằm; tơ nilon-6,6; tơ capron. Có bao nhiêu tơ thuộc loại tơ hóa học?
 Xem đáp án
Xem đáp án
Các tơ thuộc loại tơ hóa học trong dãy: tơ nitron; tơ visco; tơ nilon-6,6; tơ capron.
Tơ tằm thuộc loại tơ thiên nhiên.
Chọn D
Câu 37:
Tiến hành điện phân dung dịch chứa m gam hỗn hợp CuSO4 xM và NaCl yM với điện cực trơ, có màng ngăn, cường độ dòng điện không đổi thu được kết quả như bảng sau:
|
Thời gian điện phân (giây) |
Thể tích khí thoát ra (lít) |
Ghi chú |
|
t |
V |
Chỉ có 1 khí thoát ra |
|
1,5t |
1,35V |
Thu được hỗn hợp 2 khí |
|
2t |
1,8V |
|
Tỉ lệ x : y là
 Xem đáp án
Xem đáp án
Tự chọn V lít khí ứng với 1 mol khí.
Trong t giây: nCl2 = 1 —> ne = 2
Trong 1,5t giây (ne = 3), nếu anot chỉ thoát khí Cl2 thì nCl2 = 1,5 > 1,35: Vô lý. Vậy trong 1,5t giây anot có Cl2 (u) và O2 (v)
—> u + v = 1,35 và 2u + 4v = 3
—> u = 1,2; v = 0,15
Trong 2t giây (ne = 4), tại anot: nCl2 = 1,2 —> nO2 = 0,4
—> nH2 = 1,8 – 1,2 – 0,4 = 0,2
Bảo toàn electron cho catot —> nCu = 1,8
Bảo toàn Cu và Cl —> nCuSO4 = 1,8 và nNaCl = 2,4
Tỉ lệ nồng độ cũng là tỉ lệ mol nên: x : y = 1,8 : 2,4 = 3 : 4
Chọn C
Câu 38:
Hỗn hợp X gồm một este đơn chức và một este hai chức, trong phân tử mỗi este đều chứa vòng benzen và chỉ chứa một loại nhóm chức. Đun nóng 0,1 mol X cần dùng tối đa 12,4 gam NaOH trong dung dịch, chưng cất dung dịch sau phản ứng thu được một ancol Y duy nhất và hỗn hợp Z gồm các muối. Đốt cháy hoàn toàn Z cần dùng 1,105 mol O2, thu được Na2CO3 và 1,31 mol hỗn hợp gồm CO2 và H2O. Dẫn toàn bộ Y qua bình đựng Na dư thấy khối lượng bình tăng 3,21 gam. Số nguyên tử hiđro trong este đơn chức là
 Xem đáp án
Xem đáp án
nNaOH = 0,31
nNaOH/nEste = 3,1 nên phải có 1 este phản ứng với trên 3,1NaOH.
Sản phẩm có 1 ancol nên X gồm ACOOR (x mol) và B(COOP) (y mol, với -P là gốc phenol)
—> x + y = 0,1 và x + 4y = 0,31
—> x = 0,03; y = 0,07
Muối gồm ACOONa (0,03), B(COONa)2 (0,07) và PONa (0,14)
Đốt muối —> Na2CO3 (0,155), CO2 (u mol) và H2O (v mol)
—> u + v = 1,31
Bảo toàn O —> 2u + v + 0,155.3 = 1,105.2 + 0,03.2 + 0,07.4 + 0,14
—> u = 0,915 và v = 0,395
Bảo toàn khối lượng —> m muối = 28,44
⇔ 0,03(A + 67) + 0,07(B + 134) + 0,14(P + 39) = 28,44
—> 3A + 7B + 14P = 1159
Với A ≥ 1, B ≥ 0 và P ≥ 77 —> A = 27; B = 0, P = 77 là nghiệm duy nhất.
Muối gồm C2H3COONa (0,03), (COONa)2 (0,07) và C6H5ONa (0,14)
nROH = x = 0,03 —> m tăng = 0,03(R + 16) = 3,21
—> R = 91: C6H5-CH2-
Este gồm C2H3COO-CH2-C6H5 và (COOC6H5)2
—> Este đơn có 10H
Chọn A
Câu 39:
Cho 7,488 gam hỗn hợp rắn X gồm Fe, Fe3O4 và Fe(NO3)2 vào dung dịch chứa 0,3 mol HCl và 0,024 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa NH4+) và 0,032 mol hỗn hợp khí Z gồm NO và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, sau phản ứng thấy thoát ra 0,009 mol NO (sản phẩm khử duy nhất của N+5), đồng thời thu được 44,022 gam kết tủa. Phần trăm khối lượng Fe trong hỗn hợp X có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Thêm AgNO3 vào Y thấy xuất hiện khí NO chứng tỏ Y chứa Fe2+, H+ dư và không có NO3-.
nAgCl = 0,3 —> nAg = 0,009
Bảo toàn electron: nFe2+ = 3nNO + nAg = 0,036
nH+ dư = 4nNO = 0,036
Dung dịch Y chứa Fe2+ (0,036), H+ dư (0,036), Cl- (0,3), bảo toàn điện tích —> nFe3+ = 0,064.
Ban đầu đặt a, b, c là số mol Fe, Fe3O4 và Fe(NO3)2
mX = 56a + 232b + 180c = 7,488 (1)
nFe = a + 3b + c = 0,036 + 0,064 (2)
nH+ phản ứng = 0,3 + 0,024 – 0,036 = 0,288
—> nH2O = 0,144
Bảo toàn O —> 4b + 6c + 0,024.3 = 0,032 + 0,144 (3)
(1)(2)(3) —> a = 0,05; b = 0,014; c = 0,008
—> %Fe = 37,39%
Chọn B
Câu 40:
Thực hiện phản ứng điều chế isoamyl axetat (dầu chuối) theo trình tự sau:
- Bước 1: Cho 2 ml ancol isoamylic, 2 ml axit axetic nguyên chất và 2 giọt axit sunfuric đặc vào ống nghiệm khô.
- Bước 2: Lắc đều, đun cách thủy hỗn hợp 8-10 phút trong nồi nước sôi.
- Bước 3: Để nguội, rồi rót hỗn hợp sản phẩm vào ống nghiệm chứa 3 – 4 ml nước lạnh.
Cho các phát biểu sau:
(a) Phản ứng este hóa giữa ancol isomylic với axit axetic là phản ứng một chiều.
(b) Việc cho hỗn hợp sản phẩm vào nước lạnh nhằm tránh sự thủy phân.
(c) Sau bước 3, hỗn hợp thu được tách thành 3 lớp.
(d) Tách isoamyl axetat từ hỗn hợp sau bước 3 bằng phương pháp chiết.
(e) Ở bước 2 xảy ra phản ứng este hóa, giải phóng hơi có mùi thơm của chuối chín.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Sai, phản ứng este hóa giữa ancol isomylic với axit axetic là phản ứng thuận nghịch vì trong cùng điều kiện phản ứng, este isoamyl axetat bị thủy phân tạo lại axit, ancol ban đầu.
(b) Sai, thêm nước lạnh để tăng tỉ khối hỗn hợp giúp isoamyl axetat tách ra dễ dàng hơn.
(c) Sai, tách thành 2 lớp, isoamyl axetat ở phía trên, tất cả các chất còn lại ở phía dưới.
(d) Đúng, isoamyl axetat là chất lỏng không tan nên tách bằng cách chiết
(e) Đúng, isoamyl axetat có mùi thơm của chuối chín.
Chọn A
