Thi Online (2023) Đề thi thử Hóa THPT Tây Tiền Hải, Thái Bình (Lần 1) có đáp án
Thi Online (2023) Đề thi thử Hóa THPT Tây Tiền Hải, Thái Bình (Lần 1) có đáp án
-
572 lượt thi
-
40 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 2:
Tính chất nào sau đây của kim loại không phải do các electron tự do gây ra?
 Xem đáp án
Xem đáp án
Chọn A
Câu 3:
X là loại đường có nhiều trong quả nho chín. Số nguyên tử H trong phân tử X là?
 Xem đáp án
Xem đáp án
Chọn B
Câu 4:
Mùa lạnh, đưa lò than vào trong phòng kín dễ gây ngạt thở. Nguyên nhân gây ngạt thở nhanh là do khí nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 8:
Để bảo vệ vỏ tàu biển bằng thép bằng phương pháp điện hoá, người ta gắn vào mặt ngoài của vỏ tàu (phần chìm dưới nước) những khối kim loại X. Kết quả kim loại X bị nước biển ăn mòn thay cho thép. Kim loại X là
 Xem đáp án
Xem đáp án
Để bảo vệ vỏ tàu biển làm bằng thép (thành phần chính là Fe) người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại Zn vì Zn có tính khử mạnh hơn Fe nên Zn là cực âm và bị ăn mòn, Fe là cực dương và được bảo vệ.
Câu 9:
Cho dãy các hóa chất sau: NaOH, Ca(OH)2, Na2CO3, Na3PO4, HCl. Số hóa chất trong dãy có thể làm mềm được nước cứng tạm thời là
 Xem đáp án
Xem đáp án
Các chất làm mềm nước cứng tạm thời: NaOH, Ca(OH)2 (vừa đủ), Na2CO3, Na3PO4.
M2+ + OH- + HCO3- → MCO3 + H2O
M2+ + CO32- → MCO3
M2+ + PO43- → M3(PO4)2
(M2+ là Mg2+, Ca2+)Câu 12:
Trong điều kiện không có oxi, sắt phản ứng với lượng dư dung dịch nào sau đây tạo muối sắt (II)?
 Xem đáp án
Xem đáp án
A. Fe + FeCl3 dư → FeCl2
B. Fe + H2SO4 đặc, nóng, dư → Fe2(SO4)3 + SO2 + H2O
C. Fe + HNO3 đặc, nóng, dư → Fe(NO3)3 + NO2 + H2O
D. Fe + AgNO3 dư → Fe(NO3)3 + Ag
Câu 13:
Thí nghiệm nào sau đây không có khí thoát ra?
 Xem đáp án
Xem đáp án
A. Al + NaHSO4 → Na2SO4 + Al2(SO4)3 + H2
B. CaCO3 + HCl → CaCl2 + CO2 + H2O
C. Na2SO4 + BaCl2 → BaSO4 + NaCl
D. Cu + H+ + NO3- → Cu2+ + NO + H2O
Câu 15:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng, các kim loại kiềm có khối lượng riêng nhỏ hơn 5 gam/cm³ nên đều là kim loại nhẹ.
B. Đúng
C. Sai, Na khử H2O trước:
Na + H2O → NaOH + H2
NaOH + FeSO4 → Fe(OH)2 + Na2SO4
D. Đúng, dầu hỏa không tác dụng với kim loại kiềm và ngăn kim loại kiềm tiếp xúc với môi trường bên ngoài.
Câu 16:
Thủy phân hoàn toàn m gam saccarozơ thu được dung dịch X, trung hòa X rồi cho phản ứng với dung dịch AgNO3 trong NH3 thu được 54 gam Ag. Biết các phản ứng xảy ra hoàn toàn, giá trị của m là
 Xem đáp án
Xem đáp án
Saccarozơ → Glucozơ + Fructozơ → 4Ag
nAg = 0,5 → nC12H22O11 = 0,125 → m = 42,75 gam
Câu 19:
Cho 9,0 gam amin X (no, đơn chức, mạch hở) tác dụng vừa đủ với dung dịch HCl thu được 16,3 gam muối. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
nX = nHCl = (m muối – mX)/36,5 =0,2
→ MX = 45: C2H7N
Câu 20:
Cho sơ đồ chuyển hoá:
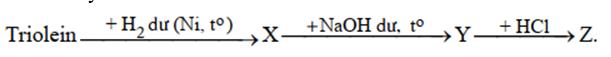
Tên của Z là
 Xem đáp án
Xem đáp án
(C17H33COO)3C3H5 + 3H2 → (C17H35COO)3C3H5
(C17H33COO)3C3H5 + 3NaOH → 3C17H35COONa + C3H5(OH)3
C17H35COONa + HCl → C17H35COOH + NaCl
→ Z là axit stearic.
Câu 21:
Cho một đinh sắt sạch vào 150 ml dung dịch CuSO4 1,0M. Sau khi phản ứng hoàn toàn, khối lượng đinh sắt tăng m gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Fe + CuSO4 → Cu + FeSO4
→ nFe phản ứng = nCu = nCuSO4 = 0,15
Δm = 0,15.64 – 0,15.56 = 1,2 → Đinh sắt tăng 1,2 gam.
Câu 22:
Xà phòng hóa hoàn toàn 7,4 gam HCOOC2H5 bằng một lượng dung dịch NaOH vừa đủ. Cô cạn dung dịch sau phản ứng, thu được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
HCOOC2H5 + NaOH → HCOONa + C2H5OH
nHCOONa = nHCOOC2H5 = 0,1 mol
→ mHCOONa = 6,8 gam
Câu 23:
Để phân biệt glixerol và ancol etylic, ta có thể dùng hóa chất nào sau đây
 Xem đáp án
Xem đáp án
Để phân biệt glixerol và ancol etylic, ta có thể dùng Cu(OH)2, khi đó glyxerol (C3H5(OH)3) hòa tan Cu(OH)2 tạo phức màu xanh lam, ancol etylic (C2H5OH) không có phản ứng gì.
Câu 24:
Protein là cơ sở tạo nên sự sống vì có trong thành phần chính của nhân tế bào và nguyên sinh chất. Protein cũng là hợp phần chủ yếu trong thức ăn của con người. Trong phân tử protein, các gốc α-aminoaxit được gắn với nhau bằng liên kết nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
Câu 25:
Cho khí CO dư phản ứng hoàn toàn với 32 gam hỗn hợp Fe2O3 và CuO, thu được m gam chất rắn và 0,5 mol CO2. Giá trị của m là
 Xem đáp án
Xem đáp án
nO bị lấy = nCO2 = 0,5
→ m rắn = 32 – 0,5.16 = 24 gam
Câu 26:
Cặp chất nào sau đây là đồng phân của nhau?
 Xem đáp án
Xem đáp án
Cặp glucozơ và fructozơ là đồng phân của nhau vì chúng có cùng công thức phân tử là C6H12O6.
Câu 27:
Có mấy amioaxit có công thức phân tử là C3H7O2N?
 Xem đáp án
Xem đáp án
Các amioaxit có công thức phân tử là C3H7O2N:
H2N-CH2-CH2-COOH
CH3-CH(NH2)-COOH
Câu 28:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Sai, dùng poli(metyl metacrylat) để chế tạo kính cường lực.
B. Sai, đồng trùng hợp stiren với butadien thu được cao su Buna-S.
C. Đúng
D. Sai, tơ visco là tơ nhân tạo.
Câu 29:
Cho các chất: NaOH, Cu, HCl, HNO3, AgNO3, Mg. Số chất phản ứng được với dung dịch Fe(NO3)2 là
 Xem đáp án
Xem đáp án
Các chất NaOH, HCl, HNO3, AgNO3, Mg có phản ứng với Fe(NO3)2:
2OH- + Fe2+ → Fe(OH)2
Fe2+ + H+ + NO3- → Fe3+ + NO + H2O (Chung cho HCl và HNO3)
Ag+ + Fe2+ → Ag + Fe3+
Mg + Fe2+ → Mg2+ + Fe
Câu 30:
Thực hiện các phản ứng sau:
(1) X + CO2 → Y (2) 2X + CO2 → Z + H2O
(3) Y + T → Q + X + H2O (4) 2Y + T → Q + Z + H2O
Hai chất X, Q tương ứng là :
 Xem đáp án
Xem đáp án
X, T là NaOH, Ca(OH)2
(1) NaOH + CO2 → NaHCO3
(2) 2NaOH + CO2 → Na2CO3 + H2O
(3) NaHCO3 + Ca(OH)2 → CaCO3 + NaOH + H2O
(4) 2NaHCO3 + Ca(OH)2 → CaCO3 + Na2CO3 + H2O
Câu 31:
Cho các phát biểu sau:
(a) Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng %P2O5.
(b) Điện phân NaCl nóng chảy, thu được khí clo ở anot.
(c) Nhúng thanh Zn vào dung dịch chứa CuSO4 và H2SO4, có xuất hiện ăn mòn điện hóa.
(d) Kim loại dẫn điện tốt nhất là Au.
(e) Có thể dùng giấm ăn để làm tan cặn trong phích hoặc ấm đun nước.
Số phát biểu đúng là :
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Đúng: NaCl → Na (catot) + Cl2 (anot)
(c) Đúng: Zn + CuSO4 → Cu + ZnSO4
Cu bám vào Zn tạo cặp điện cực Zn-Cu cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hóa.
(d) Sai, kim loại dẫn điện tốt nhất là Ag.
(e) Đúng:
CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
Câu 32:
Cho các phát biểu sau:
(a) Glucozơ được dùng để tráng gương, tráng ruột phích, làm thuốc tăng lực.
(b) Thành phần chính của cồn 75° mà trong y tế thường dùng để sát trùng là metanol.
(c) Để ủ hoa quả nhanh chín và an toàn hơn, có thể thay thế C2H2 bằng C2H4.
(d) Thủy phân triolein, thu được etylen glicol.
(e) Axit glutamic là thuốc ngăn ngừa và chữa trị các triệu chứng suy nhược thần kinh (mất ngủ, nhức đầu, ù tai, chóng mặt,. )
(f) Tơ nilon-6,6 được trùng hợp bởi hexametylenđiamin và axit ađipic.
Số phát biểu sai là:
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, thành phần chính là etanol (chiếm 75% thể tích).
(c) Đúng, C2H2 thường tạo ra từ đất đèn, có lẫn nhiều tạp chất sinh ra các khí độc hại nên dùng C2H4 sẽ tốt hơn.
(d) Sai, thủy phân triolein thu được glyxerol
(e) Đúng
(f) Sai, tơ nilon-6,6 được điều chế từ trùng ngưng.
Câu 33:
Một loại phân bón hỗn hợp trên bao bì ghi tỉ lệ 10 – 20 – 15. Các con số này chính là độ dinh dưỡng của phân đạm, lân, kaili tương ứng. Để sản xuất loại phân bón này, nhà máy Z trộn ba loại hoá chất Ca(NO3)2, KH2PO4, KNO3 với nhau. Trong phân bón đó tỉ lệ khối lượng của Ca(NO3)2 là a%; của KH2PO4 là b%. Giả sử các tạp chất không chứa N, P, K. Giá trị của (a + b) gần nhất với
 Xem đáp án
Xem đáp án
Lấy 100 gam phân, trong đó có Ca(NO3)2 (x mol), KH2PO4 (y mol), KNO3 (z mol gam) và tạp chất.
mN = 10 = 14(2x + z)
mP2O5 = 20 = 142y/2
mK2O = 15 = 94(y + z)/2
→ x = 0,3384; y = 0,2817; z = 0,0375
→ a + b = 164x + 136y = 93,81
Câu 34:
Xà phòng hóa hoàn toàn m gam hỗn hợp E gồm các triglixerit bằng dung dịch NaOH, thu được glixerol và hỗn hợp X gồm ba muối C17HxCOONa, C15H31COONa, C17HyCOONa có tỉ lệ mol tương ứng là 3 : 4 : 5. Hiđro hóa hoàn toàn m gam E, thu được 68,96 gam hỗn hợp Y. Nếu đốt cháy hoàn toàn m gam E thì cần vừa đủ 6,14 mol O2. Giá trị của m là
 Xem đáp án
Xem đáp án
C trung bình của muối = (18.3 + 16.4 + 18.5)/(3 + 4 + 5) = 52/3
→ C trung bình của E = 3.52/3 + 3 = 55
Quy đổi E thành (HCOO)3C3H5 (a), CH2 (49a) và H2 (-b) (Tính nCH2 = 55a – 6a)
mY = 176a + 14.49a = 68,96
nO2 = 5a + 1,5.49a – 0,5b = 6,14
→ a = 0,08; b = 0,28
→ mE = 68,40 gam
Câu 35:
Cho các phản ứng xảy ra theo đúng tỉ lệ số mol như sau:
(1) X + 2NaOH → X1 + X2 + X3
(2) X1 + HCl → X4 + NaCl
(3) X4 + 2AgNO3 + 4NH3 + 2H2O → X6 + 2NH4NO3 + 2Ag
(4) X2 + HCl → X5 + NaCl
(5) X3 + CO → X5
Biết X có công thức phân tử C6H8O4, và chứa 2 chức este. Cho các phát biểu sau:
(a) X4 là hợp chất hữu cơ đa chức.
(b) Phân tử khối của X6 là 138.
(c) X3 là hợp chất anđehit.
(d) Dung dịch X2 làm quỳ tím hoá xanh.
(đ) Nhiệt độ sôi của X3 cao hơn nhiệt độ sôi của X5
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
(5) → X3 là CH3OH; X5 là CH3COOH
(4) → X2 là CH3COONa
X là CH3COO-CH=CH-COO-CH3
X1 là OHC-CH2-COONa
X4 là OHC-CH2-COOH
X6 là CH2(COONH4)2
(a) Sai, X4 là chất tạp chức.
(b) Đúng
(c) Sai, X3 là ancol
(d) Đúng, CH3COO- bị thủy phân tạo môi trường kiềm nên dung dịch CH3COONa làm quỳ tím hoá xanh.
(đ) Sai, X3 có phân tử khối nhỏ hơn và liên kết H kém bền hơn X5 nên nhiệt độ sôi của X3 thấp hơn nhiệt độ sôi của X5.
Câu 36:
Nhiệt lượng toả ra khi đốt cháy 1,0 gam than là 23,0 kJ. Cần phải đốt m gam than để làm nóng 2070 gam H2O từ 20°C lên 90°C. Biết để làm nóng 1,0 mol H2O thêm 1,0°C cần một nhiệt lượng là 75,4 J và hiệu suất sử dụng nhiệt là 75%. Giá trị của m là.
 Xem đáp án
Xem đáp án
nH2O = 115; m than = x gam
Bảo toàn năng lượng:
75%.23000x = 115.75,4.(90 – 20) → x = 35,19 gam
Câu 37:
Tiến hành điện phân dung dịch chứa m gam hỗn hợp muối CuSO4 và NaCl bằng dòng điện một chiều có cường độ 2A (với điện cực trơ, có màng ngăn xốp). Kết quả thí nghiệm được ghi trong bảng sau:
|
Thời gian điện phân (giây) |
t |
t + 3377,5 |
2t |
|
Lượng khí sinh ra từ bình điện phân (mol) |
x |
x + 0,035 |
2,0625x |
|
Lượng kim loại Cu sinh ra ở catot (mol) |
y |
y + 0,025 |
y + 0,025 |
Giả sử hiệu suất điện phân 100%, các khí sinh ra không tan trong dung dịch. Giá trị của m gần nhất với:
 Xem đáp án
Xem đáp án
Trong khoảng thời gian 3377,5 tính từ t đến t + 3377,5 thì ne = 2.3377,5/F = 0,07
nCu = 0,025 → nH2 = 0,01
nCl2 = u, nO2 = v → u + v + 0,01 = 0,035
và 2u + 4v = 0,07
→ u = 0,015; v = 0,01
Trong t giây đầu chỉ thoát Cu và Cl2 nên x = y
ne trong t giây = 2x → ne trong 2t giây = 4x
Sau 2t giây:
Catot: nCu = x + 0,025 → nH2 = x – 0,025
Anot: nCl2 = x + 0,015 → nO2 = 0,5x – 0,0075
n khí tổng = (x – 0,025) + (x + 0,015) + (0,5x – 0,0075) = 2,0625x
→ x = 0,04
nCuSO4 = x + 0,025 = 0,065
nNaCl = 2(x + 0,015) = 0,11
→ m = 16,835
Câu 38:
Đốt cháy m gam hỗn hợp Mg, Fe trong oxi một thời gian, thu được (m + 4,16) gam hỗn hợp X chứa các oxit. Hòa tan hoàn toàn hỗn hợp X bằng dung dịch HCl vừa đủ, thu được dung dịch Y chứa (3m + 1,82) gam muối. Cho AgNO3 dư vào dung dịch Y thấy tạo (9m + 4,06) gam kết tủa. Mặt khác, hòa tan hết 3,75m gam hỗn hợp X bằng dung dịch HNO3 loãng (dư), thu được dung dịch Z chứa m' gam muối nitrat kim loại. Giá trị của m' là:
 Xem đáp án
Xem đáp án
nO = 4,16/16 = 0,26 → nH2O = 0,26 và nHCl = 0,52
Bảo toàn khối lượng:
m + 4,16 + 0,52.36,5 = 3m + 1,82 + 0,26.18
→ m = 8,32
nAgCl = nHCl = 0,52
m↓ = 9m + 4,06 = 78,94
→ nAg = 0,04 → nFe2+ = 0,04
Dung dịch Y chứa Mg2+ (a), Fe3+ (b), Fe2+ (0,04) và Cl- (0,52)
Bảo toàn điện tích → 2a + 3b + 0,04.2 = 0,52
m kim loại = 24a + 56(b + 0,04) = 8,32
→ a = 0,16 và b = 0,04
mX = m + 4,16 = 12,48
Nếu cho 12,48 gam X vào HNO3 dư thì thu được Mg(NO3)2 (0,16) và Fe(NO3)3 (0,08)
→ m muối = 43,04
→ Nếu cho 3,75m = 31,2 gam X vào HNO3 dư thì thu được m muối = 31,2.43,04/12,48 = 107,6 gam
Câu 39:
Hỗn hợp T gồm ba este mạch hở X (đơn chức), Y (hai chức), Z (ba chức) đều được tạo thành từ axit cacboxylic và ancol. Đốt cháy hoàn toàn m gam T, thu được H2O và 1,0 mol CO2. Xà phòng hóa hoàn toàn m gam T bằng dung dịch NaOH vừa đủ, thu được hỗn hợp E gồm hai ancol (có cùng số nguyên tử cacbon trong phân tử) và 26,96 gam hỗn hợp muối F. Cho E tác dụng hết với kim loại Na dư, thu được 0,2 mol H2. Đốt cháy toàn bộ F, thu được H2O, Na2CO3 và 0,2 mol CO2. Khối lượng của Y trong m gam T là
 Xem đáp án
Xem đáp án
nH2 = 0,2 → nNaOH = nO(E) = 0,4
→ nNa2CO3 = 0,2
nC(F) = nNa2CO3 + nCO2 = 0,4
Dễ thấy nC(F) = nNa(F) nên F gồm HCOONa (0,16) và (COONa)2 (0,12)
nC(Ancol) = 1 – nC(F) = 0,6
E chứa 2 ancol cùng C → Số C ≥ 2
nE > 0,4/3 = 0,1333 → Số C < 0,6/0,1333 = 4,5
→ Ancol cùng 2C, 3C hoặc 4C.
Xét ancol gồm C2H5OH (0,2) và C2H4(OH)2 (0,1)
X là HCOOC2H5 (x mol)
n(COONa)2 > nC2H4(OH)2 nên Y là (COOC2H5)2 (y mol)
Z là HCOO-CH2-CH2-OOC-COO-C2H5 (z mol)
nC2H5OH = x + 2y + z = 0,2
nHCOONa = x + z = 0,16
n(COONa)2 = y + z = 0,12
→ x = 0,06; y = 0,02; z = 0,1
→ mY = 2,92
Câu 40:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho 1 ml dung dịch AgNO3 1% vào ống nghiệm sạch.
Bước 2: Thêm từ từ từng giọt dung dịch NH3, lắc đều cho đến khi kết tủa tan hết.
Bước 3: Thêm tiếp khoảng 1 ml dung dịch glucozơ 1% vào ống nghiệm; đun nóng nhẹ.
Cho các phát biểu sau:
(a) Sản phẩm hữu cơ thu được sau bước 3 là amoni gluconat.
(b) Sau bước 3, có lớp bạc kim loại bám trên thành ống nghiệm.
(c) Ở bước 3, có thể thay việc đun nóng nhẹ bằng cách ngâm ống nghiệm trong nước nóng.
(d) Thí nghiệm trên chứng minh glucozơ có tính chất của anđehit.
(e) Ở thí nghiệm trên, nếu thay dung dịch glucozơ bằng dung dịch saccarozơ thì hiện tượng tương tự.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng, sản phẩm là CH2OH-(CHOH)4-COONH4 amoni gluconat)
(b) Đúng, glucozơ khử Ag+ thành Ag bám trên thành ống nghiệm.
(c) Đúng
(d) Đúng
(e) Sai, saccarozơ không có phản ứng tráng gương nên không có hiện tượng gì.
