(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Vĩnh Phúc (Lần 2) có đáp án
(2023) Đề thi thử Hóa học Sở giáo dục và đào tạo Vĩnh Phúc (Lần 2) có đáp án
-
211 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Khử hoàn toàn m gam hỗn hợp X gồm CuO, Fe2O3 cần dùng vừa đủ 4,48 lít CO (đktc). Mặt khác, để hòa tan hết X cần vừa đủ V ml dung dịch HCl 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
nO(X) = nCO = 0,2
→ nH2O = nO(X) = 0,2
→ nHCl = 2nH2O = 0,4
→ V = 400
Chọn C
Câu 4:
Thủy phân 68,4 gam saccarozơ trong môi trường axit với hiệu suất 92%, sau phản ứng thu được dung dịch chứa m gam glucozơ. Giá trị của m là
 Xem đáp án
Xem đáp án
Saccarozơ → Glucozơ + Fructozơ
0,2…………….0,2
→ mC6H12O6 = 0,2.92%.180 = 33,12 gam
Chọn D
Câu 5:
Trong điều kiện không có oxi, sắt phản ứng với chất nào sau đây sinh ra muối sắt(II)?
 Xem đáp án
Xem đáp án
Chọn A
Câu 6:
Cho kim loại Fe vào dung dịch nào sau đây thì xảy ra ăn mòn điện hóa học?
 Xem đáp án
Xem đáp án
Cho kim loại Fe vào dung dịch Cu(NO3)2 thì xảy ra ăn mòn điện hóa học:
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Cu sinh ra bám vào Fe tạo cặp điện cực Fe-Cu tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hóa học.
Chọn D
Câu 8:
Dung dịch chất nào sau đây hòa tan được Al2O3?
 Xem đáp án
Xem đáp án
Dung dịch H2SO4 hòa tan được Al2O3:
Al2O3 + H2SO4 → Al2(SO4)3 + H2O
Chọn B
Câu 9:
Kim loại nào sau đây tan hết trong dung dịch NaOH dư ở điều kiện thường?
 Xem đáp án
Xem đáp án
Kim loại Al tan hết trong dung dịch NaOH dư ở điều kiện thường:
Al + H2O + NaOH → NaAlO2 + H2
Chọn D
Câu 10:
Ở nhiệt độ thường, lưu huỳnh phản ứng được với kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Ở nhiệt độ thường, lưu huỳnh phản ứng được với kim loại Hg:
Hg + S → HgS
Chọn B
Câu 13:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
D sai, tơ poliamit kém bền trong môi trường kiềm hoặc axit do có nhóm amit dễ bị thủy phân.
Chọn D
Câu 14:
Khí thải của một nhà máy chế biến thức ăn gia súc có mùi trứng thối. Sục khí thải đó qua dung dịch Pb(NO3)2 thấy xuất hiện kết tủa màu đen. Điều này chứng tỏ khí thải có chứa khí
 Xem đáp án
Xem đáp án
Khí thải có chứa khí H2S:
H2S + Pb(NO3)2 → PbS (đen) + HNO3
Chọn B
Câu 19:
Điện phân nóng chảy NaCl, ở anot thu được chất nào sau đây?
 Xem đáp án
Xem đáp án
Điện phân nóng chảy NaCl, ở anot thu được Cl2:
NaCl → Na (catot) + Cl2 (anot)
Chọn B
Câu 21:
Cho X là chất không màu, dễ tan trong nước, kết tinh ở điều kiện thường, chất X là chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn C
Câu 23:
Trong công nghiệp, Al được sản xuất bằng phương pháp điện phân nóng chảy hợp chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Thực hiện các thí nghiệm sau:
(a) Cho AgNO3 dư vào dung dịch loãng chứa a mol Fe(NO3)2 và 2a mol HCl.
(b) Điện phân dung dịch CuSO4 bằng nguồn điện một chiều.
(c) Cho phân đạm ure vào dung dịch nước vôi trong dư.
(d) Cho dung dịch CaCl2 vào dung dịch NaHCO3.
(e) Cho từ từ H2SO4 vào dung dịch chứa Ba(HCO3)2.
Sau khi phản ứng xảy ra hoàn toàn, số thí nghiệm vừa thoát khí vừa tạo thành kết tủa là
 Xem đáp án
Xem đáp án
(a) Ag+ + Cl- → AgCl
Fe2+ + H+ + NO3- → Fe3+ + NO + H2O
Ag+ + Fe2+ → Fe3+ + Ag
(b) CuSO4 + H2O → Cu + O2 + H2SO4
(c) (NH2)2CO + Ca(OH)2 → CaCO3 + NH3
(d) Không phản ứng
(e) H2SO4 + Ba(HCO3)2 → BaSO4 + CO2 + H2O
Chọn C
Câu 26:
Cho 0,672 gam kim loại R (hóa trị II) tác dụng hết với dung dịch AgNO3 dư, thu được 2,268 gam Ag. Kim loại R là
 Xem đáp án
Xem đáp án
Chọn C
Câu 27:
Trung hòa 11,8 gam một amin đơn chức cần 200 ml dung dịch HCl 1M. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Chọn C
Câu 28:
Hỗn hợp E gồm Fe, Fe3O4, Fe2O3 và Fe(NO3)2. Nung 23,84 gam E trong môi trường trơ thu được chất rắn X (chỉ gồm Fe và các oxit) và 0,12 mol khí NO2. Hòa tan hết X trong dung dịch HCl nồng độ 3,65% thu được 672 ml khí H2 (đktc) và dung dịch Y chỉ chứa muối. Cho tiếp dung dịch AgNO3 dư vào Y thu được 102,3 gam kết tủa gồm Ag và AgCl. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của muối FeCl2 trong Y gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Y gồm FeCl2 (a), FeCl3 (b)
→ m↓ = 143,5(2a + 3b) + 108a = 102,3 (1)
nH2O = nO(X) = c
→ mE = 56(a + b) + 16c + 0,12.46 = 23,84 (2)
Bảo toàn electron: 3(a + b) = 2c + a + 0,03.2 (3)
(1)(2)(3) → a = 0,15; b = 0,1; c = 0,27
nHCl = 2nH2 + 2nH2O = 0,6
mddY = mX + mddHCl – mH2 = 618,26
→ C%FeCl2 = 3,08%
Chọn D
Câu 29:
Thủy phân 14,64 gam phenyl fomat trong dung dịch chứa 0,28 mol NaOH. Sau khi các phản ứng xảy ra hoàn toàn cô cạn dung dịch thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
HCOOC6H5 + 2NaOH → HCOONa + C6H5ONa + H2O
nHCOOC6H5 = 0,12; nNaOH = 0,28 → nH2O = 0,12
m rắn = mHCOOC6H5 + mNaOH – mH2O = 23,68 gam
Chọn A
Câu 30:
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong khí clo.
(2) Đốt nóng hỗn hợp bột Fe và S (trong điều kiện không có oxi).
(3) Cho FeO vào dung dịch HNO3 (loãng, dư).
(4) Cho Fe vào dung dịch Fe2(SO4)3.
(5) Cho Fe vào dung dịch H2SO4 (loãng, dư).
Có bao nhiêu thí nghiệm tạo ra muối sắt(II)?
 Xem đáp án
Xem đáp án
(1) Fe + Cl2 → FeCl3
(2) Fe + S → FeS
(3) FeO + HNO3 → Fe(NO3)3 + NO + H2O
(4) Fe + Fe2(SO4)3 → FeSO4
(5) Fe + H2SO4 loãng → FeSO4 + H2
Chọn D
Câu 31:
Một mẫu khí gas X chứa hỗn hợp propan và butan. Cho các phản ứng:
C3H8 + 5O2 → 3CO2 + 4H2O (1)
C4H10 + 6,5O2 → 4CO2 + 5H2O (2)
Nhiệt tỏa ra của phản ứng (1) là 2220 kJ/mol, nhiệt lượng tỏa ra của phản ứng (2) là 2874 kJ/mol. Đốt cháy hoàn toàn 12 gam X tỏa ra nhiệt lượng 597,6 kJ. Tỉ lệ số mol của propan và butan trong X là
 Xem đáp án
Xem đáp án
12 gam X chứa C3H8 (x) và C4H10 (y)
mX = 44x + 58y = 12
Q = 2220x + 2874y = 597,6
→ x = 0,075; y = 0,15
→ x : y = 1 : 2
Chọn B
Câu 32:
Hòa tan hoàn toàn m gam hỗn hợp gồm Cu và các oxit sắt trong 500 ml dung dịch HCl 2M (dùng dư), thu được dung dịch X. Tiến hành điện phân dung dịch X bằng điện cực trơ với cường độ dòng điện không đổi, quá trình điện phân được ghi nhận như sau:
- Sau thời gian t giây thì khối lượng catot bắt đầu tăng, đồng thời khối lượng dung dịch giảm 4,26 gam so với dung dịch ban đầu.
- Sau thời gian 2t giây thì khí bắt đầu thoát ra ở catot.
- Sau thời gian 3,5t giấy thì khối lượng catot tăng 6,64 gam.
(Biết khí sinh ra không tan trong dung dịch và hiệu suất điện phân bằng 100%). Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Sau t giây, catot bắt đầu tăng khi Fe3+ vừa bị điện phân hết và đến lượt Cu2+ bắt đầu bị điện phân.
Đặt nFe3+ = x → nCl2 = 0,5x = 4,26/71
→ x = 0,12
→ t giây ứng với ne = x = 0,12
Sau 2t có khí ở catot nên Cu2+ đã bị điện phân hết ở t giây thứ 2.
→ nCu2+ = x/2 = 0,06
Dung dịch X chứa Fe3+ (0,12), Cu2+ (0,06), Fe2+ (y), H+ (z) và Cl- (1)
Bảo toàn điện tích → 0,12.3 + 0,06.2 + 2y + z = 1 (1)
nFe2+ bị điện phân = (6,64 – 0,06.64)/56 = 0,05
Sau 3,5t giây (ứng với ne = 3,5.0,12 = 0,42), bảo toàn electron cho catot:
ne = 0,12 + 0,06.2 + z + 0,05.2 = 0,42 (2)
(1)(2) → y = 0,22; z = 0,08
Bảo toàn H → nH2O = 0,46
→ nO = 0,46
→ m = mFe + mCu + mO = 30,24
Chọn C
Câu 33:
NPK là loại phân bón hóa học được sử dụng rộng rãi trong nông nghiệp. Để tiết kiệm chi phí, người dân có thể trộn các loại phân đơn (chỉ chứa một nguyên tố dinh dưỡng) với nhau để được NPK. Để thu được 100 kg phân NPK (16-16-8), người ta trộn lẫn x kg ure (độ dinh dưỡng là 46%), y kg supephotphat kép (độ dinh dưỡng là 40%), z kg phân kali đỏ (độ dinh dưỡng là 60%) và một lượng chất nền (không chứa nguyên tố dinh dưỡng). Tổng giá trị (x + y + z) là
 Xem đáp án
Xem đáp án
mN = 16%.100 = 46%x → x = 34,78 kg
mP2O5 = 16%.100 = 40%y → y = 40
mK2O = 8%.100 = 60%z → z = 13,33
→ x + y + z = 88,11
Chọn C
Câu 34:
Cho sơ đồ chuyển hóa sau:
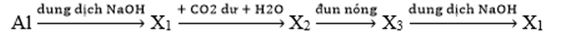
Biết X1, X2, X3 là các hợp chất khác nhau của nguyên tố nhôm. Các chất X1, X2, X3 lần lượt là
 Xem đáp án
Xem đáp án
X1 là NaAlO2; X2 là Al(OH)3; X3 là Al2O3
Phản ứng:
Al + H2O + NaOH → NaAlO2 + H2
NaAlO2 + CO2 + H2O → Al(OH)3 + NaHCO3
Al(OH)3 → Al2O3 + H2O
Al2O3 + NaOH → NaAlO2 + H2O
Chọn A
Câu 35:
Một chất hữu cơ X mạch hở có khối lượng phân tử là 60u thỏa mãn điều kiện sau: X không tác dụng với Na, X tác dụng với dung dịch NaOH và dung dịch AgNO3 trong NH3. X là
 Xem đáp án
Xem đáp án
MX = 60 → X là C3H8O hoặc C2H4O2
X không tác dụng với Na, X tác dụng với dung dịch NaOH và dung dịch AgNO3 trong NH3 → Chọn X là HCOOCH3.
Chọn B
Câu 36:
Cho các phát biểu sau:
(a) Ở điều kiện thường, glucozơ và alanin đều là chất rắn và dễ tan trong nước.
(b) Khi tham gia phản ứng tráng bạc, glucozơ bị oxi hóa thành axit gluconic.
(c) Amilopectin trong tinh bột có cấu trúc mạch không phân nhánh.
(d) Thành phần chính của cồn 70° thường dùng trong y tế để sát trùng là etanol.
(e) Gạch cua nổi lên trên khi nấu riêu cua là hiện tượng đông tụ chất béo.
(f) Xenlulozơ trinitrat là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) Đúng
(b) Sai, glucozơ bị oxi hóa thành amoni gluconat.
(c) Sai, amilopectin có mạch phân nhánh
(d) Đúng
(e) Sai, đông tụ protein.
(f) Sai, xenlulozơ trinitrat là nguyên liệu để sản xuất thuốc súng không khói.
Chọn D
Câu 37:
Cho sơ đồ chuyển hóa sau (theo đúng tỉ lệ mol):
(1) X + 2NaOH → Y + Z + T.
(2) X + H2 → E
(3) E + 2NaOH → Y + 2T.
(4) Y + 2HCl → 2NaCl + F.
Biết: X, Y, Z, T, E, F đều là hợp chất hữu cơ mạch hở; X có công thức phân tử là C8H12O4; T và Z có cùng loại nhóm chức. Cho các phát biểu sau:
(a) Phân tử chất Y được tạo nên từ 4 nguyên tố hóa học.
(b) Z tác dụng với Br2 trong dung dịch theo tỉ lệ mol 1 : 1.
(c) X, E đều là những hợp chất hữu cơ chứa hai chức cùng loại.
(d) Đun nóng Y với vôi tôi xút thu được một chất khí là thành phần chính của khí thiên nhiên.
(e) Có thể thu được T từ phản ứng lên men giấm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(2) → E là C8H14O4
(1)(3) → Z và T cùng C
(4) → Y có 2Na
Z và T cùng loại nhóm chức nên:
X là CH3-CH2-CH2-OOC-COO-CH2-CH=CH2
Y là (COONa)2; F là (COOH)2
E là CH3-CH2-CH2-OOC-COO-CH2-CH2-CH3
T là CH3-CH2-CH2OH
Z là CH2=CH-CH2OH
(a) Sai, Y chứa 3 nguyên tố C, O, Na
(b) Đúng: CH2=CH-CH2OH + Br2 → CH2Br-CHBr-CH2OH
(c) Đúng, X và E đều là este 2 chức
(d) Sai: (COONa)2 + NaOH → H2 + Na2CO3 (thành phần chính của khí thiên nhiên là CH4)
(e) Sai
Chọn D
Câu 38:
Chất X có nhiều trong cây mía, củ cải đường và hoa thốt nốt. Thủy phân chất X thu được chất Y có phản ứng tráng bạc, có độ ngọt cao hơn đường mía. Tên gọi của X và Y lần lượt là
 Xem đáp án
Xem đáp án
Chất X có trong nhiều loài thực vật, có nhiều nhất trong cây mía, củ cải đường và hoa thốt nốt → X là saccarozơ
Thủy phân chất X thu được chất Y có phản ứng tráng gương, có vị ngọt hơn đường mía → Y là fructozơ
C12H22O11 + H2O → C6H12O6 (glucozơ) + C6H12O6 (fructozơ)
Chọn D
Câu 39:
Cho X, Y (MX < MY) là hai axit đơn chức, thuộc cùng dãy đồng đẳng; Z là ancol no; T là este hai chức được tạo bởi X, Y và Z (X, Y, Z, T đều mạch hở). Dẫn 22,56 gam hỗn hợp E dạng hơi chứa X, Y, Z, T qua bình đựng 9,2 gam Na (dùng dư), phần khí và hơi thoát ra khỏi bình đem nung nóng có mặt Ni làm xúc tác thấy chúng phản ứng vừa đủ với nhau, thu được một chất hữu cơ R, đốt cháy hết R cần dùng 0,44 mol O2, thu được 5,76 gam nước. Phần chất rắn còn lại trong bình đem hòa tan vào nước dư, thấy thoát ra 0,04 mol H2. Mặt khác, đốt cháy 22,56 gam E thì cần dùng hết 0,968 mol O2. Phần trăm khối lượng của Y có trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Khí thoát ra khỏi bình Na là este và H2, khi dẫn qua Ni chúng phản ứng vừa đủ với nhau tạo chất hữu cơ duy nhất R là CnH2n-2O4
CnH2n-2O4 + (1,5n – 2,5)O2 → nCO2 + (n – 1)H2O
nH2O = 0,32 → 0,44(n – 1) = 0,32(1,5n – 2,5)
→ n = 9: R là C9H16O4
Các gốc axit trong R không trùng nhau và ít nhất 3C nên R là (C2H5COO)(C3H7COO)C2H4 (0,04 mol)
nNa ban đầu = 0,4; nNa dư = 2nH2 = 0,08
→ nNa phản ứng với E = 0,32 → nH2 = 0,16
nH2 = 4nR nên T là (C2HCOO)(C3H3COO)C2H4
E gồm:
X là CH≡C-COOH: x mol
Y là C3H3COOH: y mol
Z là C2H4(OH)2: z mol
T là (C2HCOO)(C3H3COO)C2H4 (0,04 mol)
nNa phản ứng = x + y + 2z = 0,32
mE = 70x + 84y + 62z + 180.0,04 = 22,56
nO2 = 2,5x + 4y + 2,5z + 0,04.9 = 0,968
→ x = 0,096; y = 0,032; z = 0,096
→ %Y = 11,91%
Chọn B
Câu 40:
Hiđro hóa hoàn toàn m gam chất béo X (xúc tác Ni, t°), thu được (m + 0,2) gam chất béo Y no. Đốt cháy hoàn toàn m gam X, thu được 2,75 mol CO2 và 2,55 mol H2O. Mặt khác, thủy phân hoàn toàn m gam X trong dung dịch NaOH dư đun nóng, thu được a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
Đặt nX = x và độ không no của X là k
→ nH2 = x(k – 3) = 0,1
và x(k – 1) = 2,75 – 2,55
→ x = 0,05 và k = 5
mX = mC + mH + mO = 42,9 (Trong đó nO = 6x)
nNaOH phản ứng = 3x = 0,15 và nC3H5(OH)3 = 0,05
Bảo toàn khối lượng → m muối = 44,3
Chọn B
