(2023) Đề thi thử Hoá học THPT Sở GDĐT Phú Thọ (Lần 2) có đáp án
(2023) Đề thi thử Hoá học THPT Sở GDĐT Phú Thọ (Lần 2) có đáp án
-
327 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
 Xem đáp án
Xem đáp án
Chọn B
Câu 4:
 Xem đáp án
Xem đáp án
Chọn D
Câu 5:
 Xem đáp án
Xem đáp án
Chọn C
Câu 10:
 Xem đáp án
Xem đáp án
Chọn B
Câu 12:
 Xem đáp án
Xem đáp án
Chọn C
Cho thanh kim loại Zn vào dung dịch CuSO4 xảy ra hiện tượng ăn mòn điện hóa học vì:
Zn + CuSO4 → ZnSO4 + Cu
Cu sinh ra bám vào Zn tạo cặp điện cực Zn-Cu tiếp xúc với nhau và cùng tiếp xúc với môi trường điện li nên có ăn mòn điện hóa.
Câu 15:
 Xem đáp án
Xem đáp án
Chọn A
Câu 17:
 Xem đáp án
Xem đáp án
Chọn D
A. Đúng, sản phẩm là cao su Buna-N nên có tính đàn hồi.
B. Đúng, poli(metyl metacrylat) được điều chế bằng phản ứng trùng hợp CH2=C(CH3)COOCH3
C. Đúng, poli(etylen terephtalat) được điều chế bằng phản ứng trùng ngưng C2H4(OH)2 và p-C6H4(COOH)2
D. Sai, amilopectin có phân nhánh, xenlulozơ không phân nhánh.
Câu 18:
Thủy phân 5,13 gam saccarozơ với hiệu suất a%, thu được hỗn hợp X. Cho toàn bộ X tác dụng với lượng dư dung dịch AgNO3 trong NH3, đun nóng, sau khi các phản ứng xảy ra hoàn toàn thu được 5,184 gam Ag. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A
Saccarozơ → Glucozơ + Fructozơ → 4Ag
nAg = 0,048 → nSaccarozơ phản ứng = 0,012
→ H = 0,012.342/5,13 = 80%
Câu 19:
 Xem đáp án
Xem đáp án
Chọn C
A. NH4Cl + Ca(OH)2 → CaCl2 + NH3 + H2O
B. M2+ + HCO3- → MCO3 + CO2 + H2O
C. Na2CO3 + CaCl2 → CaCO3 + NaCl
D. Zn + KHSO4 → ZnSO4 + K2SO4 + H2
Câu 20:
Cho m gam kim loại Fe tác dụng với dung dịch CuSO4 dư, sau phản ứng hoàn toàn thu được 9,6 gam kim loại Cu. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C
Fe + CuSO4 → FeSO4 + Cu
nFe = nCu = 0,15 → mFe = 8,4 gam
Câu 21:
 Xem đáp án
Xem đáp án
Chọn D
Số liên kết π có trong một phân tử triolein (C17H33COO)3C3H5 là 6, gồm 3C=C và 3C=O.
Câu 25:
 Xem đáp án
Xem đáp án
Chọn B
Có 3 dung dịch có khả năng phản ứng được với kim loại Cu là:
FeCl3 + Cu → CuCl2 + FeCl2
HNO3 + Cu → Cu(NO3)2 + NO + H2O
AgNO3 + Cu → Cu(NO3)2 + Ag
Câu 26:
Đốt cháy 3,36 gam kim loại Mg trong khí Cl2 thu được chất rắn X. Hòa tan hết X trong một lượng vừa đủ dung dịch H2SO4 loãng thu được dung dịch Y chứa m gam muối và 0,04 mol khí H2. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C
nMg = 0,14; nMgSO4 = nH2 = 0,04
Bảo toàn Mg → nMgCl2 = 0,14 – 0,04 = 0,1
→ m muối = 14,3 gam
Câu 27:
Polisaccarit X là thành phần của tinh bột có cấu trúc mạch không phân nhánh. Chất Y có nhiều trong thực vật và là thành phần chính của đường mía, đường củ cải, đường thốt nốt. Chất X và Y lần lượt là
 Xem đáp án
Xem đáp án
Chọn D
Polisaccarit X là thành phần của tinh bột có cấu trúc mạch không phân nhánh → X là amilozơ
Chất Y có nhiều trong thực vật và là thành phần chính của đường mía, đường củ cải, đường thốt nốt → Y là saccarozơ.
Câu 28:
Cho các phát biểu sau:
(a) Triolein và peptit đều có cùng thành phần nguyên tố.
(b) Trùng hợp buta-1,3-đien (xúc tác Na) thu được cao su buna-N.
(c) Ở điều kiện thường, axit glutamic và tristearin là các chất rắn.
(d) Thủy phân hoàn toàn anbumin của lòng trắng trứng, thu được α–amino axit.
(đ) Tinh bột là nguyên liệu chính để sản xuất tơ nhân tạo như tơ visco, tơ axetat.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A
(a) Sai, triolein chứa C, H, O; peptit chứa C, H, O, N.
(b) Sai, trùng hợp buta-1,3-đien (xúc tác Na) thu được cao su buna.
(c)(d) Đúng
(đ) Sai, xenlulozơ là nguyên liệu chính để sản xuất tơ nhân tạo như tơ visco, tơ axetat.
Câu 29:
Xà phòng hóa este X có công thức phân tử C5H10O2 bằng dung dịch NaOH dư thu được muối Y và ancol Z (bậc 3). Công thức cấu tạo của Y là
 Xem đáp án
Xem đáp án
Chọn D
Ancol Z (bậc 3) có ít nhất 4C nên X là HCOOC(CH3)3.
→ Y là HCOONa.
Câu 30:
 Xem đáp án
Xem đáp án
Chọn A
Este gồm HCOOCH3 và CH3COOCH3
nNaOH phản ứng = nCH3OH = 0,03
Bảo toàn khối lượng → m muối = 2,32 gam
Câu 31:
Thực hiện các thí nghiệm sau:
(a) Cho kim loại Cu vào dung dịch FeCl3 dư.
(b) Cho CrO3 tác dụng với dung dịch NaOH dư.
(c) Cho NaOH dư vào dung dịch Ca(HCO3)2.
(d) Cho dung dịch BaCl2 dư vào dung dịch KHSO4.
(đ) Cho dung dịch HCl dư vào dung dịch NaAlO2.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được dung dịch chứa 3 chất tan là
 Xem đáp án
Xem đáp án
Chọn A
(a) Cu + FeCl3 dư → CuCl2 + FeCl2
(3 chất tan là CuCl2, FeCl2, FeCl3 dư)
(b) CrO3 + NaOH dư → Na2CrO4 + H2O
(2 chất tan là Na2CrO4, NaOH dư)
(c) NaOH dư + Ca(HCO3)2 → CaCO3 + Na2CO3 + H2O
(2 chất tan là Na2CO3, NaOH dư)
(d) BaCl2 dư + KHSO4 → BaSO4 + KCl + HCl
(3 chất tan là KCl, HCl, BaCl2 dư)
(đ) NaAlO2 + HCl dư → NaCl + AlCl3 + H2O
(3 chất tan là NaCl, AlCl3, HCl dư)
Câu 32:
Đốt cháy hoàn toàn m gam amin X (no, đơn chức, mạch hở) thu được H2O, 0,3 mol CO2 và 0,05 mol khí N2. Mặt khác, cho m gam X tác dụng hết với dung dịch HCl dư, thu được dung dịch chứa a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn A
nX = 2nN2 = 0,1 → Số C = nCO2/nX = 3
X là C3H9N (0,1), muối là C3H10NCl (0,1)
→ m muối = 9,55 gam
Câu 33:
Hỗn hợp E chứa ba este thuần chức X, Y, Z (trong đó MX < MY < MZ; đều mạch hở, phân nhánh, được tạo bởi từ các ancol no, đơn chức). Hiđro hóa hoàn toàn 9,6 gam E cần dùng 0,015 mol H2 (xúc tác Ni, t°) thu được hỗn hợp F gồm một este đơn chức và một este hai chức. Đun nóng toàn bộ F với dung dịch KOH vừa đủ, thu được hỗn hợp T chứa các muối và 4,68 gam hỗn hợp gồm các ancol. Đốt cháy hoàn toàn T cần dùng 0,2175 mol O2, thu được CO2, H2O và 8,28 gam K2CO3. Phần trăm khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
Chọn A
mF = mE + mH2 = 9,63
nK2CO3 = 0,06 → nKOH = 0,12
Bảo toàn khối lượng → m muối = 11,67
Quy đổi T thành HCOOK (a), (COOK)2 (b) và CH2 (c)
mT = 84a + 166b + 14c = 11,67
nKOH = a + 2b = 0,12
nO2 = 0,5a + 0,5b + 1,5c = 0,2175
→ a = 0,03; b = 0,045; c = 0,12
TH1: T gồm CH3COOK (0,03) và C2H4(COOK)2 (0,045)
Các ancol gồm AOH (0,03), BOH (0,045) và ROH (0,045)
mAncol = 0,03(A + 17) + 0,045(B + 17) + 0,045(R + 17) = 4,68
→ 2A + 3B + 3R = 176
→ A = 43, B = R = 15 là nghiệm duy nhất.
F gồm CH3COOCH(CH3)2 (0,03) và C2H4(COOCH3)2 (0,045)
E gồm:
X là CH3COOCH(CH3)2 (0,03)
Y là C2H2(COOCH3)2 (0,015) → %Y = 22,5%
Z là C2H4(COOCH3)2 (0,03)
TH2: T gồm C4H9COOK (0,03) và (COOK)2 (0,045)
(Làm tương tự)
Câu 34:
Một loại xăng có chứa 4 ankan với thành phần về số mol như sau: 10% heptan, 50% octan, 30% nonan và 10% đecan. Nếu một xe máy chạy 100 km tiêu thụ hết 2,0 kg loại xăng nói trên thì lượng nhiệt tỏa ra môi trường là x kJ và thể tích khí cacbonic sinh ra ở điều kiện tiêu chuẩn là y lít. Biết khi đốt cháy hoàn toàn 1,0 mol loại xăng trên giải phóng ra lượng nhiệt là 5337,8 kJ và hiệu suất sử dụng nhiệt của xe máy là 40% còn lại giải phóng ra môi trường dưới dạng nhiệt. Giá trị của x và y lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
2 kg xăng gồm C7H16 (a), C8H18 (5a), C9H20 (3a) và C10H22 (a)
→ 100a + 114.5a + 128.3a + 142a = 2000
→ a = 500/299
nCO2 = 7a + 8.5a + 9.3a + 10a = 140,468
→ y = 140,468.22,4 = 3146,5 lít
Nhiệt tỏa ra môi trường = x = 10a.5337,8.60% = 53556,5 kJ
Câu 35:
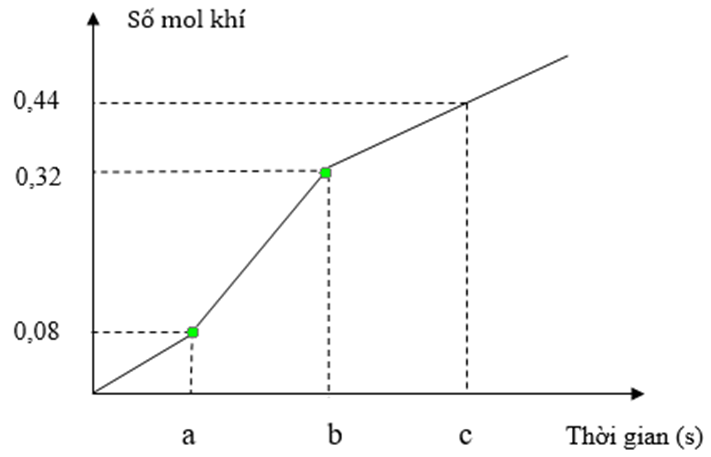
Cho các nhận định sau:
(a) Giá trị của b là 7720.
(b) Tỉ lệ mol CuSO4 : KCl trong X là 2 : 5.
(c) Khối lượng muối có trong X bằng 27,7 gam.
(d) Tại thời điểm c giây, tổng khối lượng dung dịch giảm 21 gam.
(đ) Tại thời điểm 2a giây, tổng thể tích khí thoát ra ở hai điện cực là 5,376 lít (đktc).
Số nhận định đúng là
 Xem đáp án
Xem đáp án
Chọn C
Đoạn 1: Chỉ có Cl2 thoát ra
CuSO4 + KCl → Cu + Cl2 + K2SO4
→ nCu = nCl2 = 0,08 mol
Đoạn 2: Có độ dốc lớn hơn đoạn 1 nên Cl2 và H2 cùng thoát ra.
2KCl + 2H2O → H2 + Cl2 + 2KOH
n khí đoạn 2 = 0,32 – 0,08 = 0,24
→ nCl2 = nH2 = 0,12
Đoạn 3: O2 và H2 cùng thoát ra
2H2O → 2H2 + O2
n khí đoạn 3 = 0,44 – 0,32 = 0,12
→ nO2 = 0,04 và nH2 = 0,08
(a) Đúng
ne tại b giây = 2nCl2 = 2.0,2 = Ib/F → b = 7720s
(b) Sai
nCuSO4 = 0,08 và nKCl = 2nCl2 = 0,4
→ nCuSO4 : nKCl = 1 : 5
(c) Sai
m muối = 0,08.160 + 0,4.74,5 = 42,6
(d) Đúng, lúc c giây các chất thoát ra gồm Cu (0,08), Cl2 (0,2), H2 (0,2) và O2 (0,04)
m giảm = mCu + mH2 + mCl2 + mO2 = 21 gam
(đ) Đúng
a giây đầu tiên: nCl2 = 0,08
a giây kế tiếp: nH2 = nCl2 = 0,08
→ 2a giây thoát 0,24 mol khí hay 5,376 lít.
Câu 36:
Theo tiêu chuẩn Việt Nam, hàm lượng xianua trong nước thải của các nhà máy phải xử lí trong khoảng 0,05-0,2 mg/lít trước khi thải ra môi trường. Phân tích một mẫu nước thải của một nhà máy người ta đo được hàm lượng ion xianua là 97,62 mg/lít. Để làm giảm hàm lượng xianua đến 0,12 mg/lít người ta sục khí clo vào nước thải trong môi trường có pH = 9. Khi đó xianua chuyển thành nitơ không độc theo phản ứng:
CN- + OH- + Cl2 → CO2 + Cl- + H2O + N2.
Thể tích clo (ở đktc) cần thiết để xử lí xianua trong 1000 m³ nước thải trên là
 Xem đáp án
Xem đáp án
Chọn A
2CN- + 8OH- + 5Cl2 → 2CO2 + 10Cl- + 4H2O + N2.
Do mg/lít = g/m³ nên:
nCN- = 1000(97,62 – 0,12)/26 = 3750 mol = 3,75 kmol
→ nCl2 = 3,75.2,5 = 9,375 kmol
→ V Cl2 = 9,375.22,4 = 210 m³
Câu 37:
Đun nóng m gam hỗn hợp gồm bột kim loại Al và hai oxit sắt trong khí trơ thu được hỗn hợp rắn X (oxi chiếm 20,216% về khối lượng của X). Chia X thành hai phần. Phần 1 phản ứng hết với 250 ml dung dịch KOH 1M thu được 0,075 mol khí H2 và dung dịch chứa 23,45 gam hai chất tan. Phần 2 tác dụng hết với dung dịch H2SO4 đặc, nóng thu được dung dịch Y chứa các muối trung hòa và 0,975 mol khí SO2 (sản phẩm khử duy nhất của S+6). Dung dịch Y hòa tan tối đa 42,3 gam Mg. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn D
Hai chất tan gồm KAlO2 (u) và KOH dư (v)
→ nKOH ban đầu = u + v = 0,25
và 98u + 56v = 23,45
→ u = 0,225; v = 0,025
nH2 = 0,075, bảo toàn electron: 3nAl = 2nO + 2nH2
Với nAl = 0,225 → nO = 0,2625
→ m phần 1 = 0,2625.16/20,216% = 20,775
→ nFe = (20,775 – mAl – mO)/56 = 0,1875
nAl : nFe : nO = 6 : 5 : 7 → Phần 2 gồm Al (6x), Fe (5x) và O (7x)
nSO42- (Y) = nMg = 1,7625
Bảo toàn S → nH2SO4 = 2,7375
nH2SO4 = 2nSO2 + nO ⇔ 2,7375 = 0,975.2 + 7x
→ x = 0,1125
Phần 2 / Phần 1 = 7x/0,2625 = 3 lần
→ m = 20,775 + 20,775.3 = 83,1 gam
Câu 38:
Cho sơ đồ các phản ứng sau:
(1) Al2O3 + X → Y + H2O
(2) KHSO4 + Y + H2O → Z + T
(3) KHSO4 + Y → G + T + H2O
Các chất Z và G thỏa mãn sơ đồ trên lần lượt là
 Xem đáp án
Xem đáp án
Chọn B
(2) → Y là muối AlO2-, do tạo 2 sản phẩm nên chọn KAlO2.
→ X là KOH, Z là Al(OH)3, T là K2SO4
G là Al2(SO4)3
(1) Al2O3 + 2KOH → 2KAlO2 + H2O
(2) KHSO4 + KAlO2 + H2O → Al(OH)3 + K2SO4
(3) 8KHSO4 + 2KAlO2 → Al2(SO4)3 + 5K2SO4 + 4H2O
Câu 39:
Hỗn hợp X gồm axit panmitic, axit oleic và triglixerit Y. Cho m gam X tác dụng vừa đủ với dung dịch Z chứa NaOH 0,5M và KOH 1,5M đun nóng, thu được dung dịch T. Cô cạn T chỉ thu được 178,68 gam hỗn hợp muối của hai axit cacboxylic. Nếu đốt cháy hoàn toàn m gam X thì cần vừa đủ 14,775 mol O2, thu được H2O và 10,41 mol CO2. Khối lượng của Y có trong m gam X là
 Xem đáp án
Xem đáp án
Chọn A
Muối gồm C15H31COO- (a), C17H33COO- (b), Na+ (c) và K+ (3c)
Bảo toàn điện tích: a + b = c + 3c (1)
m muối = 255a + 281b + 23c + 39.3c = 178,68 (2)
nC3H5(OH)3 = nY = d
nO2 = 23a + 25,5b + 3,5d = 14,775 (3)
nCO2 = 16a + 18b + 3d = 10,41 (4)
(1)(2)(3)(4) → a = 0,42; b = 0,18; c = 0,15; d = 0,15
→ Y là (C15H31COO)2(C17H33COO)C3H5 (0,15)
→ mY = 124,8 gam
Câu 40:
Cho E (C2H4O2) và F (C6H8O6) là các chất hữu cơ mạch hở (trong phân tử E, F chỉ chứa một loại nhóm chức). Thực hiện các chuyển hóa sau:
(1) E + NaOH → X + Y
(2) F + NaOH → X + Y + Z
(3) X + HCl → T + NaCl
Biết X, Y, Z và T là các chất hữu cơ. Cho các phát biểu sau:
(a) Chất Z là hợp chất hữu cơ tạp chức.
(b) Chất F là este của glixerol với axit cacboxylic.
(c) Từ chất Y có thể điều chế trực tiếp được CH3COOH.
(d) Chất T được sử dụng để điều chế khí CO trong phòng thí nghiệm.
(đ) Hai chất E và F đều có khả năng tham gia phản ứng tráng bạc.
Số phát biểu sai là Xem đáp án
Xem đáp án
Chọn B
X, Y là các chất hữu cơ nên E là HCOOCH3
→ X là HCOONa, Y là CH3OH, T là HCOOH
F là HCOOCH2-CH(OOCH)-COOCH3
Z là CH2OH-CHOH-COONa
(a) Đúng, Z chứa chức ancol và muối cacboxylat.
(b) Sai
(c) Đúng: CH3OH + CO → CH3COOH
(d) Đúng: HCOOH → CO + H2O (H2SO4 đặc)
(đ) Đúng, E và F đều có HCOO- (hay -O-CHO) nên có tráng bạc.
