25 Đề thi thử THPT Quốc Gia môn Hóa năm 2022 (Đề 1)
-
6471 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Kim loại nào sau đây có tính khử mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án B
Theo dãy điện hóa của kim loại, tính khử các kim loại sắp xếp giảm dần: K, Mg, Fe, Ag.
Câu 3:
Những người đau dạ dày thường có pH trong dạ dày nhỏ hơn 2 (thấp hơn so với bình thường là pH từ 2 – 3). Thuốc chữa đau dạ dày có thành phần chính là
 Xem đáp án
Xem đáp án
Đáp án A. NaHCO3
Câu 4:
Số nguyên tử oxi có trong phân tử chất béo là
 Xem đáp án
Xem đáp án
Đáp án D. 6
Công thức chung của chất béo: (RCOO)3C3H5
Câu 7:
Chất tác dụng được với khí nitơ ở điều kiện thường là
 Xem đáp án
Xem đáp án
Đáp án C. Li
Ở điều kiện thuờng, nitơ chỉ tác dụng với liti.
N2 + Li → Li3N.
Câu 10:
Kim loại nào sau đây không tác dụng với dung dịch axit H2SO4 loãng?
 Xem đáp án
Xem đáp án
Đáp án C
Những kim loại đứng sau H trong dãy hoạt động hóa học thì không tác dụng với H2SO4 loãng.
Câu 12:
Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm -OH?
 Xem đáp án
Xem đáp án
Đáp án B
Công thức của glixerol là C3H5 (OH)3.
Câu 13:
Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phuơng trình của phản ứng trên, khi hệ số của FeO là 3 thì hệ số của HNO3 là
 Xem đáp án
Xem đáp án
Đáp án D
PTHH: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O.
Câu 14:
Hòa tan hết m gam Na trong nước (dư), thu được 4,48 lít khí H2 (ở đktc). Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án D
2Na + 2H2O → 2NaOH + H2
mol
mol
Câu 15:
Chất nào sau đây không phản ứng với dung dịch HCl?
 Xem đáp án
Xem đáp án
Đáp án B
- Amin có tính bazơ nên tác dụng được với HCl.
- Amino axit có tính lưỡng tính nên tác dụng được với HCl.
PTHH:
C6H5NH2 +HCl → C6H5NH3Cl
C2H5NH2 +HCl → C2H5NH3Cl
H2N–CH2–COOH + HCl → ClH3N–CH2–COOH
Câu 16:
Đun nóng dung dịch chứa 9 gam glucozơ với lượng dư dung dịch AgNO3 trong NH3, đến khi phản ứng xảy ra hoàn toàn thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Glucozơ 2Ag
mol
gam.
Câu 17:
Cho 10,5 gam hỗn hợp X gồm anilin, metyl amin, đimetylamin và đietylamin tác dụng vừa đủ với 100 ml dung dịch HCl 0,5 M, sau phản ứng thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
RNH2 + HCl → RNH3Cl
BTKL:
gam.
Câu 18:
Trong các hiđrocacbon sau đây, hiđrocacbon nào chứa vòng benzen?
 Xem đáp án
Xem đáp án
Đáp án B
CT của striren: C6H5CH = CH2.
Câu 19:
Trường hợp nào sau đây không dẫn điện?
 Xem đáp án
Xem đáp án
Đáp án A
Muốn dẫn điện thì chất phải điện li, chất đó phải điện li trong dung dịch hoặc chất rắn khan nóng chảy.
Câu 20:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án A
Khi tham gia phản ứng tráng bạc, glucozo thể hiện tính khử.
Câu 21:
Cho các kim loại Fe, Cu, Ag và Zn. số kim loại tan được trong dung dịch Fe(NO3)3 dư là
 Xem đáp án
Xem đáp án
Đáp án A
Thứ tự trong dãy điện hóa:
Theo quy tắc α Fe(NO3)3 phản ứng với Zn, Fe, Cu.
Câu 22:
Chất X có công thức phân tử C4H8O2, tác dụng với dung dịch NaOH thu được chất Y có công thức C2H3O2Na. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Đáp án C
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
Câu 23:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án C
A sai vì este ít tan trong nước.
B sai vì benzyl axetat có mùi thơm hoa nhài.
D sai vì dùng nước Brom chỉ nhận biết được stiren.
Câu 24:
Fe phản ứng với dung dịch nào sau đây tạo khí H2 ?
 Xem đáp án
Xem đáp án
Đáp án A
Fe + H2SO4 → FeSO4+H2
Câu 25:
Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M. Sau khi phản ứng kết thúc, thu được V ml CO2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
Thứ tự phản ứng:
(1)
0,02 0,02 0,02
(2)
0,01 0,04 0,01
mol
mol
(1).
|
Bài toán cho dung dịch axit vào hỗn hợp muối cacbonat và hiđrocacbonat hoặc ngược lại: - Khi cho từ từ axit vào hỗn hợp muối: Phản ứng xảy ra theo thứ tự: Cách giải: Lưu ý theo trình tự xảy ra phản ứng. - Khi cho từ từ hỗn hợp muối vào axit: Phản ứng xảy ra đồng thời: Cách giải: Vì 2 phản ứng xảy ra đồng thời nên số mol 2 muối phản ứng tỉ lệ với số mol 2 muối ban đầu, nên cần lập tỉ lệ này để biết lượng muối đã phản ứng. |
Câu 26:
Cho 0,15 mol este X đơn chức tác dụng vừa đủ với 150 gam dung dịch NaOH 8%, thu được 172,2 gam dung dịch Y. Cô cạn dung dịch Y, thu được m gam rắn khan. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án A
mol
X là este đơn chức mà nên X là este có dạng RCOOC6H4.
RCOOC6H4 + 2NaOH → RCOONa + C6H4ONa + H2O (1)
mol gam
gam.
gam.
|
Đối với bài này, lưu ý nhầm lẫn dạng bài este đơn chức tác dụng với NaOH mà suy ra NaOH dư. Vì đề bài có đề cập phản ứng vừa đủ nên phải thuộc trường hợp este của phenol. |
Câu 27:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Dầu ăn là chất béo có thành phần: C, H, O.
Mỡ bôi trơn là hiđrocacbon có thành phần: C, H.
Câu 28:
Thí nghiệm nào sau đây không có sự hòa tan chất rắn?
 Xem đáp án
Xem đáp án
Đáp án B
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
3Cu + + → + 2NO + 4H2O
Câu 29:
Cho hỗn hợp X gồm 0,56 gam Fe và 0,12 gam Mg tác dụng với 250 ml dung dịch CuSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu đuợc 0,92 gam kim loại. Nồng độ mol/l của dung dịch CuSO4 là
 Xem đáp án
Xem đáp án
Đáp án B
mol
mol
Nếu Mg phản ứng hết:
(1)
mol
Vậy Mg phản ứng hết, Fe đã tham gia phản ứng:
(2)
x x
mol
M.
Câu 30:
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2, xúc tác Ni. Sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom dư thì còn lại 0,448 lít hỗn hợp khí Z (đktc) có tỉ khối hơi so với O2 là 0,5. Khối lượng bình đựng dung dịch brom tăng bao nhiêu gam?
 Xem đáp án
Xem đáp án
Đáp án B
Khối lượng bình Brom tăng là khối lượng hiđrocacbon không no: C2H2; C2H4
BTKL:
gam.
|
Đối với bài này, yêu cầu bài tính khối lượng bình brom tăng, tức là tính tổng khối lượng hiđrocacbon không no có trong Y, nên nếu xác định hướng làm là tìm cách tính lần lượt khối lượng anken và ankin riêng lẻ thì không thể giải quyết được, mà chỉ có thể tính tổng khối lượng anken và ankin trong Y. Từ đó ta thấy, việc xác định hướng giải nào là thỏa mãn theo yêu cầu đề là rất quan trọng. |
Câu 31:
Hòa tan hỗn hợp hai muối cacbonat của 2 kim loại hóa trị II trong dung dịch HCl dư thu được 10,08 lít khí (đktc). Cô cạn dung dịch sau phản ứng thấy khối lượng muối khan thu được so với khối lượng muối cacbonat ban đầu
 Xem đáp án
Xem đáp án
Đáp án A
MCO3 + 2HCl → MCl2 + CO2 + H2O
Ta có: mol
mol
gam.
Vậy khối lượng muối khan tăng so với khối lượng muối cacbonat ban đầu 4,95 gam.
Câu 32:
Cho các chất X, Y, Z, T đơn chức, mạch hở có cùng công thức phân tử C4H6O2. X, Y, Z, T có các đặc điểm sau:
(1) X có đồng phân hình học, dung dịch X làm đổi màu quỳ tím.
(2) Y không có đồng phân hình học, có phản ứng tráng bạc, thủy phân Y trong NaOH thu được ancol.
(3) Thủy phân Z cho 2 chất hữu cơ có cùng số nguyên tử cacbon và sản phẩm có phản ứng tráng bạc.
(4) T dùng để điều chế chất dẻo và không tham gia phản ứng với dung dịch NaHCO3.
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án A
(1) X là CH3 – CH = CH – COOH
(2) Y là HCOOCH2CH = CH2
(3) Z CH3COOCH = CH2
(4) T là CH2 = CH – COOCH3
Câu 33:
Cho m gam Mg vào dung dịch chứa 0,1 mol AgNO3 và 0,25 mol Cu(NO3)2, sau một thời gian thu được 19,44 gam kết tủa và dung dịch X chứa 2 muối. Tách lấy kết tủa, thêm tiếp 8,4 gam bột sắt vào dung dịch X, sau khi các phản ứng hoàn toàn thu được 9,36 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
x x x
Sau khi cho sắt vào dung dịch X, thấy khối lượng rắn tăng lên từ 8,4 đến 9,36 gam, suy ra khối lượng kim loại tăng do khối lượng Cu tạo thành nhiều hơn khối lượng Fe tan.
BT n:
gam
gam.
|
Lưu ý khối lượng kim loại trước và sau phản ứng có sự thay đổi như thế nào: - Khối lượng kim loại tăng chứng tỏ khối lượng kim loại tạo thành nhiều hơn khối lượng kim loại tan ra khi phản ứng và ngược lại. - |
Câu 34:
Đun nóng 0,2 mol hỗn hợp X gồm một este đơn chức và một este hai chức với dung dịch NaOH vừa đủ, thu được một ancol Y duy nhất và 24,52 gam hỗn hợp Z gồm các muối. Dẫn toàn bộ Y qua bình đựng Na dư, thấy khối lượng bình tăng 9,0 gam. Đốt cháy hoàn toàn 24,52 gam Z cần dùng 0,52 mol O2, thu được Na2CO3 và 24,2 gam hỗn hợp gồm CO2 và H2O . Phần trăm khối lượng của muối có khối lượng phân tử lớn nhất trong hỗn hợp Z là
 Xem đáp án
Xem đáp án
Đáp án B
0,2 mol:
BTKL:
Trường hợp 1: Hỗn hợp X không chứa este của phenol
2ROH H2
(loại)
Trường hợp 2: Hỗn hợp X chứa este của phenol
Nếu hỗn hợp este có dạng:
(loại)
Nếu hỗn hợp este có dạng:
C2H5OH
BTKL:
|
Lưu ý khi sử dụng từ ngữ của đề bài: Ở đây, đề bài đề cập este đơn chức và 2 chức, không đề cập đến este no hay este mạch hở, cần lưu ý đến trường hợp este của phenol. Có thể giải quyết trường hợp có este của phenol trước để giải nhanh gọn hơn. |
Câu 35:
Sục từ từ khí CO2 đến dư vào dung dịch chứa Ba(OH)2 và NaAlO2. Khối lượng kết tủa thu được sau phản ứng được biểu diễn trên đồ thị sau:
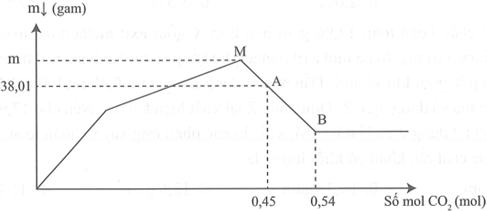
Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án A
Giai đoạn 1:
Ba(OH)2 + CO2 → BaCO3 + H2O
x x
Giai đoạn 2:
y y y
Giai đoạn 3:
BaCO3 + CO2 + 2H2O → Ba(HCO3)2 (*)
Tại A:
Lúc này khối lượng kết tủa là: (1)
Tại B:
(2)
Từ (1) và (2)
gam.
Câu 36:
Hình vẽ sau minh họa phưong pháp điều chế etyl axetat trong phòng thí nghiệm:
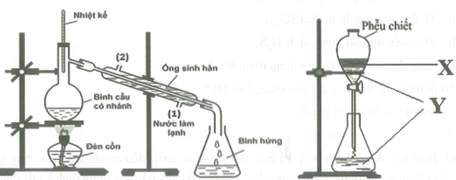
Cho các phát biểu:
(a) Hỗn hợp chất lỏng trong bình 1 gồm ancol etylic, axit axetic và axit suníùric đặc.
(b) Trong phễu chiết lớp chất lỏng Y có thành phần chính là etyl axetat.
(c) Trong bình 1 có thể thay axit axetic bằng giấm.
(d) Chất lỏng trong phễu chiết được phân thành 3 lớp.
(e) Thêm đá bọt vào bình 1 để làm sôi đều hỗn hợp.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D
Những phát biểu đúng: (a), (e).
(b) sai vì este nhẹ hơn nên X nổi lên trên mới là etyl axetat.
(c) sai vì trong giấm thành phần chủ yếu là nước, chỉ một phần nhỏ là axit axetic nên không tham gia phản ứng este được.
(d) sai vì chỉ phân thành 2 lớp.
Câu 37:
Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng thu được dung dịch Y chỉ chứa 59,04 gam muối trung hòa và 0,896 lít NO (đktc, sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Y thì có 0,44 mol NaOH phản ứng. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe trong X gần giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
BTNT N:
BT H:
BT O:
BT Fe:
.
|
Đối với bài toán này, cách giải trên áp dụng triệt để các phương pháp bảo toàn, bao gồm bảo toàn khối lượng, bảo toàn điện tích, đặc biệt là bảo toàn nguyên tố. Việc sử dụng các phương pháp bảo toàn giúp giải nhanh hơn, nhưng cần chú ý, cần nắm được bản chất của từng giai đoạn phản ứng thì mới sử dụng có hiệu quả phương pháp này. |
Câu 38:
Đốt cháy hoàn toàn 17,96 gam hỗn hợp X gồm axit metacrylic, axit ađipic, axit axetic và glixerol (trong đó số mol axit metacrylic bằng số mol axit axetic) trong oxi dư, thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào dung dịch chứa 0,48 mol Ba(OH)2 thu được 59,1 gam kết tủa và dung dịch Z. Đun nóng Z lại xuất hiện kết tủa. Nếu cho 17,96 gam X tác dụng với 150 ml dung dịch NaOH 1M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được chất rắn khan có khối lượng là
 Xem đáp án
Xem đáp án
Đáp án C
Vì số mol axit metacrylic bằng số mol axit axetic, khối lượng mol tổng của axit metacrylic và axit axetic bằng khối lượng mol của axit adipic nên xem như hỗn hợp X gồm:
BT C:
.
|
Đối với những bài toán hỗn hợp nhiều chất nhưng lại hạn chế về mặt dữ liệu tính toán, cần tìm ra điểm chung của các chất trong hỗn hợp nhằm giảm số lượng ẩn cần tìm tương ứng với dữ kiện đề bài cho. |
Câu 39:
Thực hiện các thí nghiệm sau:
(1) Cho dung dịch NaOH dư vào dung dịch Ca(HCO3)2.
(2) Cho Ca vào dung dịch Ba(HCO3)2.
(3) Cho Ba vào dung dịch H2SO4 loãng.
(4) Cho H2S vào dung dịch Fe2(SO4)3.
(5) Cho SO2 đến dư vào dung dịch H2S.
(6) Cho dung dịch NaHCO3 vào dung dịch BaCl2.
(7) Cho dung dịch NaAlO2 dư vào dung dịch HCl.
Số thí nghiệm thu được kết tủa là
 Xem đáp án
Xem đáp án
Đáp án C
(1) Ca(HCO3)2 + 2NaOH → CaCO3 ↓ +Na2CO3 + H2O
(2) Ca + 2H2O → Ca(OH)2 + H2
Ca(OH)2 + Ba(HCO3)2 → CaCO3 ↓ + BaCO3 ↓ + 2H2O
(3) Ba + H2SO4 → BaSO4 ↓ + H2
(4) Fe2(SO4)3 + H2S → 2FeSO4 + S ↓ + H2SO4
(5) SO2 + 2H2S → 3S ↓ + 2H2O
(7) NaAlO2 + HCl + H2O → NaCl + Al(OH)3 ↓
|
Lưu ý các chất không nhất thiết phản ứng trực tiếp với nhau, có thể qua phản ứng trung gian như thí nghiệm (2). Lưu ý phân biệt 2 phản ứng dễ nhầm lẫn sau: Fe2(SO4)3 + H2S → 2FeSO4 + S ↓ + H2SO4 Phản ứng trên thể hiện tính oxi hóa của và tính khử của H2S. FeSO4 + H2S → không xảy ra phản ứng. |
Câu 40:
Hỗn hợp X gồm peptit Y và este của α-amino axit (đều mạch hở). Đốt cháy hoàn toàn 25,47 gam X cần dùng 1,2825 mol O2, sản phẩm cháy dẫn qua dung dịch KOH đặc dư, thấy khối lượng dung dịch tăng 62,17 gam. Mặt khác đun nóng 25,47 gam X với dung dịch NaOH vừa đủ, thu được ancol etylic và 33,57 gam hỗn hợp Z gồm ba muối của Gly, Ala và Val. Số nguyên tử hiđro (H) trong Y là
 Xem đáp án
Xem đáp án
Đáp án B
BTKL:
Ta có: nên Y là tetrapeptit.
Trường hợp 1: Este của glyxin.
Suy ra số gốc CH2 trong peptit là (loại).
Trường hợp 2: Este của alanin.
Suy ra số gốc CH2 trong peptit là (chọn).
Vậy peptit Y là: (gly)3val. Suy ra số nguyên tử hiđro trong Y là 20.
