25 Đề thi thử THPT Quốc Gia môn Hóa năm 2022 (Đề 7)
-
6402 lượt thi
-
35 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng chất nào trong các chất sau để khử độc thủy ngân?
 Xem đáp án
Xem đáp án
Đáp án A.
Vì lưu huỳnh tác dụng với thủy ngân ngay ở nhiệt độ thường:
Câu 2:
Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là
 Xem đáp án
Xem đáp án
Đáp án B.
Cấu hình e lớp ngoài cùng của kim loại thuộc nhóm IIA là
Câu 3:
“Hiệu ứng nhà kính” là hiện tượng Trái Đất ấm dần lên do các bức xạ có bước sóng dài trong vùng hồng ngoại bị khí quyển giữ lại mà không bức xạ ra ngoài vũ trụ. Khí nào dưới đây là nguyên nhân chính gây ra hiệu ứng nhà kính?
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 5:
Kim loại nào sau đây bị thụ động hóa trong đặc nguội?
 Xem đáp án
Xem đáp án
Đáp án B.
Al, Fe, Cr bị thụ động hóa trong đặc nguội do có màng oxit bảo vệ.
Câu 7:
Phát biểu nào sau dây không đúng?
 Xem đáp án
Xem đáp án
Đáp án C.
Ví dụ:
Tùy gốc axit của muối amoni mà khi bị nhiệt phân hủy sẽ tạo thành sản phẩm khác nhau.
Câu 9:
Dãy các polime được điều chế bằng cách trùng ngưng là
 Xem đáp án
Xem đáp án
Đáp án A.
- Các polime được điều chế bằng cách trùng ngưng: nilon-6, nilon-7, nilon-6,6.
- Các polime được điều chế bằng cách trùng hợp: polibutađien, tơ nitron.
|
|
Phản ứng trùng hợp |
Phản ứng trùng hợp |
|
Khái niệm |
Quá trình kết hợp nhiều phân tử nhỏ (monome) thành các phân tử rất lớn (polime) |
Quá trình kết hợp nhiều phân tử nhỏ (monome) thành các phân tử lớn (polime) đồng thời giải phóng các phân tử nhỏ khác (nước,…) |
|
Điều kiện của monolime |
Phải có liên kết bội hoặc vòng kém bền. |
Phải có ít nhất hai nhóm chức có khả năng phản ứng với nhau tạo liên kết. |
|
Ví dụ |
Etilen (PE), propilen (PP), stiren (PS), buta-1,3-đien (cao su buna), vinyl clorua (PVC), metyl metarylat (thủy tinh hữu cơ), vinyl xianua (tơ nitron), caprolactam (vòng kém bền),… |
Nilon-6, nilon-7, nilon-6,6, tơ lapsan, ure-fomanđehit,…. |
Câu 10:
Kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
 Xem đáp án
Xem đáp án
Đáp án D.
Các kim loại có tính khử trung bình như Fe, Cu, Zn,… được điều chế bằng phương pháp nhiệt luyện.
Chất khử thường được sử dụng là
Phương pháp điều chế kim loại :
- Kim loại có tính khử mạnh: Na, K, Ca, Mg, Al,…. chỉ được điều chế bằng phương pháp điện phân nóng chảy.
- Các kim loại có tính khử trung bình như Fe, Cu, Zn,… được điều chế bằng phương pháp nhiệt luyện hoặc điện phân nóng chảy.
- Các kim loại có tính khử yếu như Ag, Hg,… được điều chế bằng phương pháp thủy luyện.
- Ngoài ra còn dùng phương pháp điện phân dung dịch điều chế kim loại có tính khử yếu.
Câu 11:
Để chứng minh trong phân tử glucozơ có 5 nhóm hiđroxyl, dùng chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C.
Một phân tử glucozơ phản ứng với 5 phân tử anhiđrit axetic tạo este.
Những chất có từ 2 nhóm liền kề trở lên tác dụng được với tạo phức xanh lam.
Câu 13:
Cho m gam Fe tan hoàn toàn trong lượng dư dung dịch thể tích khí NO (sản phẩm khử duy nhất ở đktc) thu được là 1,12 lít. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A.
mol
Ta có:
0,15 0,15 0,05
BTe: mol
Nên mol
Vậy (g)
Câu 14:
Hòa tan 11,2 gam CaO vào lượng nước dư được dung dịch X. Thể tích dung dịch HCl 2M cần để trung hòa vừa đủ dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án A.
mol
mol
(l)
Câu 15:
Cho các chất sau: etilen, axetilen, phenol, toluen, anilin. Số chất làm mất màu dung dịch là
 Xem đáp án
Xem đáp án
Đáp án C.
Những chất làm mất màu dung dịch etilen, axetilen, phenol, anlin.
Những chất làm mất màu dung dịch
- Những chất có liên kết bội kém bền như: anken, ankin, ankađien,…
- Những chất có nhóm thế làm ảnh hưởng đến khả năng thế của vòng benzen như: phenol, anlin.
- Những chất có nhóm chức như: glucozơ, anđehit, axit fomic,…
Câu 16:
Lên men 180 gam glucozơ, khí thoát ra được dẫn vào dung dịch nước vôi trong dư thu được m (gam) kết tủa trắng. Biết hiệu suất của quá trình lên men đạt 80%. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D.
nglucozơ (phản ứng) nglucozơ (đã dùng) mol
mol
mol
gam.
Câu 17:
0,1 mol amino axit X phản ứng vừa đủ với 0,2 mol HCl, sản phẩm tạo thành phản ứng vừa đủ với 0,1 mol NaOH. Công thức X có dạng
 Xem đáp án
Xem đáp án
Đáp án D.
Amino axit X:
X có dạng
Câu 20:
Cho các phát biểu sau:
(1) Xenlulozơ tan được trong nước.
(2) Xenlulozơ tan trong benzen và ete.
(3) Xenlulozơ tan trong dung dịch axit sunfuric nóng.
(4) Xenlulozơ là nguyên liệu để điều chế thuốc nổ.
(5) Xenlulozơ là nguyên liệu để điều chế tơ axetat, tơ visco.
(6) Xenlulozơ trinitrat dùng để sản xuất tơ sợi.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B.
Những phát biểu đúng: (3), (4), (5).
Xenlulozơ không tan trong nước, benzen và ete.
Xenlulozơ trinitrat dùng để sản xuất thuốc súng không khói, còn xenlulozơ axetat dùng sản xuất tơ sợi.
Câu 21:
Phát biểu náo sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án A.
A sai vì hiđro có 1 electron lớp ngoài cùng nhưng là phi kim.
Câu 22:
Este được tạo thành từ axit axetic và ancol metylic có công thức phân tử là
 Xem đáp án
Xem đáp án
Đáp án D.
Este được tạo thành từ axit axetic và ancol metylic là
Câu 23:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án D.
A sai vì axit béo là axit đơn chức.
B sai vì etylen glicol là ancol no, 2 chức, mạch hở.
C sai vì ancol etylic không tác dụng được với dung dịch NaOH.
Một số este có mùi: benzyl axetat có mùi hoa nhài, isoamyl axetat có mùi chuối chín, etyl isovalerat có mùi táo, etyl butirat và etyl propionat có mùi dứa, geranyl axetat có mùi hoa hồng.
Câu 25:
Điện phân nóng chảy 2,22 gam một muối clorua kim loại hóa trị II. Sau khi quá trình điện phân kết thúc ở anot thu 448 ml khí (đktc). Công thức của muối là
 Xem đáp án
Xem đáp án
Đáp án C.
mol
Muối clorua là
Câu 26:
Cho 21,8 gam hỗn hợp gồm phenyl axetat và etyl benzoat tác dụng vừa đủ với 200 ml dung dịch NaOH 1M, cô cạn dung dịch sau phẩn ứng thu được m gam rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A.
BTKL: mrắn
mrắn gam.
Câu 27:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án B.
Phản ứng thủy phân este trong môi trường kiềm được gọi là phản ứng xà phòng hóa.
Câu 29:
Hòa tan hết 0,2 mol FeO bằng dung dịch đặc, nóng (dư), thu được khí (sản phẩm khử duy nhất). Hấp thụ hoàn toàn khí sinh ra ở trên vào dung dịch chứa 0,07 mol KOH và 0,06 mol NaOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B.
0,2 0,2
BT e: mol
mol
Ta có: nên muối thu được gồm muối Na, K của
Ta có:
mol
mmuối
mmuối
Ở bài này, việc tính khối lượng muối không nhất thiết phải tính khối lượng từng muối cụ thể, mà sử dụng phương pháp bảo toàn khối lượng sẽ tối ưu hơn.
tạo muối
tạo muối
tạo muối và muối
Câu 30:
Đốt cháy hoàn toàn 0,35 mol hỗn hợp X gồm hai hiđrocacbon (mạch hở, thuộc cùng dãy đồng đẳng) cần vừa đủ 25,48 lít (đktc), thu được hỗn hợp khí và hơi T. Dẫn T qua bình đựng nước vôi trong dư, sau phản ứng, khối lượng dung dịch giảm 39,55 gam. Dãy đồng đẳng của hai hiđrocacbon trong X là
 Xem đáp án
Xem đáp án
Đáp án D.
mdd giảm (1)
BT O: (2)
Từ (1) và (2)
Hai hiđrocacbon thuộc dãy đồng đẳng của ankin hoặc ankađien.
Câu 31:
Cho m gam hỗn hợp gồm Na và Al vào nước (dư). Khi các phản ứng kết thúc, thu được 4,48 lít khí (đktc) và 2 gam chất rắn không tan. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án A.
Vì nước dư nên Na phản ứng hết, m gam chất rắn không tan là Al dư.
a a 0,5a
a a 1,5a
mol
mAl (dư) = 2 gam
nAl (phản ứng) mol
mAl (phản ứng) + mAl (dư) = 7 gam.
Câu 32:
Cho các phát biểu sau:
(1) Các ankylamin được dùng trong tổng hợp hữu cơ.
(2) Các amin đều thể hiện tính bazơ.
(3) Ở điều kiện thường, đimetylamin ở thể khí, tan tốt trong nước.
(4) Cho phenolphtalein vào dung dịch metylamin, xuất hiện màu hồng.
(5) Cho dung dịch NaOH vào phenylamoni clorua, đun nóng, thấy dung dịch vẩn đục.
(6) Cho dung dịch HCl đến dư vào dung dịch anilin, thu được dung dịch trong suốt.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D.
Những phát biểu đúng: (1), (2), (3), (4), (5), (6).
(5)
(6)
Câu 33:
Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào 1 lít dung dịch a mol thì thu được 31,2 gam kết tủa. Nếu cho 7,36 gam X trên vào 2 lít dung dịch a mol thì thu được 51,84 gam kết tủa. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án C.
Nhận xét: Ở 2 thí nghiệm trên, khi tăng gấp đôi nhưng lượng kết tủa không gấp đôi, chứng tỏ, khi dùng 1 lít thì phản ứng hết, còn khi dùng 2 lít thì dư.
- mol
- mol
Nếu chỉ có Mg phản ứng thì nên phải có kết tủa Ag tạo thành do Fe.
Nếu thêm Fe phản ứng hết tạo kết tủa
Vậy khi dùng a mol thì Mg đã phản ứng hết, Fe phản ứng một phần.
0,12 0,24 a a
z 2z
Câu 34:
Hỗn hợp N gồm 3 este đều đơn chức, mạch hở. Xà phòng hóa hoàn toàn 13,58 gam X với dung dịch NaOH vừa đủ, thu được hỗn hợp Y gồm hai ancol no, đơn chức và hỗn hợp Z gồm hai muối. Đốt cháy hoàn toàn Y cần 0,345 mol Mặt khác, đốt cháy hoàn toàn Z cần dùng 0,29 mol thu được và 14,06 gam hỗn hợp gồm và Hỗn hợp X trên có thể tác dụng với tối đa bao nhiêu mol (trong )?
 Xem đáp án
Xem đáp án
Đáp án B.
Vì ancol no đơn chức nên
BTKL:
Số mol tác dụng với este bằng số mol tác dụng với muối vì ancol no đơn chức.
Điểm quan trọng ở bài này cần nắm là:
- Áp dụng định luật bảo toàn khối lượng 2 lần liên tiếp mới tìm được số mol NaOH.
- Số mol tác dụng với este bằng số mol tác dụng với muối vì ancol no đơn chức.
- Khi đốt cháy ancol no đơn luôn có:
Câu 35:
Cho m gam hỗn hợp gồm Na, Ba và BaO vào nước dư thu được a mol khí và dung dịch X. Sục khí đến dư vào dung dịch X, phản ứng được biểu diễn theo đồ thị sau:
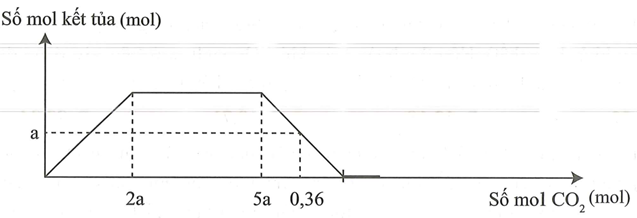
Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A.
Giai đoạn 1: lớn nhất
Giai đoạn 2: NaOH tác dụng với tạo mới sau đó muốn này tác dụng hết với tạo muối
Giai đoạn 3: tan.
tan một phần, còn lại a mol kết tủa
BTNT Na, Ba
BT e:
