25 Đề thi thử THPT Quốc Gia môn Hóa năm 2022 (Đề 2)
-
6468 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Trong số các kim loại sau, kim loại nào dẫn điện tốt nhất?
 Xem đáp án
Xem đáp án
Đáp án C
Tính dẫn điện giảm dần từ
Câu 5:
Để hàn đường ray, người ta thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
PTHH:
Câu 10:
Dung dịch bị lẫn . Để loại bỏ có thể dùng kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Theo dãy điện hóa của kim loại:
- Dùng Al, Fe, Zn đều khử được để loại bỏ nhưng với Al, Zn sẽ tạo chất là muối của những kim loại này, còn Fe thì không.
- Dùng kim loại Fe có thể khử thành và Cu và tách được kim loại Cu ra khỏi dung dịch.
|
Ghi chú: Nguyên tắc tách chất là chọn chất không tác dụng với chất cần tách, đồng thời loại bỏ tạp chất có sẵn nhưng không làm tăng thêm lượng tạp chất khác. |
PTHH:
Câu 13:
Nhiệt phân trong không khí đến khối lượng không đổi, thu được chất rắn là
 Xem đáp án
Xem đáp án
Đáp án C
PTHH:
Câu 14:
Hòa tan hỗn hợp Na và K vào nước dư, thu được dung dịch X và 0,672 lít khí (đktc). Thể tích dung dịch HCl 0,1M cần dùng để trung hòa X là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 16:
Đun nóng dung dịch chứa m (gam) glucozo với dung dịch trong thì thu được 16,2 gam Ag. Biết hiệu suất phản ứng đạt 75%. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 17:
Cho 10 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư) thu được 15 gam muối. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 18:
Trong phân tử propen có số liên kết xích ma là
 Xem đáp án
Xem đáp án
Đáp án D
CT propen:
|
Ghi chú: Liên kết đơn có 1 liên kết Liên kết đôi có 1 liên kết và 1 liên kết . Liên kết đơn có 3 có 1 liên kết và 2 liên kết |
Câu 19:
Có 3 dung dịch có cùng nồng độ mol: NaCl (1), (2), (3). Dãy nào sau đây được sắp xếp theo thứ tự tăng dần về độ dẫn điện từ trái sang phải?
 Xem đáp án
Xem đáp án
Đáp án C
không điện li nên không dẫn điện.
điện li yếu nên dẫn điện kém.
điện li mạnh nên dẫn điện tốt.
|
Ghi chú: Chất điện ly mạnh thì dẫn điện tốt, chất điện ly yếu thì dẫn điện kém, chất không điện ly thì không dẫn điện. |
Câu 20:
Cho các phát biểu sau:
(a) Fructozơ và glucozơ đều có khả năng tham gia phản ứng tráng bạc.
(b) Ở điều kiện thường, glucozơ và saccarozơ đều là những chất rắn, dễ tan trong nước.
(c) Xenlulozo trinitrat là nguyên liệu để sản xuất tơ nhân tạo và chế tạo thuốc súng không khói.
(d) Amilopectin trong tinh bột chỉ có các liên kết .
(e) Saccarozơ bị hóa đen trong đặc.
(f) Trong công nghiệp dược phẩm, saccarozơ được dùng để pha chế thuốc.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Những phát biểu đúng: (a), (b), (e), (f).
(c) sai vì xenlulozơ trinitrat không phải là nguyên liệu để sản xuất tơ nhân tạo.
(d) sai vì amilopectin trong tinh bột gồm các liên kết và
Câu 22:
Thủy phân chất hữu cơ X trong dung dịch NaOH (dư), đun nóng, thu được sản phẩm gồm 1 muối của axit fomic và ancol etylic. Chất X là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 23:
Điều nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án A
A sai vì có 4 đồng phân mạch hở:
(đồng phân hình học)
Câu 24:
Cr tạo muối Cr(II) khi phản ứng với
 Xem đáp án
Xem đáp án
Đáp án D
Crom tác dụng với tạo hợp chất Cr(III).
Câu 25:
Hòa tan hỗn hợp X gồm Na và Al (trong đó số mol Al gấp 1,5 lần số mol Na) vào nước dư thấy thoát ra 8,96 lít (đktc) và m gam rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Hỗn hợp
Sau phản ứng, Al dư.
Câu 26:
Hóa hơi 5,0 gam este đơn chức E được thể tích hơi bằng thể tích của 1,6 gam oxi đo trong cùng điều kiện nhiệt độ và áp suất. Xà phòng hóa hoàn toàn 1,0 gam E bằng dung dịch NaOH vừa đủ thu được ancol X và 0,94 gam muối natri của axit cacboxylic Y. X là ancol
 Xem đáp án
Xem đáp án
Đáp án D
Trong 5 gam este:
Trong 1 gam este:
Vậy X là ancol etylic
Câu 27:
Nhận định nào sau đây không đúng về phản ứng este hóa giữa axit cacboxylic và ancol?
 Xem đáp án
Xem đáp án
Đáp án D
Trong phản ứng este hóa, tạo thành từ sự kết hợp giữa OH của axit và H của ancol.
Câu 28:
Thí nghiệm nào sau đây thu được kết tủa?
 Xem đáp án
Xem đáp án
Đáp án D
Thí nghiệm A: tạo kết tủa , kết tủa tan tiếp trong NaOH dư,
Thí nghiệm B: tao kết tủa , kết tủa tan tiếp trong HCl dư.
Thí nghiệm C: không xảy ra phản ứng.
Câu 29:
Hòa tan hết 7,74 gam hỗn hợp Mg, Al bằng 500 ml dung dịch HCl 1M và loãng 0,28M thu được dung dịch X chỉ chứa muối và khí . Cô cạn dung dịch X thu được khối lượng muối là
 Xem đáp án
Xem đáp án
Đáp an B
Câu 30:
Cho sơ đồ chuyển hóa:. Để tổng hợp 250 kg PVC theo sơ đồ trên thì cần V khí thiên nhiên (đktc). Tính giá trị của V biết chiếm 80% thể tích khí thiên nhiên. Hiệu suất của cả quá trình là 50%.
 Xem đáp án
Xem đáp án
Đáp án A
Câu 31:
Cho 2,7 gam vào 100 ml dung dịch NaOH 2M thu được dung dịch X. Thêm dung dịch chứa 0,35 mol HCl vào dung dịch X thì lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Đáp án C
Ghi chú:
Nếu cho vào hỗn hợp gồm thì số mol kết tủa tính nhanh bằng công thức:
Câu 32:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với các thuốc thử được ghi lại dưới bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X và Y |
Có màu xanh lam |
|
|
Y |
Đun nóng với dung dịch loãng, sau đó cho tiếp dung dịch |
Kết tủa bạc trắng sáng |
|
Z |
trong môi trường kiềm |
Có màu tím |
|
T |
Đun nóng với dung dịch NaOH loãng, dư. Sau đó làm nguội, nhỏ tiếp vài giọt nước . |
Có kết tủa trắng |
Dung dịch X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Đáp án D
Y vừa tác dụng với tạo phức xanh lam, vừa thủy phân trong môi trường axit rồi tác dụng với nên Y là saccarozơ.
Z tác dụng trong môi trường kiềm tạo hợp chất màu tím nên Z là lòng trắng trứng.
T thủy phân trong NaOH rồi tạo kết tủa với , nên T là phenylamoni clorua, T tác dụng với NaOH tạo phenol, phenol tạo kết tủa với .
X tác dụng với tạo phức xanh lam nên X là glixerol.
Câu 33:
Cho hỗn hợp gồm Mg và Fe có tỉ lệ mol tương ứng 2 : 1 vào 200 ml dung dịch chứa xM và yM. Sau khi kết thúc phản ứng, thu được dung dịch X và 13,84 gam rắn Y gồm hai kim loại. Cho dung dịch dư vào X, thấy lượng phản ứng là 91,8 gam; đồng thời thu được 75,36 gam kết tủa. Giá trị của x và y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
BT Ag:
Khối lượng kết tủa 75,36 gồm khối lượng AgCl, Ag
Bảo toàn điện tích trong dung dịch X:
Từ (1), (2), (3), (4):
Câu 34:
Hỗn hợp X gồm hai este đơn chức, hơn kém nhau một nguyên tử cacbon, trong phân tử đều chứa vòng benzen. Đốt cháy hoàn toàn 0,1 mol X, thu được 16,8 lít khí (đktc). Mặt khác, đun nóng 0,1 mol X trên với dung dịch KOH vừa đủ, cô cạn dung dịch sau phản ứng thu được 22,3 gam hỗn hợp rắn Y gồm các muối. Phần trăm khối lượng của muối có khối lượng phân tử lớn trong Y là
 Xem đáp án
Xem đáp án
Đáp án D
Hai este hơn kém nhau một nguyên tử cacbon nên số cacbon lần lượt là 7C và 8C.
Este có 7 cacbon:
Este có 8 cacbon:
TH1: Cả 2 este đều là este của phenol, khi tác dụng với KOH với tỉ lệ mol 1:2.
BTKL:
(chọn)
TH2: Chỉ có là este của phenol, còn có công thức:
BTKL: (loại)
Vậy hỗn hợp X gồm 2 este đều là este của phenol.
|
Ghi chú: - Phương pháp số nguyên tử cacbon hay hiđro trung bình giúp đơn giản hóa bài toán hỗn hợp chất hữu cơ, đặc biệt là bài toán về đồng đẳng, nhằm tìm nhanh một hoặc nhiều công thức hữu cơ. - Cần áp dụng triệt để phương pháp biện luận trong tìm công thức hợp chất hữu cơ vì không phải lúc nào ta cũng tìm được công thức một cách trực tiếp. |
Câu 35:
Cho từ từ đến dư dung dịch HCl vào 100 ml dung dịch gồm aM và NaOH bM. Đồ thị biểu diễn mối liên hệ giữa số mol tạo ra và số mol HCl được mô tả như hình vẽ sau:
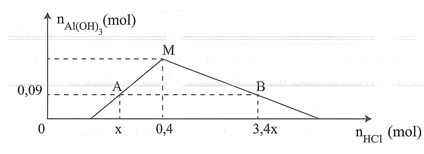
Tỉ lệ a : b gần nhất với số nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Tại M: kết tủa lớn nhất, thì
Lúc này số mol HCl là 0,4
Tại A: xảy ra (1) và (2)
Lúc này số mol HCl là
Tại B: kết tủa đã tan một phần, lượng kết tủa đã tan là:
Lúc này số mol HCl là
Từ (4), (5), (6)
Câu 36:
Điều chế este trong phòng thí nghiệm được mô tả theo hình vẽ sau:
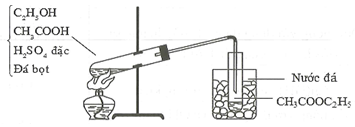
Cho các phát biểu sau:
(a) Etyl axetat có nhiệt độ sôi thấp (77C) nên dễ bị bay hơi khi đun nóng.
(b) đặc vừa làm chất xúc tác, vừa có tác dụng hút nước.
(c) Etyl axetat qua ống dẫn dưới dạng hơi nên cần làm lạnh bằng nước đá để ngưng tụ.
(d) Khi kết thúc thí nghiệm, cần tắt đèn cồn trước khi tháo ống dẫn hơi etyl axetat.
(e) Vai trò của đá bọt là để bảo vệ ống nghiệm không bị vỡ.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D
Những phát biểu đúng: (a), (b), (c), (d).
(d) đúng vì nếu chưa tắt đèn thì hơi este bay ra bắt lửa cháy.
(e) sai vì đá bọt có vai trò làm cho hỗn hợp sôi đều.
Câu 37:
Đốt cháy m gam hỗn hợp X gồm Cu và Fe trong 2,912 lít (đktc) hỗn hợp khí gồm và thu được (m + 6,11) gam hỗn hợp Y gồm các muối và oxit (không thấy khí thoát ra). Hòa tan hết Y trong dung dịch HCl, đun nóng thu được dung dịch Z chứa 2 muối. Cho dư vào dung dịch Z thu được 73,23 gam kết tủa. Mặt khác, hòa tan hết m gam hỗn hợp X trên trong dung dịch 31,5% thu được dung dịch T và 3,36 lít khí NO (sản phẩm khử duy nhất, đktc). Nồng độ C% của trong dung dịch T có giá trị gần nhất với
 Xem đáp án
Xem đáp án
Đáp án A
BT Cl:
Vì dung dịch Z chỉ chứa 2 muối nên đó là muối đồng và muối clorua của .
BT e:
|
Ghi chú: Đây là dạng bài toán khá quen thuộc của việc áp dụng kết hợp các định luật bảo toàn: bảo toàn electron, bảo toàn khối lượng, bảo toàn nguyên tố, bảo toàn điện tích. |
Câu 38:
Hợp chất hữu cơ E (chứa các nguyên tố C, H, O và tác dụng được với Na). Cho 44,8 gam E tác dụng với dung dịch NaOH vừa đủ thu được dung dịch F chỉ chứa hai chất hữu cơ X, Y. Cô cạn F thu được 39,2 gam chất X và 26 gam chất Y. Tiến hành hai thí nghiệm đốt cháy X, Y như sau:
- Thí nghiệm 1: Đốt cháy 39,2 gam X thu được 13,44 lít ở đktc; 10,8 gam và 21,2 gam .
- Thí nghiệm 2: Đốt cháy 26 gam Y thu được 29,12 lít ở đktc; 12,6 gam và 10,6 gam .
Biết E, X, Y đều có công thức phân tử trùng với công thức đơn giản nhất, các phản ứng xảy ra hoàn toàn.
Số công thức cấu tạo của E thỏa mãn các tính chất trên là
 Xem đáp án
Xem đáp án
Đáp án A
X có công thức phân tử trùng với công thức đơn giản nhất nên X là
Y có công thức phân tử trùng với công thức đơn giản nhất nên Y là
Vì nên E có công thức là:
E sẽ có 3 đồng phân (o, m, p)
|
Ghi chú: Cách lập công thức đơn giản nhất của hợp chất hữu cơ: |
Câu 39:
Tiến hành các thí nghiệm sau:
(a) Điện phân NaCl nóng chảy.
(b) Điện phân dung dịch (điện cực trơ).
(c) Cho mẫu K vào dung dịch .
(d) Cho Fe vào dung dịch .
(e) Cho Ag vào dung dịch HCl.
(f) Cho Cu vào dung dịch hỗn hợp và .
Số thí nghiệm thu được chất khí là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 40:
X, Y là hai peptit mạch hở hơn kém nhau một liên kết peptit, Z là este của . Đốt cháy hoàn toàn 43,75 gam hỗn hợp E chứa X, Y, Z thu được 3,5 mol hỗn hợp và . Nếu đun nóng 0,3 mol E trên cần dùng dung dịch chứa 22,0 gam NaOH, thu được ancol etylic và 55,03 gam hỗn hợp T gồm ba muối của glyxin, alanin và valin. Phần trăm khối lượng của peptit có khối lượng phân tử nhỏ trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Đáp án B
Từ (1), (2), (3), (4)
nên este Z có công thức
nên X, Y là tripeptit và tetrapeptit
|
Ghi chú: Những điểm cần nắm khi làm bài tập này: - Đề sử dụng lượng chất khác nhau cho các phản ứng nên cần quy đổi tỉ lệ. - Sử dụng một số cách tính số gốc amino axit hay số để biện luận. tính số gốc amino axit trung bình. Biện luận số bằng cách xem hỗn hợp peptit là |
