20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án ( Đề 13)
-
4529 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Dung dịch A có sẽ có môi trường
 Xem đáp án
Xem đáp án
|
Môi trường kiềm
|
Môi trường trung tính | Môi trường Axit |
Dung dịch A có ® môi trường axit.
Chọn đáp án B.
Câu 3:
Khí khá trơ ở nhiệt độ thường là do
 Xem đáp án
Xem đáp án
Khí khá trơ ở nhiệt độ thường là do: trong phân tử chứa liên kết ba rất bền.
Chọn đáp án D.
Câu 4:
Trong các phản ứng sau, phản ứng nào không thể hiện tính khử?
 Xem đáp án
Xem đáp án
Lưu ý: Những phản ứng mà thể hiện tính khử là những phản ứng N tăng số oxi hóa lên.
A. Số oxi hóa của nitơ tăng từ lên .
B. N ở hai vế phương trình vẫn giữ nguyên số oxi hóa là -3
C. Số oxi hóa của nitơ tăng từ lên .
D. Số oxi hóa của nitơ tăng từ lên .
Chọn đáp án B.
Câu 5:
Nung nóng m gam bột sắt ngoài không khí, sau phản ứng thu được 36 gam hỗn hợp X gồm và . Hòa tan hết X trong dung dịch loãng thu được 5,6 lít hỗn hợp khí Y gồm NO và có tỉ khối so với là 19. Giá trị m là
 Xem đáp án
Xem đáp án
Sơ đồ phản ứng:
Theo đề ra ta có: .
Gọi số mol Fe và O tương ứng trong X là x và y ta có:
Quá trình nhường và nhận e:
| Chất khử | Chất oxi hoá |
Tổng electron nhường: 3x (mol)
Tổng electron nhận:
Áp dụng định luật bảo toàn electron ta có:
Từ (*) và (**) ta có hệ
Giải hệ trên ta có: .
Như vậy .
Chọn đáp án C.
Câu 6:
Cacbon vô định hình và than chì là hai dạng thù hình của nhau vì
 Xem đáp án
Xem đáp án
Than chì và than vô định hình là các dạng thù hình của cacbon.
Chọn đáp án B.
Câu 7:
 Xem đáp án
Xem đáp án
Theo bảo toàn nguyên tố Fe, bảo toàn electron và bảo toàn khối lượng, ta có:
Theo giả thiết, theo bảo toàn electron trong phản ứng của C với và phản ứng của với , ta có:
Giải ra ta được:
Vậy giá trị của V là: .
Chọn đáp án B.
Câu 8:
Ankan Y phản ứng với clo tạo ra 2 dẫn xuất monoclo có tỉ khối hơi so với bằng 39,25.
Tên của Y là Xem đáp án
Xem đáp án
+ Vì khối lượng mol của dẫn xuất monoclo tạo ra từ Y đã biết, nên dễ dàng tìm được số nguyên tử C của Y và tên gọi của nó.
+ Phương trình phản ứng:
+ ® Y là (propan)
+ Phản ứng tạo ra hai dẫn xuất monoclo:
Chọn đáp án B.
Câu 9:
Đốt cháy hoàn toàn một hợp chất hữu cơ X (C, H, N) bằng lượng không khí vừa đủ (gồm 1/5 thể tích , còn lại là ) được khí , và . Cho toàn bộ sản phẩm cháy qua bình đựng dung dịch dư thấy có 39,4 gam kết tủa, khối lượng dung dịch giảm đi 24,3 gam. Khí thoát ra khỏi bình có thể tích 34,72 lít (đktc). Biết . Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Số mol
Khối lượng dung dịch giảm:
Số mol khí bay ra khỏi bình là ® Số mol có trong hợp chất hữu cơ X là:
Gọi công thức của X là
® Tỉ lệ ® Công thức đơn giản nhất của X có dạng:
® X là .
Chọn đáp án A.
Câu 10:
Nung nóng 100 gam hỗn hợp gồm và cho đến khối lượng không đổi còn lại 69 gam chất rắn. Thành phần % khối lượng mỗi chất trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Phương trình nhiệt phân:
không bị nhiệt phân.
Khối lượng giảm là khối lượng và :
Chọn đáp án B.
Câu 11:
Dẫn luồng khí CO qua hỗn hợp (nóng) sau khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm
 Xem đáp án
Xem đáp án
Quá trình phản ứng
Chọn đáp án C.
Câu 12:
Có hai dung dịch, mỗi dung dịch đều chứa hai cation và hai anion không trùng nhau trong các ion sau:
và . Một trong hai dung dịch trên chứa
 Xem đáp án
Xem đáp án
Theo định luật bảo toàn điện tích:
số mol. åđiện tích (+) = số mol. åđiện tích (-)
Ta áp dụng cho 4 phương án lựa chọn:
+)
số mol. åđiện tích (+) = 0,15 + 2. 0,1 = 0,35 mol
số mol. åđiện tích (-) = 2. 0,075 + 0,1 = 0,25 mol
® không thỏa mãn.
Tương tự với 3 phương án còn lại ® chỉ có trường hợp dung dịch chứa: là thỏa mãn.
Chọn đáp án B.
Câu 13:
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 14:
Trong các phản ứng của Si với đặc nóng, dung dịch NaOH, Mg. Số phản ứng mà trong đó Si thể hiện tính oxi hóa là
 Xem đáp án
Xem đáp án
(tính oxi hóa)
® có 1 phản ứng trong đó Si thể hiện tính oxi hóa.
Chọn đáp án D.
Câu 15:
Oxi hoá hết 2,2 gam hỗn hợp hai ancol đơn chức thành anđehit cần vừa đủ 4,8 gam CuO . Cho toàn bộ lượng anđehit trên tác dụng với lượng dư dung dịch trong , thu được 23,76 gam Ag. Hai ancol lần lượt là :
 Xem đáp án
Xem đáp án
Giả sử không có anđehit fomic:
Theo đề bài: . Vậy có HCHO
Theo đề bài ra ta có hệ:
Vậy 2 ancol ban đầu là .
Chọn đáp án A.
Câu 16:
Thực hiện các thí nghiệm sau đây:
(1) Sục khí vào dung dịch .
(2) Cho vào dung dịch .
(3) Chiếu sáng hỗn hợp khí metan và clo.
(4) Cho glucozơ tác dụng với ở điều kiện thường.
(5) Đun etanol với đặc ở .
(6) Đun nóng hỗn hợp triolein và hiđro (với xúc tác Ni).
(7) Cho phenol tác dụng với dung dịch NaOH.
(8) Cho anilin tác dụng với dung dịch brom.
(9) Cho metyl amin tác dụng với dung dịch .
(10) Cho glixerol tác dụng với Na.
Những thí nghiệm xảy ra phản ứng oxi hoá - khử là
 Xem đáp án
Xem đáp án
Số thí nghiệm xảy ra phản ứng oxi hóa - khử là các thí nghiệm:
(1) Sục khí vào dung dịch .
(3) Chiếu sáng hỗn hợp khí metan và clo.
(6) Đun nóng hỗn hợp triolein và hiđro (với xúc tác Ni).
(8) Cho anilin tác dụng với dung dịch brom.
(10) Cho glixerol tác dụng với Na.
Chọn đáp án A.
Câu 17:
Este X đơn chức tác dụng với NaOH đun nóng thu được muối Y có công thức phân tử là và rượu . Oxi hóa bằng CuO nung nóng thu được anđehit . tác dụng với dư, đun nóng thu được số mol Ag gấp 4 lần số mol . Vậy tên gọi của X là
 Xem đáp án
Xem đáp án
Este X đơn chức tác dụng với NaOH đun nóng ® phương trình phản ứng như sau
® Anđehit là HCHO ® Ancol là .
® Công thức cấu tạo của este là : metyl propionat.
Chọn đáp án B.
Câu 18:
Dung dịch X chứa 0,01 mol ; 0,02 mol ; 0,05 mol . Cho dung dịch X tác dụng với 160 ml dung dịch KOH 1M đun nóng để phản ứng xảy ra hoàn toàn. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Số mol
Khối lượng chất rắn thu được là:
Chọn đáp án A.
Câu 19:
Trung hoà hoàn toàn 8,88 gam một amin (bậc một, mạch cacbon không phân nhánh) bằng axit HCl, tạo ra 17,64 gam muối. Amin có công thức là
 Xem đáp án
Xem đáp án
Gọi amin có công thức
Áp dụng định luật bảo toàn khối lượng ta có:
· Với
® Loại.
· Với
Chọn đáp án D.
Câu 20:
 Xem đáp án
Xem đáp án
A. Tinh bột là polime có cấu trúc dạng mạch phân nhánh và không phân nhánh.
Đúng. Tinh bột có hai thành phần. Thành phần không phân nhánh là aminozơ, thành phần phân nhánh là aminopectin
B. Tinh bột không tan trong nước lạnh. Trong nước nóng từ trở lên, tinh bột chuyển thành dung dịch keo nhớt.
Đúng.Theo SGK lớp 12
C. Tinh bột không phản ứng với dung dịch loãng, đun nóng.
Sai. Đây là phản ứng thủy phân tinh bột cho glucozơ.
D. Etanol có thể được sản xuất bằng phương pháp lên men các nông sản chứa nhiều tinh bột. Đúng. Theo SGK lớp 12
Câu 21:
Thủy phân hoàn toàn 7,02 gam hỗn hợp X gồm glucozơ và saccarozơ trong dung dịch thu được dung dịch Y. Trung hòa hết lượng axit dư trong dung dịch Y rồi cho phản ứng ứng hoàn toàn với lượng dư dung dịch trong thì thu được 8,64 gam Ag. Thành phần % về khối lượng của saccarozơ trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Chọn đáp án D.
Câu 22:
Tiến hành hai thí nghiệm sau:
- Thí nghiệm 1:
Bước 1: Cho vào ống nghiệm 1 giọt dung dịch bão hòa + 2 ml dung dịch NaOH 30%.
Bước 2: Lắc nhẹ, gạn lớp dung dịch để giữ kết tủa.
Bước 3: Thêm khoảng 4 ml lòng trắng trứng vào ống nghiệm, dùng đũa thủy tinh khuấy đều.
- Thí nghiệm 2:
Bước 1: Lấy khoảng 4 ml lòng trắng trứng cho vào ống nghiệm.
Bước 2: Nhỏ từng giọt khoảng 3 ml dung dịch bão hòa.
Bước 3: Thêm khoảng 5 ml dung dịch NaOH 30% và khuấy đều.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
A. Đúng, Vì tốc độ phản ứng tăng khi nhiệt độ tăng.
B. Đúng, Vì lòng trắng trứng có phản ứng màu biure với cho dung dịch có màu xanh tím.
C. Sai, Vì khi nhỏ vào ống nghiệm chỉ có lòng trắng trứng nên không có phản ứng gì.
D. Đúng, VìCâu 23:
Cho các polime sau: Tơ tằm, tơ visco, tơ axetat, tơ nitron, cao su buna-S, poli vinylclorua, poli vinylaxetat, nhựa novolac. Số polime có chứa nguyên tố oxi trong phân tử là
 Xem đáp án
Xem đáp án
Tơ tằm, tơ visco, tơ axetat, poli vinylaxetat, nhựa novolac.
Tơ tằm: tơ tằm là 1 loại protein thiên nhiên được cấu tạo từ các aminoaxit do đó có O.
Tơ Visco: là tơ bán tổng hợp (nhân tạo) là sản phẩm của xenlulozơ với và NaOH có O.
Tơ nitron hay olon:
Tơ axetat:
Cao su buna - S là sản phẩm đồng trùng hợp: và .
Tơ PVC:
Poli vinylaxetat:
Nhựa novolac: Đun nóng hỗn hợp HCHO với dư xúc tác axit.
Chọn đáp án B.
Câu 24:
Cho m gam hỗn hợp X gồm Na và K (tỉ lệ mol 1:1) vào 500 ml dung dịch chứa hỗn hợp gồm 0,5M và 1M sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cho dung dịch Y tác dụng với 1,5 lít dung dịch HCl 1M, sau khi phản ứng xảy ra hoàn toàn thu được 23,4 gam kết tủa. Giá trị nhỏ nhất của m là
 Xem đáp án
Xem đáp án
Ta có:
Dung dịch Z gồm:
Khối lượng Na, K đã dùng có giá trị nhỏ nhất khi xảy ra hiện tượng hòa tan một phần kết tủa ở phản ứng (2). Theo bảo toàn nguyên tố Al, gốc và bảo toàn điện tích trong dung dịch Z, ta có:
Giải ra ta có:
.
Chọn đáp án C.
Câu 25:
Nhúng một thanh Al nặng 20 gam vào 400 ml dung dịch 0,5M. Khi nồng độ dung dịch giảm 25% thì lấy thanh Al ra khỏi dung dịch, giả sử tất cả Cu thoát ra bám vào thanh Al. Khối lượng thanh Al sau phản ứng là
 Xem đáp án
Xem đáp án
Từ phản ứng:
Ta thấy:
Cứ 3 mol phản ứng thì khối lượng thanh Al tăng:
Theo đề bài, có phản ứng ® thanh Al tăng :
Do đó, khối lượng thanh Al sau phản ứng là : 20 + 2,3 = 22,3 gam.
Chọn đáp án D.
Câu 26:
Điện phân 100 ml dung dịch 0,2M với cường độ dòng điện 9,65A. Biết hiệu suất điện phân là 100%. Khối lượng Cu bám vào catot khi thời gian điện phân và là
 Xem đáp án
Xem đáp án
Ta có:
Thời gian cần thiết đề điện phân hết là:
® Tại có ½ số mol bị điện phân ® .
® Tại : đã bị điện phân hết ® .
Chọn đáp án C.
Câu 27:
Cho 2 phản ứng sau:
(1)
(2)
Kết luận nào dưới đây là đúng?
 Xem đáp án
Xem đáp án
Sắp xếp tính oxi hóa giảm dần là: .
Chọn đáp án B.
Câu 28:
Hoà tan một lượng Fe vào dung dịch loãng thấy thoát ra , lít khí . Mặt khác nếu hoà tan cùng một lượng Fe trên vào dung dịch đặc nóng thấy thoát ra lít khí (các thể tích đo ở cùng điều kiện). Mối quan hệ giữa và là
 Xem đáp án
Xem đáp án
Giả sử có 1 mol Fe:
Phần 1: phản ứng với :
(1)
Phần 2: Phản ứng với đặc nóng:
(2)
Từ phương trình (1) và (2) ta rút ra tỉ lệ:
Chọn đáp án D.
Câu 29:
Nung m gam bột sắt trong oxi, thu được 4,5 gam hỗn hợp chất rắn X. Hòa tan hết hỗn hợp X trong dung dịch đặc nóng (dư) thoát ra 1,26 lít (đktc) (là sản phẩm khử duy nhất).
Giá trị của m là
 Xem đáp án
Xem đáp án
Quy đổi hỗn hợp X thành (Fe, O)
Đặt:
Chọn đáp án A.
Câu 30:
Cho m gam hỗn hợp bột X gồm , CuO và Cu (x, y nguyên dương) vào 600 ml dung dịch HCl 1M, thu được dung dịch Y (không chứa HCl) và còn lại 6,4 gam kim loại không tan. Cho Y tác dụng với lượng dư dung dịch , thu được 102,3 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
+ Nhận thấy: có Cu dư nên Y muối sắt trong Y chỉ có thể là .
+ Ta có
+
+
Chọn đáp án C.
Câu 31:
Cho hình sau:
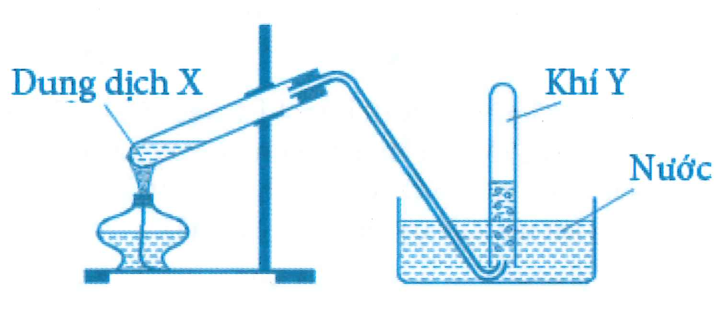
Hình vẽ trên mô tả thí nghiệm điều chế khí nào sau đây
 Xem đáp án
Xem đáp án
Với mô hình thí nghiệm trên chỉ có là hợp lý vì:
+ Với khí người ta điều chế từ hoặc chứ không thể đun dung dịch X.
+ Với :
+ Với tan rất nhiều trong nước nên không thể thu được khí Y.
+ Với được điều chế bằng cách đun với (đ/n).
Chọn đáp án C.
Câu 32:
Trong khi làm các thí nghiệm ở lớp hoặc trong các giờ thực hành hóa học có một số khí thải: . Biện pháp đúng dùng để khử các khí trên là
 Xem đáp án
Xem đáp án
Biện pháp để khử các khí trên là dùng bông tẩm xút hoặc nước vôi trong nút ngay ống nghiệm sau khi đã quan sát hiện tượng.
Chọn đáp án C.
Câu 33:
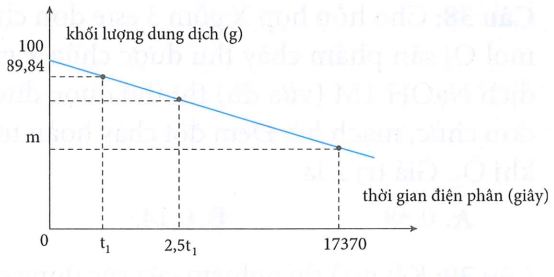
Tiến hành điện phân 100g dung dịch chứa (7x mol) và (10x mol) (có màng ngăn) với cường độ dòng điện 5A, khối lượng dung dịch trong quá trình điện phân thay đổi theo thời gian được biểu diễn bằng đồ thị sau:
Khi điện phân tới thời điểm giây khi khí bắt đầu thoát ra tại catot thì tạm dừng điện phân, sau thêm một lượng dung dịch vào rồi điện phân tiếp tới thời điểm 17370 giây thì kết thúc quá trình điện phân, lấy màng ngăn ra; để yên dung dịch một thời gian thì khối lượng dung dịch còn lại m gam.
Giá trị của m là
 Xem đáp án
Xem đáp án
Tại :
Tại : và điện phân hết
Tại 17370 giây:
Chọn đáp án A.
Câu 34:
Cho 31,15 gam hỗn hợp bột Zn và Mg (tỷ lệ mol 1 : 1) tan hết trong dung dịch hỗn hợp gồm và thu được dung dịch A chỉ chứa m gam hỗn hợp các muối và 4,48 lít (đktc) hỗn hợp khí B gồm và . Khí B có tỷ khối so với bằng 11,5. m gần giá trị nào nhất?
 Xem đáp án
Xem đáp án
Ta có: Chọn đáp án A.
Câu 35:
Cho các phát biểu sau:
(a) Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do sự đông tụ của protein do nhiệt độ.
(b) Dầu ăn và mỡ bôi trơn có cùng thành phần nguyên tố.
(c) Cao su có tính đàn hồi, không dẫn điện, không dẫn nhiệt.
(d) Muối mono natri của axit glutamic được dùng làm mì chính.
(e) Khi ăn cơm, nếu nhai kĩ sẽ thấy có vị ngọt là do tinh bột trong cơm bị thủy phân thành glucozơ.
(g) Khi bị ong đốt, để giảm đau nhức có thể bôi vôi tôi vào vết đốt.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Các phát biểu đúng là:
(a) Khi nấu canh cua thì thấy các mảng “riêu cua” nổi lên là do sự đông tụ của protein do nhiệt độ.
(c) Cao su có tính đàn hồi, không dẫn điện, không dẫn nhiệt.
(d) Muối mono natri của axit glutamic được dùng làm mì chính.
(e) Khi ăn cơm, nếu nhai kĩ sẽ thấy có vị ngọt là do tinh bột trong cơm bị thủy phân thành glucozơ.
(g) Khi bị ong đốt, để giảm đau nhức có thể bôi vôi tôi vào vết đốt.
Chọn đáp án C.
Câu 36:
Tiến hành các thí nghiệm sau:
(a) Cho dung dịch HCl vào dung dịch .
(b) Cho kim loại Be vào .
(c) Cho kim loại Al vào dung dịch loãng nguội.
(d) tác dụng với nước có mặt oxi.
(e) Clo tác dụng sữa vôi ( ).
(g) Lấy thanh Fe ngâm trong dung dịch đặc nguội, rồi lấy ra cho tiếp vào dung dịch HCl loãng.
Số thí nghiệm có phản ứng oxi hóa - khử xảy ra là
 Xem đáp án
Xem đáp án
(a) Cho dung dịch HCl vào dung dịch
Chuẩn:
(b) Cho kim loại Be vào .
Không có phản ứng
(c) Cho kim loại Al vào dung dịch loãng nguội.
Không có phản ứng.
(8) tác dụng với nước có mặt oxi.
Chuẩn:
(9) Clo tác dụng sữa vôi .
Chuẩn:
(10) Lấy thanh Fe ngâm trong dung dịch đặc nguội, rồi lấy ra cho tiếp vào dung dịch HCl loãng.
Chuẩn: .
Chọn đáp án A.
Câu 37:
Cho X, Y là hai axit cacboxylic đơn chức mạch hở ; T là este hai chức tạo bởi X, Y và một ancol no mạch hở Z. Đốt cháy hoàn toàn 6,88 gam hỗn hợp E gồm X, Y, T bằng một lượng vừa đủ , thu được 5,6 lít (đktc) và 3,24 gam nước. Mặt khác 6,88 gam E tác dụng với dung dịch dư thu được 12,96 gam Ag. Khối lượng rắn khan thu được khi cho cùng lượng E trên tác dụng với 150 ml dung dịch KOH 1M là
 Xem đáp án
Xem đáp án
Do hỗn hợp E phản ứng tráng bạc ® X là HCOOH và este T có gốc HCOO-.
Theo bài ra ta có:
Áp dụng ĐLBTNT.O:
Mặt khác:
Axit Y có tổng số liên kết p là k ® Tổng số liên kết p trong este T là k + 1
Áp dụng điều kiện: .
Ta chọn
Ta chọn
T là .
Z là
Áp dụng ĐLBTKL cho quá trình:
Chọn đáp án C.
Câu 38:
Cho hỗn hợp X gồm 3 este đơn chức. Đem đốt cháy m gam X thì cần vừa đủ 0,465 mol sản phẩm cháy thu được chứa x mol . Thủy phân m gam X trong 90 ml dung dịch NaOH 1M (vừa đủ) thì thu được được 8,86 gam hỗn hợp muối Y và một ancol Z no đơn chức, mạch hở. Đem đốt cháy hoàn toàn hỗn hợp muối Y thì cần dùng 7,392 lít (đktc) khí . Giá trị x là
 Xem đáp án
Xem đáp án
Bài toán mới nhìn qua có vẻ khá lạ vì X có tới 3 este mà không có chút manh mối nào về công thức phân tử. Tuy nhiên, các bạn hãy chú ý rằng việc cho thêm NaOH vào X rồi đem đốt cháy sẽ không làm ảnh hưởng tới lượng cần dùng.
Ta có:
Theo chú ý bên trên ta suy ra số mol cần để đốt cháy ancol là:
Như vậy, ta sẽ có:
Câu 39:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
| Mẫu thử | Thuốc thử | Hiện tượng |
| X | Quỳ tím | Quỳ tím hoá đỏ |
| Y | Dung dịch xanh lam | |
| X,Z | Dung dịch trong dư, đun nóng | Kết tủa Ag trắng sáng |
| T | Nước | Kết tủa trắng |
Các dung dịch X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Axit focmic làm quỳ tím chuyển sang màu đỏ.
Glixerol tác dụng với dung dịch Þ tạo dung dịch có màu xanh lam.
Anđehit axetic tác dụng dung dịch trong dư, đun nóng Þ kết tủa Ag trắng sáng.
Phenol tác dụng với dung dịch nước brom Þ sau phản ứng tạo kết tủa trắng.
Chọn đáp án C.
Câu 40:
Cho hỗn hợp X gồm hai chất hữu cơ có cùng công thức phân tử tác dụng vừa đủ với dung dịch NaOH đun nóng, thu được dung dịch Y và 4,48 lít hỗn hợp Z (ở đktc) gồm hai khí (đều làm xanh giấy quỳ ẩm). Tỉ khối hơi của Z đối với bằng 13,75. Cô cạn dung dịch Y thu được khối lượng muối khan là
 Xem đáp án
Xem đáp án
Ta có:
X phản ứng với dung dịch NaOH giải phóng hỗn hợp khí Z gồm hai chất khí đều làm xanh giấy quỳ ẩm, suy ra X gồm hai muối amoni. Do trong phân tử có 2 nguyên tử O nên các muối amoni có gốc axit là RCOO-.
Vì nên Z chứa một chất là , chất còn lại là amin. Do các muối amoni chỉ có 2 nguyên tử C và gốc axit phải có ít nhất 1 nguyên tử C nên amin là . Suy ra X gồm
Suy ra:
Trong Y chứa . Khi cô cạn dung dịch Y thu được khối lượng muối khan là:
Chọn đáp án B.
