20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
20 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án ( Đề 19)
-
4535 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Este vinyl axetat có công thức là
 Xem đáp án
Xem đáp án
CH3COOCH=CH2: vinyl axetat.
CH3COOCH3: metyl axetat.
CH2=CHCOOCH3: metyl acrylat.
HCOOCH3: metyl fomat.
Chọn đáp án A.
Câu 2:
Hợp chất nào sau đây thuộc loại đipeptit?
 Xem đáp án
Xem đáp án
Đipeptit là phân tử tạo bởi 2 gốc a-amino axit
® Đipeptit phù hợp là NH2-CH2-CONH-CH(CH3)-COOH.
Chọn đáp án B.
Câu 3:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Đúng.
B. Sai, do peptit có từ 2 liên kết peptit trở lên (tripeptit trở lên) mới có phản ứng màu biure.
C. Sai, do trong một phân tử tetrapeptit mạch hở có 3 liên kết peptit.
D. Sai, do các hợp chất peptit kém bền trong cả môi trường kiềm và môi trường axit.
Chọn đáp án A.
Câu 4:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
A. Sai, do saccarozơ không làm mất màu nước brom.
B. Sai, do xenlulozơ có cấu tạo mạch không phân nhánh.
C. Đúng.
D. Sai, do glucozơ bị oxi hóa bởi dung dịch AgNO3 trong NH3.
Chọn đáp án C.
Câu 5:
Cho các vật liệu polime sau: bông, tơ tằm, thủy tinh hữu cơ, nhựa PVC, tơ axetat, tơ visco, xenlulozơ và len. Số lượng polime thiên nhiên là
 Xem đáp án
Xem đáp án
Các vật liệu là polime thiên nhiên là: bông, tơ tằm, xenlulozơ và len.
Chọn đáp án D.
Câu 6:
Trong các polime: polistiren, amilozơ, amilopectin, poli(vinyl clorua), tơ capron, poli(metyl metacrylat) và teflon. Những polime có thành phần nguyên tố giống nhau là:
 Xem đáp án
Xem đáp án
Những polime có thành phần nguyên tố giống nhau là: amilozơ, amilopectin, poli(metyl metacrylat) do cùng có thành phần gồm các nguyên tố C, H, O.
Chọn đáp án D.
Câu 7:
Cho các kim loại: Cu, Ag, Fe, Al, Au. Độ dẫn điện của chúng giảm dần theo thứ tự:
 Xem đáp án
Xem đáp án
Độ dẫn điện của chúng giảm dần theo thứ tự: Ag > Cu > Au > Al > Fe.
Chọn đáp án A.
Câu 8:
Kim loại Al không phản ứng được với dung dịch
 Xem đáp án
Xem đáp án
Kim loại Al, Fe bị thụ động trong HNO3 đặc, nguội, H2SO4 đặc nguội. Nên kim loại Al không phản ứng được với dung dịch H2SO4 (đặc, nguội).
Chọn đáp án D.
Câu 10:
Chất rắn X màu lục thẫm, tan trong dung dịch HCl được dung dịch A. Cho A tác dụng với NaOH và Br2 được dung dịch màu vàng, cho dung dịch H2SO4 vào lại thu được dung dịch màu da cam. Chất rắn X là:
 Xem đáp án
Xem đáp án
X là Cr2O3 là chất rắn màu lục thẫm
Màu vàng màu da cam
Chọn đáp án A.
Câu 11:
Để điều chế 2 lít NH3 từ N2 và H2 với hiệu suất 25% thì thể tích N2 cần dùng ở cùng điều kiện là
 Xem đáp án
Xem đáp án
Phương trình phản ứng
Hiệu xuất đạt 25% nên số mol N2 thực tế cần dùng là:
Câu 12:
 Xem đáp án
Xem đáp án
Người ta có thể sử dụng nước đá khô (CO2 rắn) để tạo môi trường lạnh và khô trong việc bảo quản thực phẩm và hoa quả tươi. Do nước đá khô có khả năng thăng hoa ở nhiệt độ thường.
Chọn đáp án B.
Câu 13:
Ankan Y phản ứng với clo tạo ra 2 dẫn xuất monoclo có tỉ khối hơi so với H2 bằng 39,25. Tên của Y là:
 Xem đáp án
Xem đáp án
Câu 14:
Cho sơ đồ chuyển hoá sau:
C3H4O2 + NaOH ® X + Y X + H2SO4 loãng ® Z + T
Biết Y và Z đều có phản ứng tráng gương. Hai chất Y, Z tương ứng là
 Xem đáp án
Xem đáp án
Phương trình phản ứng:
HCOOCH=CH2 + NaOH ® HCOONa + CH3CHO
2HCOONa + H2SO4 ® 2HCOOH + Na2SO4
Chọn đáp án B.
Câu 15:
Cho các chất sau: axetilen, axit oxalic, axit acrylic, fomanđehit, phenyl fomat, vinyl axetilen, glucozơ, anđehit axetic, metyl axetat, saccarozơ, natri fomat. Số chất có thể tham gia phản ứng tráng gương là
 Xem đáp án
Xem đáp án
Có 5 chất tham gia phản ứng tráng gương là: fomanđehit, phenyl fomat, glucozơ, anđehit axetic, natri fomat.
Chọn đáp án D.
Câu 16:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Phát biểu đúng là “Dung dịch hỗn hợp HCl và KNO3 hoà tan được bột đồng”
8H+ + 2 + 3Cu ® 3Cu2+ + 2NO + 4H2O
Chọn đáp án D.
Câu 17:
Hoà tan hỗn hợp gồm Zn, Cu, Fe, Cr vào dung dịch HCl có sục khí oxi dư thu được dung dịch X. Cho dung dịch NH3 dư vào X thu được kết tủa Y. Nung Y trong chân không hoàn toàn được chất rắn Z. Chất rắn Z gồm:
 Xem đáp án
Xem đáp án
Chọn đáp án C.
Câu 18:
Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch:
CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có thể tạo kết tủa là:
 Xem đáp án
Xem đáp án
Có 6 trường hợp có thể tạo kết tủa là:
NaOH; Na2CO3, KHSO4; Na2SO4; Ca(OH)2 ;H2SO4.
Chọn đáp án B.
Câu 19:
Cho hình vẽ mô tả thí nghiệm điều chế khí X bằng cách cho dung dịch Y tác dụng với chất rắn Z. Hình vẽ bên không minh họa phản ứng nào sau đây?
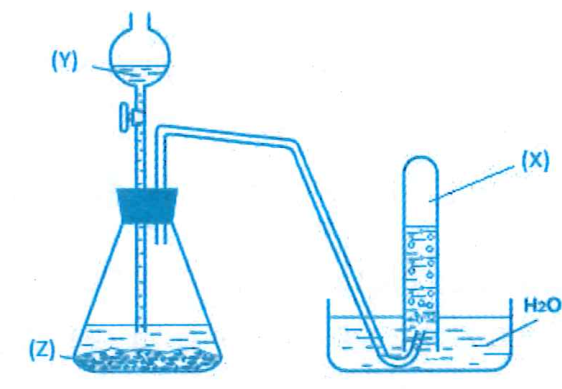
 Xem đáp án
Xem đáp án
Do NH3 tan nhiều trong nước nên không thể thu bằng phương pháp đẩy nước.
Chọn đáp án D.
Câu 20:
Khí biogas sản xuất từ chất thải chăn nuôi được sử dụng làm nguồn nhiên liệu trong sinh hoạt ở nông thôn. Tác dụng của việc sử dụng khí biogas là
 Xem đáp án
Xem đáp án
Khí biogas sản xuất từ chất thải chăn nuôi được sử dụng làm nguồn nhiên liệu trong sinh hoạt ở nông thôn. Tác dụng của việc sử dụng khí biogas là đốt để lấy nhiệt và giảm thiểu ô nhiễm môi trường.
Nhờ ứng dụng này, người nông dân tận dụng những chất thải của con vật, mùa màng làm cải thiện môi trường và giúp người nông dân ít phải mua chất đốt.
Chọn đáp án C.
Câu 21:
Trộn lẫn 200ml dung dịch H2SO4 0,05M với 300ml dung dịch HCl 0,1M ta được dung dịch D. Lấy 150ml dung dịch D trung hòa bởi 50ml dung dịch KOH. Tính nồng độ dung dịch KOH đem dùng.
 Xem đáp án
Xem đáp án
Ta có:
Vậy
Chọn đáp án B.
Câu 22:
Nung nóng 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khối lượng không đổi còn lại 69 gam chất rắn. Thành phần % khối lượng mỗi chất trong hỗn hợp ban đầu là:
 Xem đáp án
Xem đáp án
Na2CO3 không bị nhiệt phân.
Khối lượng giảm là khối lượng H2O và CO2:
Câu 23:
Thuỷ phân hoàn toàn 3,42 gam saccarozơ trong môi trường axit, thu được dung dịch X. Cho toàn bộ dung dịch X phản ứng hết với lượng dư dung dịch AgNO3 trong NH3, đun nóng, thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Khối lượng:
Chọn đáp án C.
Câu 24:
Hòa tan a gam crom trong dung dịch H2SO4 loãng, nóng thu được dung dịch X và 3,36 lit khí (đktc). Cho X tác dụng với dung dịch NaOH dư trong không khí đến khối lượng không đổi. Lọc, đem nung đến khối lượng không đổi thì lượng chất rắn thu được là
 Xem đáp án
Xem đáp án
Ta có:
Khối lượng oxit là
Câu 25:
Hỗn hợp A gồm X, Y (MX < MY) là 2 este đơn chức có chung gốc axit. Đun nóng m gam A với 400 ml dung dịch KOH 1M dư thu được dung dịch B và (m - 12,6) gam hỗn hợp hơi gồm 2 anđehit no, đơn chức đồng đẳng kế tiếp có tỉ khối hơi so với H2 là 26,2. Cô cạn dung dịch B thu được (m + 6,68) gam chất rắn khan. % khối lượng của X trong A là
 Xem đáp án
Xem đáp án
Áp dụng định luật bảo toàn khối lượng ta có:
và
Số mol KOH dư
Khối lượng muối axit là:
Câu 26:
Hỗn hợp X gồm chất Y (C2H8N2O4) và chất Z (C4H8N2O3); trong đó Y là muối của axit đa chức, Z là đipeptit mạch hở. Cho 25,6 gam X tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,2 mol khí. Mặt khác 25,6 gam X tác dụng với dung dịch HCl dư, thu được m gam chất hữu cơ. Giá trị của m là:
 Xem đáp án
Xem đáp án
Ta có:
Câu 27:
Đốt 0,1 mol hỗn hợp A gồm một a-aminoaxit (X) no mạch hở chứa 1 nhóm-NH2, 1 nhóm - COOH, X-X và X-X-X cần 27,048 lít oxi (đktc). Khi đun nóng 0,1 mol hỗn hợp A với dung dịch NaOH vừa đủ thu được dung dịch chứa chất tan có khối lượng lớn hơn khối lượng hỗn hợp A ở trên là 7,4 gam. Khối lượng của 2,016 mol hỗn hợp A là:
 Xem đáp án
Xem đáp án
Quy đổi 0,1 mol hỗn hợp A thành
Câu 28:
Một hỗn hợp X gồm 2 hiđrocacbon A, B thuộc cùng 1 dãy đồng đẳng (đều ở thể khí ở đktc). Để đốt cháy hết X cẩn dùng vừa đủ 20,16 lit O2 (đktc) và phản ứng tạo ra 7,2 gam H2O. Khi cho lượng hỗn hợp X trên tác dụng với lượng dư AgNO3 trong dung dịch NH3 thu được 62,7 gam kết tủa. Công thức cấu tạo của A, B là
 Xem đáp án
Xem đáp án
Do A, B tác dụng với AgNO3/ NH3 thu được kết tủa ® A, B là ankin.
Công thức chung của 2 ankin:
® Mặt khác các hiđrocacbon ở thể khí ® Có 2 cặp nghiệm thỏa mãn
Xét trường hợp:
gam kết tủa ® hợp lý
® Hai ankin là C2H2, C3H4.
Chọn đáp án D.
Câu 29:
Tiến hành nhiệt phân hoàn toàn m gam hỗn hợp X gồm Cu(NO3)2 và Cu trong một bình kín, thu được chất rắn Y có khối lượng (m - 7,36) gam. Cho toàn bộ chất rắn Y tác dụng với dung dịch H2SO4 đặc nóng dư đến khi phản ứng xảy ra hoàn toàn thu được 0,672 lít SO2 (đktc) là sản phẩm khử duy nhất. Giá trị m là:
 Xem đáp án
Xem đáp án
Do Y + H2SO4 có SO2 nên Y chứa Cu dư, do đó khối lượng giảm là khối lượng của NO2 (0,16 mol)
Có ngay:
Chọn đáp án C.
Câu 30:
Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau.
- Phần 1: Tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2.
- Phần 2: Phản ứng với dung dịch NaOH dư, thu được a mol khí H2.
Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Vì các phản ứng hoàn toàn, Y tác dụng với dung dịch NaOH dư thu được H2 nên trong Y có Al dư.
Ta có:
Khi đóCâu 31:
Đốt cháy hoàn toàn m gam hỗn hợp các axit thuộc dãy đồng đẳng axit acrylic rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào 350 ml dung dịch Ca(OH)2 1M thấy có 10 gam kết tủa xuất hiện và khối lượng dung dịch sau phản ứng tăng 25,4 gam so với khối lượng dung dịch ban đầu. Giá trị của m là:
 Xem đáp án
Xem đáp án
Chọn đáp án B.
Câu 32:
Kết quả thí nghiệm của các dung dịch X, Y, Z và T với thuốc thử được ghi lại ở bảng sau:
|
|
X |
Y |
Z |
T |
|
Dung dịch HCl |
Có phản ứng |
Có phản ứng |
Có phản ứng |
Có phản ứng |
|
Dung dịch KOH |
Không phản ứng |
Không phản ứng |
Có phản ứng |
Có phản ứng |
|
Dung dịch Brom |
Nước brom không nhạt màu |
Nước brom nhạt màu và có kết tủa trắng |
Nước brom không nhạt màu |
Nước brom nhạt màu và không có kết tủa trắng |
Các chất X, Y, Z và T lần lượt là:
 Xem đáp án
Xem đáp án
X là: CH3NH2
Y là: C6H5NH2
Z là: H2N-CH(CH3)-COOH
T là: (C17H33COO)3C3H5
Chọn đáp án C.
Câu 33:
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3.
(b) Nung FeS2 trong không khí.
(c) Nhiệt phân KNO3.
(d) Cho dung dịch CuSO4 vào dung dịch NH3 (dư).
(e) Cho Fe vào dung dịch CuSO4.
(g) Cho Zn vào dung dịch FeCl3 (dư).
(h) Thổi khí H2 dư vào CuO nung nóng.
(i) Cho Ba vào dung dịch CuSO4 (dư).
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là
 Xem đáp án
Xem đáp án
Thí nghiệm thu được kim loại là (a), (h), (e)
Chọn đáp án A.
Câu 34:
Hỗn hợp X gồm 3 este đơn chức, tạo thành từ cùng một ancol Y với 3 axit cacboxylic (phân tử chỉ có nhóm -COOH); trong đó, có hai axit no là đồng đẳng kế tiếp nhau và một axit không no (có đồng phần hình học, chứa một liên kết đôi C=C trong phân tử). Thủy phân hoàn toàn 11,76 gam X bằng dung dịch NaOH, thu được hỗn hợp muối và m gam ancol Y. Cho m gam Y vào bình đựng Na dư, sau phản ứng thu được 1792ml khí (đktc) và khối lượng bình tăng 4,96gam. Mặt khác, nếu đốt cháy hoàn toàn 5,88 gam X thì thu được CO2 và 3,96 gam H2O. Phần trăm khối lượng của este không no trong X có giá trị gần với giá trị nào sau đây nhất?
 Xem đáp án
Xem đáp án
X gồm 3 este đơn chức Þ Y là ancol đơn chức
Bảo toàn khối lượng:
là CH3OH
Đồng nhất số liệu về 11,76 gam X ® đốt X thu được gam H2O
Công thức trung bình cho 2 este no, đơn, hở là CnH2nO2 (n > 2).
CTTQ cho este đơn, hở, chứa 1p C=C, có đphh là CmH2m-2O2 (m ³ 5).
Ta có: với k là độ bất bão hòa của HCHC.
Áp dụng:
Bảo toàn
® este không no làCâu 35:
Cho hỗn hợp X gồm các peptit mạch hở gồm: Gly - Ala; X1 - Ala ; Glu - X2 - Ala (A); Lys - Ala - X3 (B) và Lys - Ala - Ala - Lys (C); nA : nB : nC = 4 : 2 :1, trong đó X1, X2, X3 là các a-aminoaxit no mạch hở; phân tử có 1 nhóm -NH2; 1 nhóm -COOH.
Cho m gam hỗn hợp X tác dụng với dung dịch NaOH vừa đủ, đun nóng thu được dung dịch chứa m + 9,04 (gam) muối của các a-aminoaxit. Đốt cháy hoàn toàn m gam hỗn hợp X thu được 20,496 lít CO2 (đktc) và 15,39 gam H2O. Khối lượng muối thu được khi cho cùng lượng X trên tác dụng với H2SO4 loãng vừa đủ để thu được các muối chứa (không có muối chứa ) sau khi cô cạn cẩn thận là
 Xem đáp án
Xem đáp án
Cho X tác dụng với H2SO4 dư
Câu 36:
Dung dịch X chứa x mol NaOH và y mol Na2ZnO2 (hoặc Na2(Zn(OH)4)), dung dịch Y chứa z mol Ba(OH)2 và t mol Ba(AlO2)2 (hoặc Ba(Al(OH)4)2 trong đó (x < 2z).
tiến hành hai thí nghiệm sau:
- Thí nghiệm 1: nhỏ từ từ đến dư dung dịch HCl vào dung dịch X
- Thí nghiệm 2: nhỏ từ từ đến dư dung dịch HCl vào dung dịch Y
Kết quả hai thí nghiệm trên được biểu diễn trên đồ thị sau:
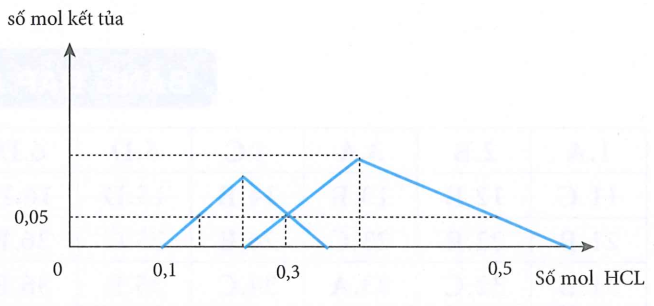
- Giá trị của y và t lần lượt là:
 Xem đáp án
Xem đáp án
Từ đồ thị ta thấy:
Với
Với
Chọn đáp án B.
Câu 37:
Cho X, Y là hai axit cacboxylic đơn chức mạch hở (MX < MY ); T là este hai chức tạo bởi X, Y và một ancol no mạch hở Z. Đốt cháy hoàn toàn 6,88 gam hỗn hợp E gồm X, Y, T bằng một lượng vừa đủ O2, thu được 5,6 lit CO2 (đktc) và 3,24 gam nước. Mặt khác 6,88 gam E tác dụng với dung dịch AgNO3 / NH3 dư thu được 12,96 gam Ag. Khối lượng rắn khan thu được khi cho cùng lượng E trên tác dụng với 150 ml dung dịch KOH 1M là:
 Xem đáp án
Xem đáp án
Hỗn hợp E phản ứng tráng bạc ® X là HCOOH và este T có gốc HCOO-.
Đặt số mol X, Y, T lần lượt là a, b và c. Có CO2 0,25 mol và H2O 0,18 mol.
Bảo toàn nguyên tố oxi
Và
Axit Y có tổng số liên kết pi là k ® tổng số liên kết pi trong este T là k+1.
Áp dụng điều kiện:
Ta chọn
(Bảo toàn nguyên tố cacbon)
Ta chọn
X là
Y là CH2 = CH - COOH
T là HCOO - CH2 - CH2 - OOC - CH = CH2. Z là C2H4(OH)2
Bảo toàn khối lượng:
Câu 38:
 Xem đáp án
Xem đáp án
Muối của aminoaxit
Muối của axit
23,08 gam
Áp dụng bảo toàn nguyên tố Na, ta có:
Áp dụng bảo toàn khối lượng F ta có:
Áp dụng bảo toàn nguyên tố C ta có
Do
® Số C trong là CH2=CH-COONa
® Số
Áp dụng sơ đồ đường chéo ta có:
Chọn đáp án B.
Câu 39:
 Xem đáp án
Xem đáp án
Gọi
® Vì khối lượng dung dịch giảm 33,1g ® loại phương án 2 (Cu2+ dư)
Câu 40:
Hòa tan hoàn toàn hỗn hợp X gồm Mg, MgO, Fe3O4 và Fe(NO3)2 (trong đó oxi chiếm 29,68% theo khối lượng) trong dung dịch HCl dư thấy có 4,61 mol HCl phản ứng. Sau khi các phản ứng xảy ra xong thu được dung dịch Y chỉ chứa 231,575 gam muối clorua và 14,56 lít (đkc) khí Z gồm NO, H2. Z có tỉ khối so với H2 là Thêm dung dịch NaOH dư vào Y, sau phản ứng thu được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được 102,2 gam chất rắn T. Phần trăm khối lượng MgO trong X gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Bảo toàn
® Số mol Số mol O trong
Bảo toàn
Ta có:
Chọn đáp án A.
