Đề thi thử THPT môn Hóa năm 2022 có đáp án (Mới nhất) - Đề 9
-
3446 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Chất thuộc loại polisaccarit là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Polisaccarit: Xenlulozơ
Monosaccarit: Glucozơ, fructozơ
Đisaccarit: Saccarozơ
Polisaccarit: Xenlulozơ
Monosaccarit: Glucozơ, fructozơ
Đisaccarit: Saccarozơ
Câu 3:
Amin nào sau đây thuộc loại amin bậc hai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
A. Metylamin CH3NH2: amin bậc 1
B. Trimetylamin (CH3)3N: amin bậc 3
C. Phenylamin C6H5NH2: amin bậc 1
D. Đietylamin (C2H5)2NH: amin bậc 2
A. Metylamin CH3NH2: amin bậc 1
B. Trimetylamin (CH3)3N: amin bậc 3
C. Phenylamin C6H5NH2: amin bậc 1
D. Đietylamin (C2H5)2NH: amin bậc 2
Câu 4:
Chất nào sau đây là tripeptit?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tripeptit là hợp chất hữu cơ được tạo nên từ ba gốc α-amino axit liên kết với nhau bởi các liên kết peptit (chứa 2 liên kết peptit).
Ala-Ala-Gly là tripeptit.
Tripeptit là hợp chất hữu cơ được tạo nên từ ba gốc α-amino axit liên kết với nhau bởi các liên kết peptit (chứa 2 liên kết peptit).
Ala-Ala-Gly là tripeptit.
Câu 5:
Polime nào dưới đây có tính dẻo là đặc trưng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Tính dẻo là đặc trưng là poli vinyl clorua ( Chất dẻo PVC)
Tính dẻo là đặc trưng là poli vinyl clorua ( Chất dẻo PVC)
Câu 6:
Etyl fomat có công thức là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Etyl fomat có công thức là HCOOC2H5
Metyl fomat: HCOOCH3
Metyl axetat: CH3COOCH3
Vinyl fomat: HCOOCH=CH2
Etyl fomat có công thức là HCOOC2H5
Metyl fomat: HCOOCH3
Metyl axetat: CH3COOCH3
Vinyl fomat: HCOOCH=CH2
Câu 7:
Số electron lớp ngoài cùng của nguyên tử Na là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Na ở nhóm IA nên có 1 electron lớp ngoài cùng (Cấu hình: 1s2 2s2 2p6 3s1)
Na ở nhóm IA nên có 1 electron lớp ngoài cùng (Cấu hình: 1s2 2s2 2p6 3s1)
Câu 8:
Kim loại nào sau đây tan được trong dung dịch HCl?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Kim loại Zn tan được trong dung dịch HCl:
Zn + 2HCl → ZnCl2 + H2
Kim loại Zn tan được trong dung dịch HCl:
Zn + 2HCl → ZnCl2 + H2
Câu 9:
Kim loại nào sau đây tác dụng với Cl2 và dung dịch HCl tạo ra cùng một muối là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Kim loại Mg tác dụng với Cl2 và dung dịch HCl tạo ra cùng một muối MgCl2.
Còn lại Fe tạo muối FeCl3 (với Cl2), tạo muối FeCl2 (với HCl);
Ag, Cu không tác dụng với HCl.
2Fe + 3Cl2 2FeCl3
Fe + 2HCl → FeCl2 + H2
Mg + Cl2 MgCl2
Mg + 2HCl → MgCl2 + H2↑
Kim loại Mg tác dụng với Cl2 và dung dịch HCl tạo ra cùng một muối MgCl2.
Còn lại Fe tạo muối FeCl3 (với Cl2), tạo muối FeCl2 (với HCl);
Ag, Cu không tác dụng với HCl.
2Fe + 3Cl2 2FeCl3
Fe + 2HCl → FeCl2 + H2
Mg + Cl2 MgCl2
Mg + 2HCl → MgCl2 + H2↑
Câu 10:
Tên gọi của chất béo có công thức (CH3[CH2]16COO)3C3H5 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tên gọi của chất béo có công thức (CH3[CH2]16COO)3C3H5 là tristearin
Trilinolein: (C17H31COO)3C3H5.
Triolein: (C17H33COO)3C3H5.
Tripanmitin: (C15H31COO)3C3H5.
Tên gọi của chất béo có công thức (CH3[CH2]16COO)3C3H5 là tristearin
Trilinolein: (C17H31COO)3C3H5.
Triolein: (C17H33COO)3C3H5.
Tripanmitin: (C15H31COO)3C3H5.
Câu 11:
Kim loại có độ cứng lớn nhất là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Kim loại có nhiệt độ nóng chảy cao nhất là W (vonfram).
Kim loại có nhiệt độ nóng chảy thấp nhất và cao nhất là Hg và W.
Kim loại có khối lượng riêng thấp nhất và cao nhất là Li và Os.
Kim loại độ cứng thấp nhất và cao nhất là Cs và Cr.
Kim loại có nhiệt độ nóng chảy cao nhất là W (vonfram).
Kim loại có nhiệt độ nóng chảy thấp nhất và cao nhất là Hg và W.
Kim loại có khối lượng riêng thấp nhất và cao nhất là Li và Os.
Kim loại độ cứng thấp nhất và cao nhất là Cs và Cr.
Câu 12:
Chất nào sau đây là este đơn chức?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
CH3COOC2H5 là este đơn chức được tạo từ axit đơn CH3COOH và ancol đơn C2H5OH.
CH3COOC2H5 là este đơn chức được tạo từ axit đơn CH3COOH và ancol đơn C2H5OH.
Câu 14:
Tên gọi của peptit H2N-CH2-CONH-CH2-CONHCH(CH3)COOH là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
H2N-CH2-COOH: Gly
H2N-CH2-COOH: Gly
NHCH(CH3)COOH: Ala
H2N-CH2-COOH: Gly
H2N-CH2-COOH: Gly
NHCH(CH3)COOH: Ala
Câu 15:
Trong công nghiệp, kim loại nào sau đây chỉ được điều chế bằng phương pháp điện phân nóng chảy?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương pháp điện phân nóng chảy dùng để điều chế các kim loại từ nhôm trở về trước.
VD: K, Na, Mg…
Phương pháp điện phân nóng chảy dùng để điều chế các kim loại từ nhôm trở về trước.
VD: K, Na, Mg…
Câu 16:
Dãy chất nào sau đây là hợp chất hữu cơ
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dãy A là hợp chất hữu cơ.
Các dãy còn lại có NH4HCO3, CO2, K2CO3, NaHCO3, (NH4)2CO3 là các chất vô cơ.
Dãy A là hợp chất hữu cơ.
Các dãy còn lại có NH4HCO3, CO2, K2CO3, NaHCO3, (NH4)2CO3 là các chất vô cơ.
Câu 17:
Cho dãy kim loại: Na, Ca, Cu, Fe, K. Số kim loại trong dãy tác dụng với H2O tạo dung dịch bazơ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Có 3 kim loại tác dụng với H2O tạo bazơ trong dãy là Na, Ca, K.
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Có 3 kim loại tác dụng với H2O tạo bazơ trong dãy là Na, Ca, K.
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Câu 18:
Este nào sau đây khi đun nóng với lượng dư dung dịch NaOH, thu được các sản phẩm hữu cơ đều không làm mất màu nước brom?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Este CH3CH2COOCH3 khi đun nóng với lượng dư dung dịch NaOH, thu được các sản phẩm hữu cơ đều không làm mất màu nước brom:
CH3CH2COOCH3 + NaOH CH3CH2COONa + CH3OH
Este CH3CH2COOCH3 khi đun nóng với lượng dư dung dịch NaOH, thu được các sản phẩm hữu cơ đều không làm mất màu nước brom:
CH3CH2COOCH3 + NaOH CH3CH2COONa + CH3OH
Câu 19:
Vào mùa đông, nhiều gia đình sử dụng bếp than đặt trong phòng kín để sưởi ấm gây ngộ độc khí, có thể dẫn tới tử vong. Nguyên nhân gây ngộ độc là do khí nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên nhân gây ngộ độc là do khí CO, khí này thay thế O2 tạo liên kết bền vững với hemoglobin trong máu và gây ngạt.
Nguyên nhân gây ngộ độc là do khí CO, khí này thay thế O2 tạo liên kết bền vững với hemoglobin trong máu và gây ngạt.
Câu 20:
Kali hidrocabonat là một loại thuốc hiệu quả chống lại bệnh nấm mốc được sử dụng trong canh tác hữu cơ. Công thức hóa học của kali hidrocacbonat là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Công thức hóa học của kali hiđrocacbonat là KHCO3.
Kali cacbonat: K2CO3
Kali sunfit: K2SO3
Kali hidrosunfat: KHSO4
Công thức hóa học của kali hiđrocacbonat là KHCO3.
Kali cacbonat: K2CO3
Kali sunfit: K2SO3
Kali hidrosunfat: KHSO4
Câu 21:
Trong số các chất sau: xenlulozơ, saccarozơ, fructozơ, glucozơ, tinh bột. Các chất khi thủy phân đến cùng chỉ thu được glucozơ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Có 2 chất khi thủy phân đến cùng chỉ thu được glucozơ là xenlulozơ và tinh bột, phản ứng chung dạng:
(C6H10O5)n + nH2O → nC6H12O6
C12H22O11 + H2O C6H12O6 + C6H12O6
Có 2 chất khi thủy phân đến cùng chỉ thu được glucozơ là xenlulozơ và tinh bột, phản ứng chung dạng:
(C6H10O5)n + nH2O → nC6H12O6
C12H22O11 + H2O C6H12O6 + C6H12O6
Câu 22:
Đường fructozơ có nhiều trong mật ong, ngoài ra còn có trong các loại hoa quả và rau xanh như ổi, cam, xoài, rau diếp xoắn, cà chua…rất tốt cho sức khỏe. Công thức phân tử của fructozơ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Frutozơ: C6H12O6
Axit axetic: CH3COOH
Saccarozơ: C12H22O11
Tinh bột: (C6H10O5)n
Frutozơ: C6H12O6
Axit axetic: CH3COOH
Saccarozơ: C12H22O11
Tinh bột: (C6H10O5)n
Câu 23:
Cho các polime: (1) polietilen, (2) poli(metyl metacrylat), (3) polibutađien, (4) polistiren, (5) poli(vinyl axetat) và (6) tơ nilon-6,6. Số polime thủy phân trong cả dung dịch axit và dung dịch kiềm là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Poli(metyl metacrylat) và poli(vinyl axetat) là các polieste và tơ nilon-6,6 là poliamit, có thể bị thủy phân trong dung dịch axit và dung dịch kiềm.
Các polime có nhóm este và -CONH- sẽ bị thủy phân trong cả axit và bazơ.
→ (2), (5), (6)
Poli(metyl metacrylat) và poli(vinyl axetat) là các polieste và tơ nilon-6,6 là poliamit, có thể bị thủy phân trong dung dịch axit và dung dịch kiềm.
Các polime có nhóm este và -CONH- sẽ bị thủy phân trong cả axit và bazơ.
→ (2), (5), (6)
Câu 24:
Tiến hành thí nghiệm phản ứng tráng gương của glucozơ theo các bước sau đây:
Bước 1: Cho vào ống nghiệm sạch 1ml dung dịch AgNO3 1%, cho thêm một vài giọt dung dịch NaOH 10%, sau đó thêm từng giọt dung dịch NH3 5% và lắc đều cho đến khi kết tủa tan hết
Bước 2: Thêm tiếp 1ml dung dịch glucozơ, hơ nóng nhẹ ống nghiệm trên ngọn lửa đèn cồn trong vài phút
Nhận định nào sau đây là sai?
Bước 1: Cho vào ống nghiệm sạch 1ml dung dịch AgNO3 1%, cho thêm một vài giọt dung dịch NaOH 10%, sau đó thêm từng giọt dung dịch NH3 5% và lắc đều cho đến khi kết tủa tan hết
Bước 2: Thêm tiếp 1ml dung dịch glucozơ, hơ nóng nhẹ ống nghiệm trên ngọn lửa đèn cồn trong vài phút
Nhận định nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
A. Đúng
B. Sai, NaOH để tạo kết tủa AgOH giúp NH3 tạo phức nhanh. Mặt khác NaOH ăn mòn thủy tinh nên cũng làm ống nghiệm sạch hơn
C. Đúng, glucozơ khử Ag+ thành Ag
2AgNO3 + H2O + 2NH3 + C6H12O6 → 2Ag + 2NH4NO3 + C6H12O7
D. Đúng, Ag sinh ra bám vào mặt trong ống nghiệm nên thành ống nghiệm sáng bóng
A. Đúng
B. Sai, NaOH để tạo kết tủa AgOH giúp NH3 tạo phức nhanh. Mặt khác NaOH ăn mòn thủy tinh nên cũng làm ống nghiệm sạch hơn
C. Đúng, glucozơ khử Ag+ thành Ag
2AgNO3 + H2O + 2NH3 + C6H12O6 → 2Ag + 2NH4NO3 + C6H12O7
D. Đúng, Ag sinh ra bám vào mặt trong ống nghiệm nên thành ống nghiệm sáng bóng
Câu 25:
Cho m gam Al tác dụng với dung dịch NaOH dư, thu được 6,72 lít khí H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
nH2 = 0,3 → nAl = 0,2 → mAl = 5,4 gam
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2↑
nH2 = 0,3 → nAl = 0,2 → mAl = 5,4 gam
Câu 26:
Cho hỗn hợp kim loại Mg, Al, Fe vào dung dịch AgNO3 và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch chứa 3 muối gồm
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Kim loại có tính khử mạnh hơn sẽ ưu tiên nằm trong muối dưới dạng cation. Kim loại thoát ra ngoài gồm Ag, Cu, có thể có Fe dư.
→ 3 muối gồm Mg(NO3)2, Al(NO3)3 và Fe(NO3)2
Mg + 2AgNO3 → Mg(NO3)2 + Ag
Al + 3AgNO3 → 3Ag + Al(NO3)3
Fe + Cu(NO3)2 → Cu + Fe(NO3)2
Kim loại có tính khử mạnh hơn sẽ ưu tiên nằm trong muối dưới dạng cation. Kim loại thoát ra ngoài gồm Ag, Cu, có thể có Fe dư.
→ 3 muối gồm Mg(NO3)2, Al(NO3)3 và Fe(NO3)2
Mg + 2AgNO3 → Mg(NO3)2 + Ag
Al + 3AgNO3 → 3Ag + Al(NO3)3
Fe + Cu(NO3)2 → Cu + Fe(NO3)2
Câu 28:
Cho 8,76 gam lysin và 22,5 gam glyxin vào dung dịch chứa 0,4 mol KOH, thu được dung dịch Y. Cho Y tác dụng hoàn toàn với dung dịch HCl dư, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
nLys = 0,06 mol; nGly = 0,3 mol
Muối gồm Lys(HCl)2 (0,06), GlyHCl (0,3) và KCl (0,4)
→ m muối = 76,39 gam
nLys = 0,06 mol; nGly = 0,3 mol
Muối gồm Lys(HCl)2 (0,06), GlyHCl (0,3) và KCl (0,4)
→ m muối = 76,39 gam
Câu 29:
Cho các phát biểu sau:
1. Thủy tinh hữu cơ plexiglas có thành phần chính là poli(metyl metacrylat)
2. Xenlulozơ triaxetat là polime nhân tạo
3. Polietilen được điều chế bằng phản ứng trùng ngưng
4. Các peptit đều dễ bị thủy phân trong môi trường axit hoặc kiềm
5. Xenlulozơ là nguyên liệu để sản xuất tơ nhân tạo, chế tạo phim ảnh, thuốc súng không khói
1. Thủy tinh hữu cơ plexiglas có thành phần chính là poli(metyl metacrylat)
2. Xenlulozơ triaxetat là polime nhân tạo
3. Polietilen được điều chế bằng phản ứng trùng ngưng
4. Các peptit đều dễ bị thủy phân trong môi trường axit hoặc kiềm
5. Xenlulozơ là nguyên liệu để sản xuất tơ nhân tạo, chế tạo phim ảnh, thuốc súng không khói
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
(1) Đúng
(2) Đúng, xenlulozơ triaxetat tạo ra từ xenlulozơ.
(3) Sai, polietilen điều chế bằng phản ứng trùng hợp etilen.
(4) Đúng, các peptit có liên kết peptit kém bền trong môi trường axit hoặc kiềm.
(5) Đúng
(1) Đúng
(2) Đúng, xenlulozơ triaxetat tạo ra từ xenlulozơ.
(3) Sai, polietilen điều chế bằng phản ứng trùng hợp etilen.
(4) Đúng, các peptit có liên kết peptit kém bền trong môi trường axit hoặc kiềm.
(5) Đúng
Câu 30:
Cho các phát biểu sau:
1. Điện phân dung dịch NaCl, ở anot xảy ra quá trình oxi hóa ion clorua
2. Hợp kim natri-kali dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân
3. Trong nhóm IA, từ Li đến Cs, khả năng phản ứng với nước giảm dần
4. Nhôm dẫn điện tốt hơn đồng
5. Li được dùng để chế tạo tế bào quang điện
6. Các kim loại Na, Ba, Be đều tác dụng với nước ở nhiệt độ thường
1. Điện phân dung dịch NaCl, ở anot xảy ra quá trình oxi hóa ion clorua
2. Hợp kim natri-kali dùng làm chất trao đổi nhiệt trong một số lò phản ứng hạt nhân
3. Trong nhóm IA, từ Li đến Cs, khả năng phản ứng với nước giảm dần
4. Nhôm dẫn điện tốt hơn đồng
5. Li được dùng để chế tạo tế bào quang điện
6. Các kim loại Na, Ba, Be đều tác dụng với nước ở nhiệt độ thường
Những phát biểu không đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
(1) Đúng, tại anot: 2Cl- → Cl2 + 2e
(2) Đúng
(3) Sai, khả năng phản ứng với H2O tăng dần dó tính khử tăng dần
(4) Sai, Ag > Cu > Au > Al > Fe
(5) Sai, Cs mới dùng để chế tạo tế bào quang điện
(6) Sai, Be không phản ứng với H2O
(1) Đúng, tại anot: 2Cl- → Cl2 + 2e
(2) Đúng
(3) Sai, khả năng phản ứng với H2O tăng dần dó tính khử tăng dần
(4) Sai, Ag > Cu > Au > Al > Fe
(5) Sai, Cs mới dùng để chế tạo tế bào quang điện
(6) Sai, Be không phản ứng với H2O
Câu 31:
Tiến hành các thí nghiệm sau:
1. Cho dung dịch AgNO3 dư vào dung dịch FeCl2
2. Sục khí Cl2 vào dung dịch FeCl2
3. Dẫn khí H2 dư qua bột CuO nung nóng
4. Nhiệt phân AgNO3
5. Điện phân dung dịch CuSO4 với điện cực trơ
6. Cho Ba vào dung dịch CuCl2 (dư)
7. Cho bột Cu và FeCl3 theo tỉ lệ mol 1:1 vào nước dư
Sau khi kết thúc phản ứng, số thí nghiệm thu được kim loại là
1. Cho dung dịch AgNO3 dư vào dung dịch FeCl2
2. Sục khí Cl2 vào dung dịch FeCl2
3. Dẫn khí H2 dư qua bột CuO nung nóng
4. Nhiệt phân AgNO3
5. Điện phân dung dịch CuSO4 với điện cực trơ
6. Cho Ba vào dung dịch CuCl2 (dư)
7. Cho bột Cu và FeCl3 theo tỉ lệ mol 1:1 vào nước dư
Sau khi kết thúc phản ứng, số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
(1) 3AgNO3 dư + FeCl2 → Fe(NO3)3 + 2AgCl + Ag
(2) Cl2 + 2FeCl2 → 2FeCl3
(3) H2 + CuO → Cu + H2O
(4) 2AgNO3 → 2Ag + 2NO2 + O2
(5) 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
(6) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2
(7) Cu + 2FeCl3 → CuCl2 + 2FeCl2 (Cu còn dư)
(1) 3AgNO3 dư + FeCl2 → Fe(NO3)3 + 2AgCl + Ag
(2) Cl2 + 2FeCl2 → 2FeCl3
(3) H2 + CuO → Cu + H2O
(4) 2AgNO3 → 2Ag + 2NO2 + O2
(5) 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
(6) Ba + 2H2O → Ba(OH)2 + H2
Ba(OH)2 + CuCl2 → BaCl2 + Cu(OH)2
(7) Cu + 2FeCl3 → CuCl2 + 2FeCl2 (Cu còn dư)
Câu 32:
Hấp thụ hết a mol khí CO2 vào dung dịch NaOH 1,5M và Ba(OH)2 0,45M. Sau khi kết thúc các phản ứng, thu được 17,73 gam kết tủa và dung dịch X. Cho từ từ dung dịch HCl 1,2M vào X đến khi bắt đầu có khí thoát ra thì đã dùng 200ml. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Thêm HCl từ từ vào X thấy 0,24 mol HCl mới có khí chứng tỏ X chứa CO32-, có thể có thêm OH- hoặc HCO3-
→ Ba2+ đã kết tủa hết
→ nBa(OH)2 = nBaCO3 = 0,09 → nNaOH = 0,3
Khi bắt đầu có khí thì dung dịch chứa Na+ (0,3), Cl- (0,24), bảo toàn điện tích
→ nHCO3- = 0,06 mol
Bảo toàn C → nCO2 = nBaCO3 + nHCO3- = 0,15 mol
Thêm HCl từ từ vào X thấy 0,24 mol HCl mới có khí chứng tỏ X chứa CO32-, có thể có thêm OH- hoặc HCO3-
→ Ba2+ đã kết tủa hết
→ nBa(OH)2 = nBaCO3 = 0,09 → nNaOH = 0,3
Khi bắt đầu có khí thì dung dịch chứa Na+ (0,3), Cl- (0,24), bảo toàn điện tích
→ nHCO3- = 0,06 mol
Bảo toàn C → nCO2 = nBaCO3 + nHCO3- = 0,15 mol
Câu 33:
Cho sơ đồ phản ứng theo đúng tỉ lệ mol
(1) X + 2NaOH (t°) → X1 + X2 + X3
(2) 2X1 + H2SO4 → Na2SO4 + 2X4
(3) 2X2 + H2SO4 → Na2SO4 + 2X5
(4) X3 + CuO (t°) → X6 + Cu + H2O
Biết X (C6H10O4) chứa hai chức este, các phân tử X3, X4, X5 có cùng số nguyên tử cacbon. Phát biểu nào sau đây sai?
(1) X + 2NaOH (t°) → X1 + X2 + X3
(2) 2X1 + H2SO4 → Na2SO4 + 2X4
(3) 2X2 + H2SO4 → Na2SO4 + 2X5
(4) X3 + CuO (t°) → X6 + Cu + H2O
Biết X (C6H10O4) chứa hai chức este, các phân tử X3, X4, X5 có cùng số nguyên tử cacbon. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các cặp X1 và X4; X2 và X5 cùng C
Giả thiết X3, X4, X5 cùng C → Mỗi chất 2C
X là CH3COO-CH2-COO-C2H5
X1 là CH3COONa; X4 là CH3COOH
X2 là HO-CH2-COONa; X5 là HO-CH2-COOH; X3 là C2H5OH; X6 là CH3CHO
A. Sai, X6 bị H2 khử tạo X3.
B. Đúng:
CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
HO-CH2-COOH + CaCO3 → (HO-CH2-COO)2Ca + CO2 + H2O
C. Đúng, X4, X5 có phân tử khối lớn hơn và liên kết H liên phân tử bền hơn X3 nên nhiệt độ sôi cao hơn X3.
D. Đúng
Các cặp X1 và X4; X2 và X5 cùng C
Giả thiết X3, X4, X5 cùng C → Mỗi chất 2C
X là CH3COO-CH2-COO-C2H5
X1 là CH3COONa; X4 là CH3COOH
X2 là HO-CH2-COONa; X5 là HO-CH2-COOH; X3 là C2H5OH; X6 là CH3CHO
A. Sai, X6 bị H2 khử tạo X3.
B. Đúng:
CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
HO-CH2-COOH + CaCO3 → (HO-CH2-COO)2Ca + CO2 + H2O
C. Đúng, X4, X5 có phân tử khối lớn hơn và liên kết H liên phân tử bền hơn X3 nên nhiệt độ sôi cao hơn X3.
D. Đúng
Câu 35:
Hòa tan 41,4 gam hỗn hợp gồm Na, Na2O, Ba và BaO vào H2O dư, thu được dung dịch X và b mol H2. Sục từ từ khí CO2 vào X, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
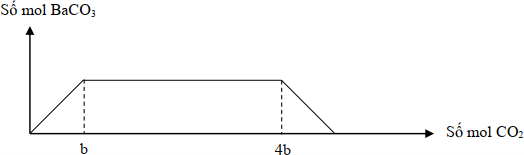
Giá trị của b là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Theo đồ thị:
nBaCO3 = b và nNaHCO3 = 4b – b = 3b
Quy đổi hỗn hợp thành O (a), Na (3b) và Ba (b)
→ 16a + 23.3b + 137b = 41,4
Bảo toàn electron: 2a + 2b = 3b + 2b
→a = 0,27 mol; b = 0,18 mol
Theo đồ thị:
nBaCO3 = b và nNaHCO3 = 4b – b = 3b
Quy đổi hỗn hợp thành O (a), Na (3b) và Ba (b)
→ 16a + 23.3b + 137b = 41,4
Bảo toàn electron: 2a + 2b = 3b + 2b
→a = 0,27 mol; b = 0,18 mol
Câu 37:
Hỗn hợp X gồm glyxin, alanin và axit glutamic. Hỗn hợp Y gồm tristearin và tripanmitin. Đốt cháy hoàn 0,75 mol hỗn hợp Z gồm a gam X và b gam Y cần dùng 217,56 lít O2 ở đktc, sản phẩm cháy gồm N2, CO2 và 128,25 gam H2O. Cho a gam X phản ứng vừa đủ với V ml dung dịch HCl 0,9M. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
X = C2H3ON + ?CH2 + ?CO2 + H2O
Y = ?CH2 + 3CO2 + H2
Đặt nX = x và nY = y. Quy đổi Z thành C2H3ON (x), H2O (x), H2 (y), CH2 (z) và CO2
nZ = x + y = 0,75
nO2 = 2,25x + 0,5y + 1,5z = 9,7125
nH2O = 1,5x + x + y + z = 7,125
→ x = 0,45; y = 0,3; z = 5,7
a gam X phản ứng vừa đủ với nHCl = nN = x = 0,45 mol
→ V = 500 ml
X = C2H3ON + ?CH2 + ?CO2 + H2O
Y = ?CH2 + 3CO2 + H2
Đặt nX = x và nY = y. Quy đổi Z thành C2H3ON (x), H2O (x), H2 (y), CH2 (z) và CO2
nZ = x + y = 0,75
nO2 = 2,25x + 0,5y + 1,5z = 9,7125
nH2O = 1,5x + x + y + z = 7,125
→ x = 0,45; y = 0,3; z = 5,7
a gam X phản ứng vừa đủ với nHCl = nN = x = 0,45 mol
→ V = 500 ml
Câu 40:
Hỗn hợp X chứa Mg, Fe, Cu, FeO, Fe2O3 và CuO, trong đó oxi chiếm 4,5% khối lượng. Đun nóng m gam X với 0,336 lít khí CO một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỷ khối hơi so với hidro bằng . Hòa tan hết Y trong dung dịch chứa 1,28 mol HNO3, thu được dung dịch T chứa 83,32 gam muối và 2,688 lít hỗn hợp G chứa NO và N2O. Biết G có tỷ khối hơi đối với hidro bằng . Biết thể tích các khí đều đo ở đktc. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Quy đổi X thành kim loại (x gam) và O (y mol)
→ mO = 16y = 4,5%(x + 16y) (1)
Z gồm CO2 (0,005) và CO dư (0,01)
→ Y gồm kim loại (x gam) và O (y – 0,005 mol)
G gồm NO (0,1) và N2O (0,02). Đặt nNH4+ = z
nH+ = 1,28 = 2(y – 0,005) + 10z + 0,1.4 + 0,02.10 (2)
m muối = x + 62[0,1.3 + 0,02.8 + 2(y – 0,005) + 8z] + 80z = 83,32 (3)
(1)(2)(3) → x = 15,28; y = 0,045; z = 0,06
→ m = x + 16y = 16 gam
Quy đổi X thành kim loại (x gam) và O (y mol)
→ mO = 16y = 4,5%(x + 16y) (1)
Z gồm CO2 (0,005) và CO dư (0,01)
→ Y gồm kim loại (x gam) và O (y – 0,005 mol)
G gồm NO (0,1) và N2O (0,02). Đặt nNH4+ = z
nH+ = 1,28 = 2(y – 0,005) + 10z + 0,1.4 + 0,02.10 (2)
m muối = x + 62[0,1.3 + 0,02.8 + 2(y – 0,005) + 8z] + 80z = 83,32 (3)
(1)(2)(3) → x = 15,28; y = 0,045; z = 0,06
→ m = x + 16y = 16 gam
