[Năm 2022] Đề thi thử môn Hóa học THPT Quốc gia có lời giải (20 đề)
[Năm 2022] Đề thi thử môn Hóa học THPT Quốc gia có lời giải (20 đề) - Đề 2
-
4783 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 10:
Khí sunfurơ là chất khí độc, khí thải ra môi trường thì gây ô nhiễm không khí. Công thức của sunfurơ là
 Xem đáp án
Xem đáp án
Chọn D
Câu 13:
Thuỷ phân triolein trong dung dịch NaOH thu được glixerol và muối X. Công thức của X là
 Xem đáp án
Xem đáp án
Chọn A
Câu 14:
Canxi cacbonat để sản xuất vôi, thủy tinh, xi măng. Công thức của canxi cacbonat là
 Xem đáp án
Xem đáp án
Chọn B
Câu 19:
Natri clorua là gia vị quan trọng trong thức ăn của con người. Công thức của natri clorua là
 Xem đáp án
Xem đáp án
Chọn C
Câu 21:
Khi đốt cháy hoàn toàn 7,02 gam hỗn hợp glucozơ và saccarozơ cần vừa đủ 0,24 mol O2, thu được CO2 và m gam H2O. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn C.
Ta có:
Câu 22:
Hoà tan hết 1,2 gam kim loại R (hoá trị II) trong dung dịch H2SO4 loãng, thu được 0,05 mol H2. Kim loại R là
 Xem đáp án
Xem đáp án
Chọn A
Câu 24:
Cho dung dịch KOH dư vào dung dịch FeCl2 và FeCl3 thu được kết tủa X. Cho X tác dụng với lượng dư dung dịch H2SO4 (đặc, nóng) thu được dung dịch chứa muối
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Cho lá kẽm mỏng vào ống nghiệm đựng 2 ml dung dịch chất X, thấy lá kẽm tan dần và có khí thoát ra. Chất X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 27:
Cho 3 gam H2NCH2COOH tác dụng hết với dung dịch NaOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Câu 28:
Thuỷ phân saccarozơ, thu được hai monosaccarit X và Y. Chất X có nhiều trong quả nho chín nên còn được gọi là đường nho. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn D
Câu 29:
Hoà tan hết 1,62 gam Al trong dung dịch NaOH, thu được V ml khí H2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn C
Câu 30:
Có bao nhiêu tơ hóa học trong các tơ: xenlulozơ axetat, capron, nitron, nilon–6,6?
 Xem đáp án
Xem đáp án
Chọn A
Câu 31:
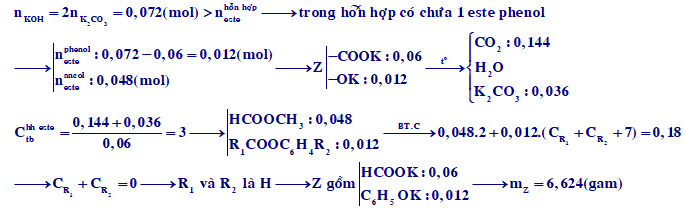
Cho 0,06 mol hỗn hợp hai este đơn chức X và Y tác dụng vừa đủ với dung dịch KOH thu được hỗn hợp Z gồm các chất hữu cơ. Đốt cháy hoàn toàn Z thu được H2O; 0,144 mol CO2 và 0,036 mol K2CO3. Làm bay hơi Z thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B.
Câu 32:
Nung 7,84 gam Fe trong không khí, sau một thời gian, thu được 10,24 gam hỗn hợp rắn X. Cho X phản ứng hết với dung dịch HNO3 (loãng, dư), thu được V ml khí NO (sản phẩm khử duy nhất của N+5 đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn D.
Câu 33:
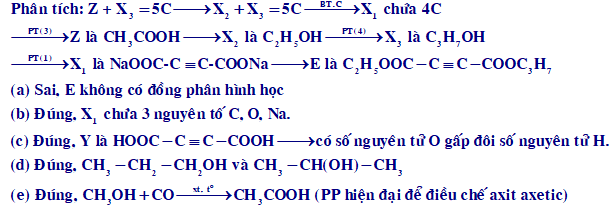
Cho sơ đồ chuyển hóa sau (theo đúng tỉ lệ mol):
E (C9H12O4) + 2NaOHX1 + X2 + X3
X1 + 2HCl → Y + 2NaCl
X2 + O2 Z + H2O
Z + X3 T(C5H10O2) + H2O
Biết chất E là este mạch hở. Cho các phát biểu sau:
(a) Chất E có đồng phân hình học.
(b) Trong thành phần phân tử của X1 chỉ có các nguyên tử của 3 nguyên tố.
(c) Trong phân tử Y, số nguyên tử oxi gấp 2 lần số nguyên tử hiđro.
(d) Có hai công thức cấu tạo thỏa mãn tính chất của X3.
(e) Chất Z có thể được tạo thành từ CH3OH chỉ bằng 1 phản ứng hóa học.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn D.
Câu 34:
Thực hiện các thí nghiệm sau:
(a) Cho hỗn hợp Na2O và Al2O3 (tỉ lệ mol 1 : 1) vào nước (dư).
(b) Cho hỗn hợp Cu và Fe3O4 (tỉ lệ mol tương ứng 2 : 1) vào dung dịch HCl (dư).
(c) Cho hỗn hợp Ba và NaHCO3 (tỉ lệ mol 1 : 1) vào nước (dư).
(d) Cho hỗn hợp Cu và NaNO3 (tỉ lệ mol tương ứng 1 : 2) vào dung dịch HCl (dư).
(e) Cho hỗn hợp BaCO3 và KHSO4 vào nước (dư).
Khi phản ứng trong các thí nghiệm trên kết thúc, có bao nhiêu thí nghiệm không thu được chất rắn?
 Xem đáp án
Xem đáp án
Chọn B.
(a) 1 mol Na2O tạo thành 2 mol NaOH sau đó hòa tan tối đa 1 mol Al2O3 tạo dung dịch trong suốt.
(b) 1 mol Fe3O4 hòa tan HCl tạo thành 2 mol FeCl3 sau đó hòa tan tối đa 1 mol Cu Þ Cu còn dư 1 mol
(c) Hòa tan Ba vào dung dịch NaHCO3 thu được kết tủa BaCO3.
(d) 3Cu + 8H+ + 2NO3- : dựa vào tỉ lệ mol thì Cu hết Þ không thu được chất rắn.
(e) Cho hỗn hợp BaCO3 và KHSO4 vào nước thu được kết tủa BaSO4.
Câu 35:
Đốt cháy hoàn toàn m gam hỗn hợp E gồm ancol isopropylic và hai amin no, đơn chức, mạch hở Y, Z (số mol của Y gấp 3 lần số mol của Z, MZ = MY + 14) cần vừa đủ 1,5 mol O2, thu được N2, H2O và 0,8 mol CO2. Phần trăm khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
Chọn D.
Nếu đốt X: a mol và b, c là số mol Y (CnH2n + 3N) Þ 3a + nb = 0,8 (1)
và 4,5a + (1,5n + 0,75).b = 1,5 (theo cân bằng pt của O2) (2)
Nhân cho 1,5.(1) = 4,5a + 1,5nb = 1,2 thay vào (2) Þ b = 0,4
Mà nY = 3nZ Þ nY = 0,3 mol và nZ = 0,1 mol
(1) Þ 3a + CY.0,3 + (CY + 1).0,1 = 0,8 Þ 3a + 0,4CY = 0,7 Þ CY = 1 và a = 0,1
Vậy Y là CH5N có %m = 46,97%
Câu 36:
Hỗn hợp E gồm: X, Y là hai axit đồng đẳng kế tiếp; Z, T là hai este (đều hai chức, mạch hở; Y và Z là đồng phân của nhau; MT – MZ = 14). Đốt cháy hoàn toàn 7,704 gam E cần vừa đủ 0,222 mol O2, thu được CO2 và H2O. Mặt khác, cho 7,704 gam E phản ứng vừa đủ với 220 ml dung dịch NaOH 0,6M. Cô cạn dung dịch sau phản ứng, thu được hỗn hợp muối khan G của các axit cacboxylic và 1,68 gam hỗn hợp ba ancol có cùng số mol. Khối lượng muối của axit có phân tử khối lớn nhất trong G gần nhất với giá trị nào dưới đây?
 Xem đáp án
Xem đáp án
Chọn D.

Câu 37:
Cho các phát biểu sau:
(a) Nước quả chanh khử được mùi tanh của cá.
(b) Fructozơ là monosaccarit duy nhất có trong mật ong.
(c) Sản phẩm của phản ứng thủy phân saccarozơ được dùng trong kĩ thuật tráng gương.
(d) Một số este hoà tan tốt nhiều chất hữu cơ nên được dùng làm dung môi.
(e) Vải làm từ nilon–6,6 sẽ nhanh hỏng khi ngâm lâu trong nước xà phòng có tính kiềm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B.
(b) Sai. Fructozơ là monosaccarit chiếm nhiều nhất (40%) có trong mật ong ngoài ra còn có glucozơ chiếm khoảng 30%.
Câu 38:
Đun nóng a gam hỗn hợp E chứa triglixerit X và các axit béo với 200 ml dung dịch NaOH 1M (vừa đủ), thu được glixerol và hỗn hợp muối Y. Hiđro hóa hoàn toàn Y cần vừa đủ 0,1 mol H2 chỉ thu được muối natri panmitat. Đốt cháy 0,07 mol E thu được 1,645 mol CO2. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là
 Xem đáp án
Xem đáp án
Chọn D.
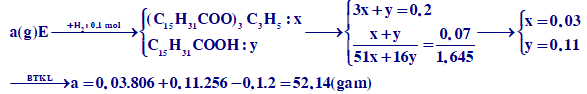
Câu 39:
Hòa tan hết 23,18 gam hỗn hợp X gồm Fe, Mg và Fe(NO3)3 vào dung dịch chứa 0,92 mol HCl và 0,01 mol NaNO3, thu được dung dịch Y (chất tan chỉ có 46,95 gam hỗn hợp muối) và 2,92 gam hỗn hợp Z gồm ba khí không màu (trong đó hai khí có số mol bằng nhau). Dung dịch Y phản ứng được tối đa với 0,91 mol KOH, thu được 29,18 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm thể tích của khí có phân tử khối lớn nhất trong Z là
 Xem đáp án
Xem đáp án
Chọn A.
Dung dịch Y chứa Fe2+ ; Fe3+ ; Mg2+ ; NH4+ ; Na+ (0,01) và Cl- (0,92).
Ta có: mion kim loại + = 46,95 – 0,01.23 – 0,92.35,5 = 14,06 (1)
Khi cho Y tác dụng với KOH thì: (2)
Từ (1), (2) suy ra: mion kim loại = 13,88 (g) ; Þ
Hỗn hợp Z gồm 3 khí: trong đó có H2) và N2O; N2 hoặc N2O; NO hoặc N2; NO.
Nhận thấy nN (Z) : nO (Z) = 3 : 1 Þ 3N và 1O Þ 2 khí đó là N2 và NO (có số mol bằng nhau = 0,05)
Vậy %V khí N2O = 45,45%.
Câu 40:
Thí nghiệm xác định định tính nguyên tố cacbon và hidro trong phân tử glucozơ được tiến hành theo các bước sau:
Bước 1: Trộn đều khoảng 0,2 gam glucozơ với 1 đến 2 gam đồng (II) oxit, sau đó cho hỗn hợp ống nghiệm khô (ống số 1) rồi thêm tiếp khoảng 1 gam đồng (II) oxit để phủ kín hỗn hợp. Nhồi một nhúm bông có rắc bột CuSO4 khan vào phần trên của ống số 1 rồi nút bằng nút cao su có ống dẫn khí.
Bước 2: Lắp ống số 1 lên giá thí nghiệm rồi nhúng ống dẫn khí vào dung dịch Ca(OH)2 đựng trong ống nghiệm (ống số 2).
Bước 3: Dùng đèn cồn đun nóng ống số 1 (lúc đầu đun nhẹ, sau đó đun tập trung vào phần có hỗn hợp phản ứng).
Cho các phát biểu sau:
(a) Trong thí nghiệm trên, CuO có vai trò chuyển nguyên tố C thành CO2, nguyên tố H thành H2O.
(b) Thí nghiệm trên, trong ống số 2 có xuất hiện kết tủa trắng.
(c) Ở bước 2, lắp ống số 1 sao cho miệng ống hướng lên.
(d) Sau bước 3, màu trắng của CuSO4 chuyển thành màu xanh của CuSO4.5H2O.
(e) Kết thúc thí nghiệm: tắt đèn cồn, để ống số 1 nguội hẳn rồi mới đưa ống dẫn khí ra khỏi dung dịch trong ống số 2.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B.
(d) Sai, lắp sao cho miệng ống hơi cúi xuống (thấp hơn đáy ống), mục đích là làm cho nước bám vào thành ống nghiệm (CuSO4 khan có thể không hấp thụ hết) không chảy ngược xuống đáy ống nghiệm (gây vỡ ống).
(e) Sai, tháo ống dẫn khí trước rồi mới tắt đèn cồn. Nếu làm ngược lại, khi tắt đèn cồn trước, nhiệt độ ống 1 giảm làm áp suất giảm, nước có thể bị hút từ ống 2 lên ống 1, gây nguy cơ vỡ ống 1.
