[Năm 2022] Đề thi thử môn Hóa học THPT Quốc gia có lời giải (20 đề)
[Năm 2022] Đề thi thử môn Hóa học THPT Quốc gia có lời giải (20 đề) - Đề 12
-
4790 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 5:
Trong tự nhiên, chất X tồn tại dưới dạng ngậm nước X.2H2O gọi là thạch cao sống. Công thức của X là
 Xem đáp án
Xem đáp án
Chọn B
Câu 7:
Ấm đun nước lâu ngày, thường thấy xuất hiện một lớp cặn ở đáy. Lớp cặn đó chứa chất nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B
Câu 11:
Cho dung dịch Fe(NO3)3 tác dụng với dung dịch NaOH tạo thành kết tủa có màu
 Xem đáp án
Xem đáp án
Chọn A
Câu 12:
Do sự thiếu hiểu biết, vào mùa đông, một số gia đình sử dụng bếp than đặt trong phòng kín để sưởi ấm, dẫn đến hiện tượng các thành viên trong gia đình bị ngộ độc khí X, có thể dẫn tới tử vong. Khí X là
 Xem đáp án
Xem đáp án
Chọn D
Câu 15:
Khi thủy phân chất béo trong môi trường kiềm thì thu được muối của axit béo và
 Xem đáp án
Xem đáp án
Chọn D
Câu 21:
Chất X ở dạng sợi, màu trắng, không có mùi vị và không tan trong nước. Thủy phân hoàn toàn chất X, thu được chất Y. Chất Y có nhiều trong quả nho chín nên được gọi là đường nho. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn B
Câu 23:
Cho các polime sau: polietilen, xenlulozơ, nilon-6,6, amilopectin, nilon-6, amilozơ. Số polime thiên nhiên là
 Xem đáp án
Xem đáp án
Chọn A
Câu 24:
Nhỏ nước brom vào dung dịch chất hữu cơ X, lắc nhẹ, thấy kết tủa trắng xuất hiện. Nếu cho một mẩu natri bằng hạt đậu xanh vào dung dịch X thì thấy giải phóng khí. Tên gọi của X là
 Xem đáp án
Xem đáp án
Chọn A
Câu 25:
Khi hoà tan hỗn hợp hai kim loại Cu và Fe vào dung dịch HNO3 loãng thì thu được khí màu nâu đỏ và dung dịch X. Sau phản ứng thấy vẫn còn dư kim loại Cu. Vậy trong dung dịch X có các loại ion dương là:
 Xem đáp án
Xem đáp án
Chọn D
Câu 27:
Cho 18 gam dung dịch glucozơ 20% hoàn tan vừa hết m gam Cu(OH)2, tạo thành dung dịch màu xanh thẫm. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Câu 28:
Dẫn V lít khí đimetylamin vào dung dịch HCl dư, cô cạn dung dịch sau phản ứng thu được 16,789 gam muối. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn A
Câu 29:
Cho 16,8 gam NaHCO3 tác dụng với lượng dư dung dịch Ba(OH)2, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn B
Câu 31:
Cho các phát biểu sau:
(a) Một số este có mùi thơm được dùng làm chất tạo hương cho thực phẩm và mỹ phẩm.
(b) Các este bị thủy phân trong môi trường kiềm đều tạo muối và ancol.
(c) Tinh bột và xenlulozơ là hai chất đồng phân của nhau.
(d) Tất cả các peptit đều có phản ứng với Cu(OH)2 tạo hợp chất màu tím.
(e) Khi rớt axit sunfuric đặc vào vải cotton (sợi bông) thì chỗ vải đó sẽ bị đen rồi thủng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn A
Câu 32:
Thực hiện các thí nghiệm sau:
(a) Đun nóng dung dịch hỗn hợp NaHCO3, Ca(NO3)2 (tỉ lệ mol tương ứng 1:1).
(b) Cho dung dịch chứa a mol NaOH vào dung dịch chứa a mol Ca(HCO3)2.
(c) Sục 3,2x mol khí CO2 vào dung dịch hỗn hợp chứa x mol Ba(OH)2 và 1,2x mol NaOH.
(d) Cho một mẩu Na vào dung dịch FeSO4.
(e) Ở nhiệt độ thường, cho dung dịch NaHCO3 vào dung dịch Ba(NO3)2.
Sau khi phản ứng kết thúc, số thí nghiệm tạo thành chất kết tủa là
 Xem đáp án
Xem đáp án
Chọn B
Câu 33:
Hỗn hợp E gồm bốn este đều có công thức C8H8O2 và có vòng benzen. Cho 16,32 gam E tác dụng tối đa với V ml dung dịch NaOH 2M (đun nóng), thu được 3,88 gam hỗn hợp ancol và 18,78 gam hỗn hợp muối. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn D
Câu 34:
Thủy phân hoàn toàn chất béo X trong môi trường axit, thu được glixerol, axit oleic và axit linoleic. Đốt cháy m gam X cần vừa đủ 35,616 lít O2, thu được H2O và 25,536 lít CO2 và. Cho m gam X phản ứng hoàn toàn với 0,448 lít H2, thu được chất rắn Y, Y tối đa với V ml dung dịch Br2 0,5M. Các thể tích khí đo ở điều kiện tiêu chuẩn Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn B
Câu 35:
Nhiệt phân hoàn toàn 26,73 gam X (là muối ở dạng ngậm nước), thu được hỗn hợp Y (gồm khí và hơi) và 7,29 gam một chất rắn Z. Hấp thụ hết Y vào nước, thu được dung dịch T. Cho 180 ml dung dịch NaOH 1M vào T, thu được dung dịch chỉ chứa một muối, khối lượng của muối là 15,3 gam. Phần trăm khối lượng nguyên tố oxi trong X là
 Xem đáp án
Xem đáp án
Chọn A
Câu 36:
Tiến hành thí nghiệm theo các bước sau:
- Bước 1: Cho 2 ml ancol etylic khan vào ống nghiệm khô có sẵn vài viên đá bọt, sau đó thêm từng giọt dung dịch H2SO4 đặc (4 ml), đồng thời lắc đều. Lắp dụng cụ thí nghiệm như hình vẽ:
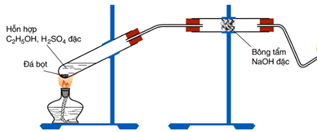
- Bước 2: Đun nóng hỗn hợp phản ứng sao cho hỗn hợp không trào lên ống dẫn khí.
- Bước 3: Đốt khí sinh ra ở đầu vuốt nhọn của ống dẫn khí.
- Bước 4: Dẫn khí khí sinh ra ở đầu vuốt nhọn qua dung dịch KMnO4.
Cho các phát biểu sau:
(a) Đá bọt điều hòa quá trình sôi, giúp dung dịch sôi đều, tránh hiện tượng quá sôi.
(b) Khí thoát ra ở đầu vuốt nhọn không có khả năng làm mất màu dung dịch nước brom.
(c) Màu của dung dịch KMnO4 bị nhạt dần và xuất hiện kết tủa màu đen.
(d) Ở thí nghiệm trên, có thể thay etanol bằng metanol.
(e) Vai trò của bông tẩm NaOH đặc là hấp thụ khí SO2 sinh ra.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn B
Câu 37:
Cho các sơ đồ chuyển hóa theo đúng tỉ lệ mol:
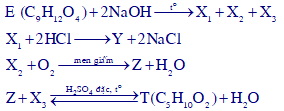
Biết chất E là este mạch hở. Cho các phát biểu sau:
(a) Hợp chất E có hai đồng phân cấu tạo.
(b) Khối lượng phân tử của X1 là 160.
(c) Trong phân tử Y, số nguyên tử oxi gấp 2 lần số nguyên tử hiđro.
(d) Hợp chất T có hai đồng phân cấu tạo.
(e) Chất Z có thể được tạo thành từ CH3OH chỉ bằng 1 phản ứng hóa học.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn C
Câu 38:
Trộn 58,75 gam hỗn hợp X gồm Fe(NO3)2 và kim loại M với 46,4 gam FeCO3 được hỗn hợp Y. Cho toàn bộ Y vào lượng vừa đủ dung dịch KHSO4, thu được dung dịch Z chỉ chứa 4 ion (không kể H+ và OH− của H2O) và 16,8 lít hỗn hợp T (đktc) gồm 3 khí trong đó có 2 khí có cùng phân tử khối và 1 khí hóa nâu trong không khí. Tỉ khối của T so với H2 là 19,2. Cô cạn 1/10 dung dịch Z thu được m gam rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn A
Câu 39:
Đốt cháy hoàn toàn m gam hỗn hợp E gồm hai este mạch hở X và Y (đều tạo bởi axit cacboxylic và ancol; MX < MY < 150), thu được 4,48 lít khí CO2. Cho m gam E tác dụng vừa đủ với dung dịch NaOH, thu được một muối và 3,14 gam hỗn hợp ancol Z. Cho toàn bộ Z tác dụng với Na dư, thu được 1,12 lít khí H2. Phần trăm khối lượng X trong E là
 Xem đáp án
Xem đáp án
Chọn B
Câu 40:
Hỗn hợp hơi E chứa etilen, metan, axit axetic, metyl metacrylat, metylamin và hexametylenđiamin. Đốt cháy 0,2 mol E cần vừa đủ a mol O2, thu được 0,48 mol H2O và 1,96 gam N2. Mặt khác, 0,2 mol E tác dụng vừa đủ với 100 ml dung dịch Br2 0,7M. Giá trị a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Chọn B
