Bộ 30 đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án
Bộ 30 đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 24)
-
25115 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
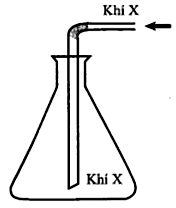
Trong phòng thí nghiệm, khí X được điều chế và thu vào bình tam giác như hình vẽ bên. Khí X được tạo thành từ phản ứng hóa học nào dưới đây?
 Xem đáp án
Xem đáp án
Khí X được thu bằng cách để ngửa bình → Khí X nặng hơn không khí.
Trong các phương trình hóa học trên, chỉ có A sinh ra khí nặng hơn không khí (NO2) → Chọn A.
Câu 2:
Trong các nguồn năng lượng: (1) thủy điện, (2) gió, (3) mặt trời, (4) hóa thạch; những nguồn năng lượng sạch là:
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 3:
Trong phòng thí nghiệm, kim loại Na được bảo quản bằng cách ngâm trong chất lỏng nào dưới đây?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 4:
Thủy phân hoàn toàn 1 mol peptit mạch hở X, thu được 2 mol Gly, 2 mol Ala và 1 mol Val. Mặt khác, thủy phân không hoàn toàn X, thu được hỗn hợp các amino axit và các peptit (trong đó có Gly-Ala-Val). Số công thức cấu tạo phù hợp với tính chất của X là
 Xem đáp án
Xem đáp án
Trong 1 phân tử X có 2 gốc Gly, 2 gốc Ala và 1 gốc Val.
Có 6 công thức cấu tạo phù hợp với X là:
G-A-V-G-A G-A-V-A-G
G-G-A-V-A A-G-A-V-G
G-A-G-A-V A-G-G-A-V
Câu 5:
Phát biểu nào dưới đây sai?
 Xem đáp án
Xem đáp án
A đúng vì do ở trạng thái trung gian, ion Cr3+ trong dung dịch vừa có tính oxi hóa (trong môi trưòng axit), vừa có tính khử (trong môi trường bazơ).
B sai vì trong phản ứng Ag+ tác dụng với Fe2+ , Ag+ đóng vai trò chất oxi hóa.
C đúng.
D đúng vì H2SO4 đặc, nóng có tính oxi hóa mạnh nên oxi hóa được Ag, còn H2SO4 loãng thì không.
Câu 6:
Ma túy đá hay còn gọi là hàng đá, chấm đá là tên gọi chỉ chung cho các loại ma túy tổng hợp, có chứa chất methamphetamine (meth). Những người thường xuyên sử dụng ma túy đá gây hậu quả là suy kiệt thể chất, hoang tưởng, thậm chí mất kiểm soát hành vi, gây hại cho người khác và xã hội, nặng hơn có thể mắc bệnh tâm thần. Khi oxi hóa hoàn toàn 0,5215 gam methamphetamine bằng CuO dư, dẫn sản phẩm cháy lần lượt qua bình (1) đựng H2SO4 đặc, bình (2) đựng Ba(OH)2 dư. Sau khi kết thúc thí nghiệm thấy khối lượng bình (1) tăng 0,4725 gam; ở bình (2) tạo thành 6,895 gam kết tủa và còn 39,2 ml khí (ở đktc) thoát ra. Biết công thức phân tử trùng với công thức đơn giản nhất. Công thức phân tử của methamphetamine là
 Xem đáp án
Xem đáp án
Bình (1) hấp thụ H2O; bình (2) hấp thụ CO2; khí thoát ra ngoài là N2.
Bảo toàn nguyên tố C, H, N:
Ta có: mC +mH+mN=0,5214 gam→ Trong phân tử methamphetamine không chứa O.
->nC:nH:nN=0,035:0,0525:0,0035=10:15:1
Vì công thức phân tử trùng với công thức đơn giản nhất
→ Công thức phân tử của methamphetamine là C10H15N.
Câu 7:
Cho các phản ứng sau:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2 (1)
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag (2)
Dãy sắp xếp theo thứ tự tăng dần tính oxi hóa của các ion kim loại là
 Xem đáp án
Xem đáp án
Phản ứng xảy ra theo chiều:
Chất khử mạnh + Chất oxi hóa mạnh → Chất khử yếu hơn + Chất oxi hóa yếu hơn
Ở (1): Tính oxi hóa Fe3+>Fe2+
Ở (2): Tính oxi hóa Ag+>Fe3+ → Đáp án C thỏa mãn.
Câu 8:
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong khí clo.
(2) Đốt nóng hỗn hợp Fe và S (trong điều kiện không có oxi).
(3) Cho FeO vào dung dịch HNO3 loãng, dư.
(4) Cho Fe vào dung dịch Fe2(SO4)3.
(5) Cho Fe vào dung dịch H2SO4 loãng dư.
Số thí nghiệm tạo ra muối sắt(II) là
 Xem đáp án
Xem đáp án
Có 3 thí nghiệm tạo ra muối sắt(II) là: (2), (4), (5).
Câu 9:
Cho sơ đồ chuyển hóa (mỗi mũi tên ứng với một phản ứng):
Tên của Z là
 Xem đáp án
Xem đáp án
Sơ đồ hoàn chỉnh:
Câu 10:
Phát biểu nào dưới đây sai?
 Xem đáp án
Xem đáp án
A đúng vì protein là polipeptit, có phản ứng màu biure.
B, C đúng.
D sai vì chỉ có protein dạng hình cầu mới tan trong nước tạo dung dịch keo.
Câu 11:
Cho các chất: NaHCO3, Ca(OH)2, Al(OH)3, SiO2, HF, Cl2, NH4Cl. số chất tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là
 Xem đáp án
Xem đáp án
Có 5 chất tác dụng với dung dịch NaOH loãng ở nhiệt độ thường là:
Câu 12:
Phát biểu nào dưới đây sai?
 Xem đáp án
Xem đáp án
A sai vì F chỉ có số oxi hóa -1 trong hợp chất.
B, C đúng.
D đúng vì
Câu 13:
Cho các phát biểu sau:
(a) Glucozo và saccarozo đều là chất rắn có vị ngọt, dễ tan trong nước.
(b) Tinh bột và xenlulozo đều là polisaccarit.
(c) Trong dung dịch, glucozo và saccarozo đều hòa tan Cu(OH)2 tạo dung dịch màu xanh lam.
(d) Khi thủy phân hoàn toàn hỗn hợp tinh bột và saccarozo trong môi trường axit, chỉ thu được một loại monosaccarit duy nhất.
(e) Khi đun nóng glucozo với dung dịch AgNO3 trong NH3 thu được Ag.
(f) Glucozo và saccarozo đều tác dụng với H2 (Ni, t0 ) tạo sobitol.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a), (b), (c) đúng.
(d) sai vì thủy phân saccarozo thu được hai monosaccarit là glucozo và fructozo.
(e) đúng.
(f) sai vì saccarozo không có phản ứng với H2 (Ni, to).
→ Có 4 phát biểu đúng là: (a), (b), (c), (e).
Câu 14:
Cho dãy chất sau:
p-HO CH2 C6H4 OH; p-HO C6H4 COOC2H5;
p-HO C6H4 COOH; p-HCOO C6H4 OH; p-CH3O C6H4 OH.
Cho các điều kiện sau:
(a) Chỉ tác dụng với NaOH theo tỉ lệ mol 1:1.
(b) Tác dụng với Na dư tạo ra số mol H2 bằng số mol chất phản ứng.
Số chất trong dãy thỏa mãn đồng thời hai điều kiện (a) và (b) là
 Xem đáp án
Xem đáp án
Có 1 chất thỏa mãn cả hai điều kiện là: .
Câu 15:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
A đúng.
B sai vì benzyl axetat có mùi hoa nhài, không có mùi chuối chín.
C sai vì dung dịch brom chỉ nhận biết được stiren, không nhận biết được benzen và toluen.
D sai vì este không tan trong nước.
Câu 16:
Cho sơ đồ phản ứng sau:
(1) X + O2 axit cacboxylic Y1 (2) X + H2 ancol Y2
(3) Y1 + Y2 Y3 + H2O
Biết Y3 có công thức phân tử là C6H10O2. Tên gọi của X là
 Xem đáp án
Xem đáp án
Sơ đồ hoàn chỉnh:
Câu 17:
Ancol etylic được điều chế từ tinh bột bằng phương pháp lên men với hiệu suất toàn bộ quá trình là 90%. Hấp thụ hoàn toàn lượng CO2 sinh ra khi lên men vào dung dịch nước vôi trong, thu được 33 gam kết tủa và dung dịch X. Biết khối lượng X giảm đi so với lượng nước vôi trong ban đầu là 13,2 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Ta có:
Câu 18:
Để trung hòa 20 ml dung dịch HCl 0,1M cần 10 ml dung dịch NaOH nồng độ X mol/l. Giá trị cùa X là
 Xem đáp án
Xem đáp án
Ta có:
Câu 19:
Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịchNaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
 Xem đáp án
Xem đáp án
→
Số mol HCl cần dùng là: lít = 80 ml.
Câu 21:
Dung dịch X chứa các ion: Ca2+, Na+, HCO3- và Cl-, trong đó số mol của Cl- là 0,1. Chia X thành hai phần bằng nhau. Phần một phản ứng với NaOH dư thu được 2 gam kết tủa. Phần hai tác dụng với Ca(OH)2 dư thu được 3 gam kết tủa. Mặt khác, nếu đun sôi đến cạn dung dịch X thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Nhận thấy: → Ở phần một, Ca2+ phản ứng hết, CO32- dư.
Xét phần một:
Xét phần hai:
Bảo toàn điện tích trong X:
-> m=0,04.40+0,08.23+0,1.35,5+0,03.60=8,79 gam
Câu 22:
Hỗn hợp khí X gồm O2 và O3 có tỉ khối so với H2 là 22. Hỗn hợp khí Y gồm metylamin và etylamin có tỉ khối so với H2 là 17,833. Để đốt hoàn toàn V1 lít Y cần vừa đủ V2 lít X (biết sản phẩm cháy gồm CO2, H2O và N2, các chất khí đo ở cùng điều kiện nhiệt độ, áp suất). Tỉ lệ V1 : V2 là
 Xem đáp án
Xem đáp án
Các khí đo ở cùng điều kiện nhiệt độ, áp suất nên tỉ lệ thể tích bằng tỉ lệ số mol.
Gọi số mol của Y là 1 mol
MX=44-> Gọi số mol O2 và O3 lần lượt là x và 3x mol->nO=11x mol
Xét phản ứng đốt cháy:
Bảo toàn nguyên tố C:
Bảo toàn nguyên tố H:
Bảo toàn nguyên tố O:
Câu 23:
Cho các phản ứng xảy ra theo sơ đồ sau:
X + NaOH Y + Z
Y (rắn) + NaOH (rắn) CH4 + Na2CO3
Z + 2AgNO3 + 3NH3 + H2O CH3COONH4 + 2NH4NO3 + 2Ag
Chất X là
 Xem đáp án
Xem đáp án
Y tác dụng với NaOH (CaO, to) tạo thành CH4 → Y là CH3COONa → Loại A, B.
Thủy phân X thu được sản phẩm Z có phản ứng tráng bạc
→ X không thể là etyl axetat → Loại D.
Câu 24:
Cho các phát biểu sau:
(a) Khi đốt cháy hoàn toàn anken luôn thu được .
(b) Trong thành phần hợp chất hữu cơ nhất thiết phải có cacbon.
(c) Liên kết hóa học chủ yếu trong hợp chất hữu cơ là liên kết cộng hóa trị.
(d) Những hợp chất hữu cơ khác nhau có cùng phân tử khối là đồng phân của nhau.
(e) Phản ứng hữu cơ thường xảy ra nhanh vào không theo một hướng nhất định.
(f) Hợp chất C9H14BrCl có vòng benzen trong phân tử.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
a) đúng.
(b) đúng vì hợp chất hữu cơ là hợp chất của cacbon.
(c) đúng.
(d) sai vì những hợp chất có cùng công thức phân tử là đồng phân của nhau.
(e) sai vì những phản ứng hữu cơ thường xảy ra chậm.
(f) sai vì mà hợp chất chứa vòng benzen có kmin=4 → C9H14BrCl không có vòng benzen trong phân tử.
→ Có 3 phát biểu đúng là: (a), (b), (c).
Câu 25:
Cho các cặp chất với tỉ lệ số mol tương ứng như sau:
(a) Fe3O4 và Cu (1 : 1) (b) Sn và Zn (2 : 1)
(c) Zn và Cu (1 : 1) (d) Fe2(SO4)3 và Cu (l : 1)
(e) FeCl2 và Cu (2 : 1) (g) FeCl3 và Cu (1 : 1)
Số cặp chất tan hoàn toàn trong một lượng dư dung dịch HCl loãng nóng là
 Xem đáp án
Xem đáp án
Có 3 cặp chất tan hoàn toàn trong một lượng dư dung dịch HCl loãng nóng là: (a), (b); (d). (c), (e) không tan hoàn toàn do Cu không tan, không phản ứng với HCl và với muối Zn2+; Fe2+.
(g) không tan hoàn toàn do Cu còn dư sau phản ứng với Fe3+.
Câu 26:
Cho 3 hiđrocacbon mạch hở X, Y, Z ( MX<MY<MZ<62) có cùng số nguyên tử cacbon trong phân tử, đều phản ứng với dung dịch AgNO3 trong NH3 dư. Cho các phát biểu sau:
(a) 1 mol chất X phản ứng với 4 mol H2 (Ni, to).
(b) Chất Z có đồng phân hình học.
(c) Chất Y có tên là but-1-in.
(d) Ba chất X, Y, Z đều có mạch cacbon không phân nhánh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
X là HC ≡ CC ≡ CH; Y là HC ≡ CCH = CH2; Z là HC ≡ CCH2CH3.
(1) đúng kX=4
(2) sai vì HC ≡ CCH2CH3 không có đồng phân hình học.
(3) sai vì but-1-in là tên của Z, không phải tên gọi Y.
(4) đúng.
→ Có 2 phát biểu đúng là: (a) và (d).
Câu 27:
Thực hiện các thí nghiệm sau:
(a) Nung NH4NO3 nóng.
(b) Đun nóng NaCl tinh thể với dung dịch H2SO4 đặc.
(c) Sục khí Cl2 vào dung dịch NaHCO3.
(d) Sục khí CO2 vào dung dịch Ca(OH)2 dư.
(e) Sục khí SO2 vào dung dịch KMnO4.
(f) Cho dung dịch KHSO4 vào dung dịch NaHCO3.
(g) Cho PbS vào dung dịch HCl loãng.
(h) Cho Na2SO3 vào dung dịch H2SO4 dư, đun nóng.
Số thí nghiệm tạo ra chất khí là
 Xem đáp án
Xem đáp án
Phương trình hóa học:
(a) NH4NO3 N2O + 2H2O
(b)
(c) Cl2 + 2NaHCO3 + H2O → NaCl + NaClO + 2CO2 + 2H2O
(d) CO2 + Ca(OH)2 du → CaCO3 + H2O
(e) 5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
(f) HSO4- +HCO3- ->SO42- CO2 + H2O
(g) PbS + HCl → Không phản ứng
(h) Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
→ Có 5 thí nghiệm tạo ra chất khí là: (a), (b), (c), (f), (h).
Câu 28:
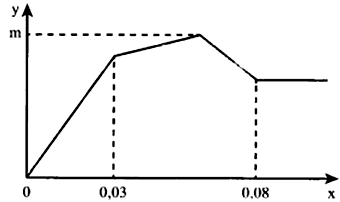
Nhỏ từ từ đến dư dung dịch Ba(OH)2 vào dung dịch gồm Al2(SO4)3 và AlCl3. Sự phụ thuộc của khối lượng kết tủa (y gam) vào so mol Ba(OH)2 (x mol) được biểu diễn bằng đồ thị bên, khối lượng kết tủa cực đại là m gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Tại : BaSO4 đã kết tủa hết, Al(OH)3 mới kết tủa một phần.
Tại : Al(OH)3 bị hòa tan hết.
Câu 29:
Cho 1,82 gam hỗn hợp X gồm Cu và Ag (tỉ lệ mol tương ứng 4 : 1) vào 30 ml dung dịch gồm H2SO4 0,5M và HNO3 2M, sau khi phản ứng xảy ra hoàn toàn, thu được a mol khí NO (sản phẩm khử duy nhất của N5+ ). Trộn a mol NO trên với 0,1 mol O2 thu được hỗn hợp khí Y. Cho toàn bộ Y tác dụng với H2O, thu được 150 ml dung dịch có pH = z. Giá trị của z là
 Xem đáp án
Xem đáp án
Sơ đồ phản ứng:
Nhận thấy:
Do Cu, Ag phản ứng hết, H+ dư.
Phương trình hóa học: 4NO + O2 + 2H2O → 4HNO3
0,015 0,1 → 0,015 mol
-> [H+]=
Câu 30:
Cho 7,65 gam hỗn hợp X gồm Al và Al2O3 (trong đó Al chiếm 60% khối lượng) tan hoàn toàn trong dung dịch Y gồm H2SO4 và NaNO3, thu được dung dịch Z chỉ chứa ba muối trung hòa và m gam hỗn hợp khí T (trong T có 0,015 mol H2). Cho dung dịch BaCl2 dư vào Z đến khí các phản ứng xảy ra hoàn toàn, thu được 93,2 kết tủa. Còn nếu cho Z phản ứng với NaOH thì lượng NaOH phản ứng tối đa là 0,935 mol. Giá trị của m gần nhất với
 Xem đáp án
Xem đáp án
Sơ đồ phản ứng:
Bảo toàn nguyên tố Al:
Xét Z tác dụng với BaCl2 và Z tác dụng với NaOH:
Bảo toàn nhóm SO4:
Ta có:
Bảo toàn điện tích trong Z:
Bảo toàn nhóm SO4 và Na:
Bảo toàn nguyên tố H:
Bảo toàn khối lượng:
Câu 31:
Đun hỗn hợp etylen glicol và axit cacboxylic X (phân tử chỉ có nhóm COOH) với xúc tác H2SO4 đặc, thu được hỗn hợp sản phẩm hữu cơ, trong đó có chất hữu cơ Y mạch hở. Đốt cháy hoàn toàn 3,95 gam Y cần 4,00 gam O2, thu được CO2 và H2O theo tỉ lệ mol tương ứng là 2 : 1. Biết Y có công thức phân tử trùng với công thức đơn giản nhất. Y phản ứng với NaOH theo tỉ lệ mol tương ứng 1:2. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Xét phản ứng đốt cháy Y:
Sơ đồ phản ứng:
Bảo toàn khối lượng:
Bảo toàn nguyên tố C, H:
Ta có: nC:nH:nO=6:6:5-> Y là C6H6O5.
Y là phản ứng với NaOH theo tỉ lệ 1:2 → Công thức cấu tạo của Y là HOC2H4OOCC≡CCOOH.
→ X là HOOCC≡CCOOH.
A đúng vì tổng số nguyên tử hiđro trong X, Y = 6 + 2 = 8.
B đúng vì X không có phản ứng với AgNO3/NH3.
C đúng vì có liên kết trong phân tử nên phản ứng với Br2 theo tỉ lệ 1 : 2.
D sai vì X khồng có đồng phân hình học.
Câu 32:
Đốt cháy hoàn toàn một este đơn chức, mạch hở X (phân tử có số liên kết π nhỏ hơn 3), thu được thể tích khí CO2 bằng 6/7 thể tích khí O2 đã phản ứng (các thể tích khi đo ở cùng điều kiện). Cho m gam X tác dụng hoàn toàn với 200 ml dung dịch KOH 0,7M thu được dung dịch Y. Cô cạn Y thu được 12,88 gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Gọi công thức của X là CxHyO2,
Phương trình hóa học:
Theo đề bài: (*)
TH1: Nếu X có 1 liên kết π->y= 2x->x=3;y=6
TH2: Nếu X có 2 liên kết π-> y=2x-2-> x=4,5 (loại).
→ X là C3H6O2.
Xét X tác dụng với KOH:
Gọi số mol KOH phản ứng là a mol.
Ta có: (R=44+39)x+56(0,14-x)=12,88-> (R=27)x =5,04
Nếu R là H -> x=0,18>0,14 Loại
Nếu R là CH3 -> x=0,12<0,14 Thỏa mãn
-> m=0,12.78=8,88 gam
Câu 33:
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3. (b) Nung FeS2 trong không khí.
(c) Nhiệt phân KNO3. (d) Cho dung dịch CuSO4 vào dung dịch NH3 dư.
(e) Cho Fe vào dung dịch CuSO4. (f) Cho Zn vào dung dịch FeCl3 dư.
(g) Nung Ag2S trong không khí. (h) Cho Ba vào dung dịch CuSO4 dư.
Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm sinh ra kim loại là
 Xem đáp án
Xem đáp án
Có 3 thí nghiệm sinh ra kim loại là: (a), (e), (g).
Câu 34:
Hợp chất hữu cơ X (chứa C, H, O) chỉ chứa một loại nhóm chức. Cho 0,15 mol X phản ứng vừa đủ với 180 gam dung dịch NaOH, thu được dung dịch Y. Làm bay hơi Y, chỉ thu được 164,7 gam hơi nước và 44,4 gam hỗn hợp chất rắn khan Z. Đốt cháy hoàn toàn Z, thu được 23,85 gam Na2CO3; 56,1 gam CO2 và 14,85 gam H2O. Mặt khác, Z phản ứng với dung dịch H2SO4 loãng, dư, thu được hai axit cacboxylic đơn chức và hợp chất T (chứa C, H, O và MT<126). Số nguyên tử H trong phân tử T bằng
 Xem đáp án
Xem đáp án
Xét X tác dụng với dung dịch NaOH:
Bảo toàn khối lượng: MX=44,4+164,7-180=29,1 mol
Bảo toàn nguyên tố C: Số C = 10
Bảo toàn nguyên tố H: Số H = 10
Số O = 4
→ Công thức của X là C10H10O4.
Ta có: X + 3NaOH → X + H2O và Z + H2SO4 → Hai axit cacboxylic + T
→ X có dạng HCOOC6H4CH2OOCCH3.
→ T là HOC6H4CH2OH → Trong phân tử T có 8 nguyên tử H.
Câu 35:
Hai peptit X, Y ( MX<MY) mạch hở, có cùng số nguyên tử cacbon, Z là este của amino axit có công thức phân tử C3H7O2N. Đun nóng 47,8 gam hỗn hợp E chứa X, Y, Z cần dùng dung dịch chứa 0,6 mol NaOH, thu được 0,12 mol ancol T và 64,36 gam hỗn hợp muối của glyxin, alanin và valin. Phần trăm khối lượng của Y trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Z là NH2CH2COOCH3 → T là CH3OH.
Sơ đồ phản ứng:
Bảo toàn khối lượng:
Muối có dạng CnH2nNO2Na->
Bảo toàn nguyên tố C:
->Số
Do X, Y có cùng số nguyên tử cacbon nên trong phân tử X, Y đều có 7 nguyên tử C
→ X là Gly-Val (x mol) và Y là (Gly)2Ala (y mol)
Ta có:
Câu 36:
Chất X có công thức phân tử C6H8O4. Cho 1 mol X phản ứng hết với dung dịch NaOH, thu được chất Y và 2 mol chất Z. Đun Z với dung dịch H2SO4 đặc, thu được đimetyl ete. Chất Y phản ứng với dung dịch H2SO4 loãng, dư, thu được chất T. Cho T phản ứng với HBr, thu được hai sản phẩm là đồng phân cấu tạo của nhau. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đun Z thu được đimetyl ete → Z là CH3OH.
kX=3 → X là este hai chức không no, có 1 liên kết trong phân tử.
→ X có dạng C2H2(COOCH3)2 → Y là C2H2(COONa)2 →T là C2H2(COOH)2 → T phản ứng với HBr thu được hai sản phẩm là đồng phân cấu tạo của nhau
→ T có dạng CH2 = C(COOH)2
→ X là CH2 = C(COOCH3)2
Nhận thấy:
A sai vì công thức phân tử của Y là C4H2O4Na2.
B sai vì Z là CH3OH, ancol no, đơn chức, mạch hở → Không làm mất màu dung dịch brom.
C đúng.
D sai vì X phản ứng với H2 (Ni, to) theo tỉ lệ mol 1:1.
Câu 37:
Hòa tan hết 16,58 gam hỗn hợp X gồm Al, Mg, Fe, FeCO3 trong dung dịch chứa 1,16 mol NaHSO4 và 0,24 mol HNO3, thu đuợc dung dịch Z (chỉ chứa muối trung hòa) và 6,89 gam hỗn hợp khí Y gồm CO2, N2, NO, H2 (trong Y có 0,035 mol H2 và tỉ lệ mol NO : N2 = 2 : 1). Dung dịch Z phản ứng tối đa với 1,46 mol NaOH, lọc lấy kết tủa đem nung trong không khí đến khối lượng không đổi, thu được 8,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe đơn chất trong X là
 Xem đáp án
Xem đáp án
Sơ đồ phản ứng:
Bảo toàn nguyên tố Na:
Bảo toàn điện tích trong Z1:
Gọi số mol N2, NO, CO2, NH4+ lần lượt là a, 2a, b, c mol.
-> 30.2a=28a+44b=6,89-0,035.2 (1)
Bảo toàn nguyên tố N: 1.2a=2a+c=0,24 (2)
Bảo toàn nguyên tố H:
Bảo toàn nguyên tố O: (3)
Từ (1), (2), (3) suy ra: a=0,0575; b=0,04; c=0,01
Gọi số mol Mg và Fe đơn chất lần lượt là x và y mol.
Ta có:
Câu 38:
Hỗn hợp E gồm chất X (CmH2m+4O4N2 ) là muối của axit cacboxylic hai chức và chất Y (CnH2m+3O2N ) là muối của axit cacboxylic đơn chức. Đốt cháy hoàn toàn 0,2 mol E cần dùng vừa đủ 0,58 mol O2, thu được N2, CO2 và 0,84 mol H2O. Mặt khác, cho 0,2 mol E tác dụng hết với dung dịch NaOH, cô cạn dung dịch sau phản ứng, thu được một chất khí làm xanh quỳ tím ẩm và m gam hỗn hợp hai muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Quá trình quy đổi:
X (CmH2m+4O4N2)-> (CH2)a(CO2)2(NH3)2H2: x mol (với a = m – 2)
Y (CnH2n+3O2N)-> (CH2)b(CO2)2(NH3)2H2: y mol (với b = n – 1)
→ Quy đổi E thành CH2 (z mol); H2 (x + y mol); CO2 (2x + y mol) và NH3 (2x + y mol).
Sơ đồ phản ứng: 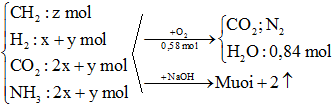
Ta có: x + y = 0,2 (1)
Bảo toàn nguyên tố H: (2)
Bảo toàn electron: 6z+3(2x+y)+2(x+y)=0,58.4 (3)
Từ (1), (2) và (3) suy ra: x=0,12; y=0,08; z=0,16
là nghiệm duy nhất của phương trình.
→ X là (COONH4)2 (0,12 mol) và Y là C2H5COONH4 (0,08 mol).
→ Muối gồm (COONa)2 0,12 mol và C2H5COONa (0,08 mol).
->m=0,12.134+0,08.96=23,76 gam
Câu 39:
Hỗn hợp E gồm: X, Y là hai axit đồng đẳng kế tiếp; Z, T là hai este (đều hai chức, mạch hở; Y và Z là đồng phân của nhau; MT-MZ=14). Đốt cháy hoàn toàn 12,84 gam E cần vừa đủ 0,37 mol O2, thu được CO2 và H2O. Mặt khác, cho 12,84 gam E phản ứng vừa đủ với 220 ml dung dịch NaOH 1M. Cô cạn dung dịch sau phản ứng, thu được hỗn hợp muối khan G của các axit cacboxylic và 2,8 gam hỗn hợp ba ancol có cùng số mol. Khối lượng muối của axit có phân tử khối lớn nhất trong G là
 Xem đáp án
Xem đáp án
Nhận xét: X, Y, Z, T đều là các hợp chất hai chức và có cùng số liên kết π.
Gọi CnH2n-2-2kO4 công thức chung là (với k là độ không no).
-> (CH2)n-2(CO2)2H6-2k: x mol hay (CH2)n(CO2)2H6-2k: x mol
Quá trình quy đổi: (CH2)a-2(CO2)2H6-2k-> CH2(nx mol); CO2(2x mol); H(6-2k)x mol
Sơ đồ phản ứng:
Ta có: 14nx+2x.44+(6-2k)x=12,84 (1)
Bảo toàn electron: 6nx+(6-2k)x=0,37.4 (2)
Lại có: nNaOH=2x=0,22 (3)
Từ (1), (2), (3) suy ra: nx=0,12; x=0,11; k=2
→ X, Y, Z, T là các hợp chất hai chức no, mạch hở.
Ta có: -> Có 1 chất có n = 1
→ X là: CH2(COOH)2; Y là CH3CH(COOH)2; Z là ; T là
→ Ba ancol thu được là CH3OH; C2H5OH; C2H4(OH)2 có số mol bằng nhau → nZ=nT= y mol
Theo đề bài: mancol=32y+46y+62y=2,8-> y=0,02 mol
Gọi số mol X và Y lần lượt là a và b mol.
Câu 40:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào ống nghiệm 2-3 giọt CuSO4 5% và 1 ml dung dịch NaOH 10%. Lắc nhẹ, gạn bỏ phần dung dịch. Lấy kết tủa cho vào ống nghiệm (1).
Bước 2: Rót 1,5 ml dung dịch saccarozo 1% vào ống nghiệm (2) và rót tiếp vào đó 0,5 ml dung dịch H2SO4. Đun nóng dung dịch trong 2-3 phút.
Bước 3: Để nguội dung dịch, cho từ từ NaHCO3 tinh thể vào ống nghiệm (2) và khuấy đều bằng đũa thủy tinh cho đến khi ngừng thoát khí CO2.
Bước 4: Rót dung dịch trong ống nghiệm (2) vào ống nghiệm (1), lắc đều cho đến khi kết tủa tan hoàn toàn.
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Phản ứng hóa học xảy ra ở từng bước:
Bước 1: Xuất hiện kết tủa màu xanh lam đậm: Cu2++ 2OH- -> Cu(OH)2
Bước 2: Saccarozo bị thủy phân trong môi trường axit, thu được glucozo và fructozo:
Bước 3: Trung hòa axit dư trong ống nghiệm (2): HCO3-+H+ -> H2O+CO2
Bước 4: Fructozo, glucozo hòa tan Cu(OH)2 tạo phức màu xanh lam đặc trưng.
Ta thấy:
A đúng vì thủy phân saccarozo thu được hai loại monosaccarit là glucozo và fructozo.
B sai vì nếu không để nguội dung dịch, phản ứng giữa NaHCO3 và axit xảy ra mạnh, tốc độ thoát khí nhanh, có thể làm dung dịch trong ống nghiệm trào ra ngoài gây nguy hiểm.
