Bộ 30 đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án
Bộ 30 đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 23)
-
25112 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 2:
Thủy phân hoàn toàn 111 gam peptit X mạch hở chỉ thu được 133,5 gam alanin duy nhất, số liên kết peptit trong phân tử X là
 Xem đáp án
Xem đáp án
Ta có:
Phương trình: Số liên kết peptit =6-1=5.
Câu 3:
Dung dịch glucozo và saccarozơ có tính chất hóa học chung là
 Xem đáp án
Xem đáp án
B sai vì đây là tính chất vật lí, không phải tính chất hóa học.
Câu 4:
Để đánh giá độ dinh dưỡng của phân kali người ta dựa vào hàm lượng phần trăm của X. X là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 6:
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm hai kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX<MY ) vào nước, thu được 3,36 lít H2 (đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
→ Hai kim loại kiềm là Na (a mol) và K (b mol).
Ta có hệ phương trình: X là Na (0,2 mol): %mX =54,12 %.
Câu 7:
Điện phân NaCl nóng chảy (điện cực trơ), tại catot xảy ra quá trình nào sau đây?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 8:
Hợp chất hữu cơ mạch hở X có công thức phân tử C6H10O4. Thuỷ phân X tạo ra hai ancol đơn chức có số nguyên tử cacbon trong phân tử gấp đôi nhau. Công thức của X là
 Xem đáp án
Xem đáp án
Ta có: k = 2; thủy phân X thu được hái ancol nên X là este hai chức.
Hai ancol có số nguyên tử cacbon gấp đôi nhau nên X chỉ có thể là CH3OCOCH2 COOC2H5.
Chọn đáp án B
Câu 9:
Cho bốn hỗn hợp, mỗi hỗn hợp gồm hai chất rắn có số mol bằng nhau: Na2O và Al2O3; Cu và FeCl3; BaCl2 và CuSO4; Ba và NaHCO3. Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra dung dịch là
 Xem đáp án
Xem đáp án
Chỉ có hỗn hợp Na2O và A12O3 có thể tan hoàn toàn trong nước dư:
Na2O + H2O → 2NaOH
2NaOH + Al2O3 → 2NaAlO2 + H2O.
Câu 10:
Cho Mg vào dung dịch chứa FeSO4 và CuSO4. Sau phản ứng, thu được chất rắn X chỉ có một kim loại và dung dịch Y chứa hai muối. Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Thứ tự xuất hiện kim loại và ion kim loại:
→ Mg hết, CuSO4 hết, FeSO4 chưa phản ứng.
Câu 11:
Cho hỗn hợp gồm kim loại M và Al (tỉ lệ mol 1:1) tan hoàn toàn trong nước dư, thu được 5,6 lít
khi H2 (đktc) và dung dịch Y chứa hai chất tan. Sục khí CO2 dư vào Y, thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Gọi số mol của M và Al lần lượt là a và a mol.
Nếu M là kim loại kiềm: x+3x=0,25.2-> x=0,125
Khi đó:
Nếu M là kim loại kiềm thổ: 2x=3x=0,25.2-> x=0,1
Khi đó: .
Câu 12:
Nung nóng 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là
 Xem đáp án
Xem đáp án
Ta có quá trình:
Bảo toàn khối lượng:
Cho Y phản ứng với HCl ta có thể coi:
Câu 13:
Thực hiện thí nghiệm như hình vẽ sau: Sau khi lắc nhẹ, rồi để yên thì thấy tại ống nghiệm (M) và (N) lần lượt xuất hiện dung dịch
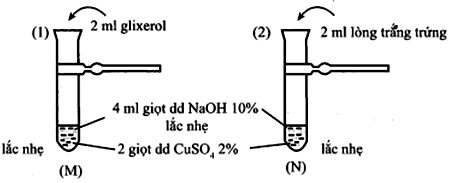
 Xem đáp án
Xem đáp án
Chọn đáp án A
Câu 14:
Hỗn hợp X gồm CaC2 X mol và Al4C3 y mol. Cho một lượng nhỏ X vào H2O rất dư, thu được dung dịch Y, hỗn hợp khí Z (C2H2, CH4) và a gam kết tủa Al(OH)3. Đốt cháy hết Z, rồi cho toàn bộ sản phấm vào Y được 2a gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Tỉ lệ x : y bằng
 Xem đáp án
Xem đáp án
Phương trình hóa học:
CaC2 + 2H2O → Ca(OH)2 + C2H2 ↑
x x mol
Al4C3 + 12H2O → 4Al(OH)3 ↓ + 3CH4 ↑
y 4y mol
Ca(OH)2 + 2Al(OH)3 → Ca(AlO2)2 + 4H2O
x 2x x mol
Dung dịch Y gồm Ca(AlO2)2 (X mol).
Giả sử
Ta có:
Cho CO2 vào dung dịch Y:
Ca(AlO2)2 + 2CO2 + 4H2O → 2Al(OH)3 ↓ + Ca(HCO3)2
x 2x mol
Câu 15:
Đun nóng 0,1 mol este no, đơn chức E với 30 ml dung dịch 28% (d = 1,2 g/ml) của một hiđroxit kim loại kiềm. Sau khi phản ứng kết thúc, cô cạn dung dịch, thu được chất rắn X và 4,6 gam ancol Y. Đốt cháy X, thu được 12,42 gam muối cacbonat, 8,26 gam hỗn hợp khí cacbonic và hơi nước. Tên của E là
 Xem đáp án
Xem đáp án
Bảo toàn nguyên tố M:
Vậy kim loại M là kali (K).
Ta có: ->Y là C2H5OH.
Chất rắn X gồm (0,1 mol) và KOH dư (0,18-0,1=0,08 mol).
Bảo toàn nguyên tố C:
Bảo toàn nguyên tố H:
Theo đề bài: 44.(0,1.(n+1)-0,09+18.(0,1(n-0,5)+0,04)=8,26->n=1
Vậy công thức của muối là CH3COOK
→ Công thức của X là CH3COOC2H5 (etyl axetat).
Câu 16:
Thực hiện các thí nghiệm sau:
(1) Đốt dây sắt trong khí clo. (2) Đốt nóng hỗn hợp bột Fe và S.
(3) Cho FeO vào dung dịch HNO3 (loãng, dư). (4) Cho Fe vào dung dịch Fe2(SO4)3.
(5) Cho Fe vào dung dịch AgNO3 dư. (6) Sục khí clo vào dung dịch FeSO4.
Có bao nhiêu thí nghiệm tạo ra muối sắt(III)?
 Xem đáp án
Xem đáp án
(1) 2Fe + 3Cl2 2FeCl3
(2) Fe + S FeS
(3) 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
(4) Fe + Fe2(SO4)3 → 3FeSO4
(5) Fe + AgNO3 → Fe(NO3)2 + AgNO3
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓
(6) 3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
Các thí nghiệm thu được muối sắt(III) là (1); (3); (5); (6).
Câu 17:
Cho từ từ từng giọt của dung dịch chứa b mol HCl vào dung dịch chứa a mol Na2CO3 thu được V lít khí CO2. Ngược lại, cho từ từ từng giọt của dung dịch chứa a mol Na2CO3 vào dung dịch chứa b mol HCl thu được 2V lít khí CO2 (các thể tích khí đo cùng điều kiện). Mối quan hệ giữa a và b là
 Xem đáp án
Xem đáp án
Cho từ từ a mol HCl vào b mol Na2CO3 thì: Cho từ từ b mol Na2CO3 vào a mol HCl thì:
Theo đề bài ta có:
Câu 18:
Từ tinh bột, điều chế ancol etylic theo sơ đồ sau: Tinh bột Glucozơ C2H5OH. Biết hiệu suất của hai quá trình lần lượt là 80% và 75%. Để điều chế được 200 lít rượu (khối lượng riêng của C2H5OH bằng 0,8 gam/ml) thì cần dùng m kg gạo chứa 90% tinh bột. Giá trị của m là
 Xem đáp án
Xem đáp án
Ta có: Tinh bột → Glucozo → C2H5OH
162 92 gam
x 55,2 kg
Mà H1 = 80% và H2 = 75%: m=97,2:80%:75%:90%=180 kg.
Câu 19:
Cho các phát biểu sau:
(a) Tất cả các peptit đều có phản ứng màu biure.
(b) Muối phenylamoni clorua không tan trong nước.
(c) Ở điều kiện thường, metylamin và đimetylamin là những chất khí.
(d) Trong phân tử peptit mạch hở Gly-Ala-Gly có bốn nguyên tử oxi.
(e) Ở điều kiện thường, amino axit là những chất lỏng.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) sai vì chỉ có peptit có từ hai liên kết peptit trở lên mới có phản ứng màu biure.
(b) sai vì muối phenylamoni clorua (C6H5NH3Cl) chứa liên kết ion tan tốt trong nước.
(c) đúng vì các amin metyỊamin CH3NH2, đimetylamin (CH3)2NH, trimetyl amin (CH3)3N và etyl amin C2H5NH2 đềư là những chất khí, mùi khai và tan tốt trong nước.
(d) đúng mỗi gốc Gly, Ala, Gly đều chứa hai nguyên tử O, trừ đi hai nguyên tử O ở hai liên kết peptit → có bốn nguyên tử O.
(e) sai vì ở điều kiện thường các amino axit là những chất rắn.
Câu 20:
Một bình kín chỉ chứa một ít bột niken và hỗn hợp X gồm 0,05 mol điaxetilen (HC-C-C-CH), 0,1 mol hiđro. Nung nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 22,5. Cho Y phản ứng vừa đủ với 0,04 mol AgNO3 trong NH3, sau phản ứng thu được 5,84 gam kết tủa và 0,672 lít (đktc) hỗn hợp khí Z. Khí Z phản ứng với tối đa a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Ta có:
Gọi số mol của CH ≡ CCH2CH3, CH ≡ CCH = CH2, CH ≡ CC ≡ CH lần lượt là x, y, z mol.
Ta có hệ phương trình:
Bảo toàn liên kết π:
Câu 21:
Cho các phát biểu sau:
(a) Đun nóng dung dịch sacarozo trong môi trường axit chỉ thu được glucozo.
(b) Nhỏ dung dịch brom vào dung dịch phenol lấy dư thấy xuất hiện kết tủa màu trắng.
(c) Để làm sạch lọ đựng anilin thì rửa bằng dung dịch HCl sau đó rửa lại bằng nước.
(d) Có hai chất trong các chất: phenol, etyl axetat, ancol etylic, axit axetic tác dụng được với dung dịch NaOH.
(e) Dầu thực vật và dầu bôi trơn máy có thành phần chính là chất béo.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Các phát biểu đúng là (b), (c).
(a) sai vì thu được glucozo và fructozo.
(d) sai vì có ba chất tác dụng được với dung dịch NaOH là: phenol, etyì axetat, axit axetic.
Câu 22:
Cho từ từ đến dư dung dịch HCl vào dung dịch chứa 0,08 mol K2CO3 và 0,06 mol NaOH. Sự phụ thuộc của lượng khí CO2 thoát ra (y mol) theo số mol của HCl được biểu diễn bằng đồ thị sau: Giá trị của y là
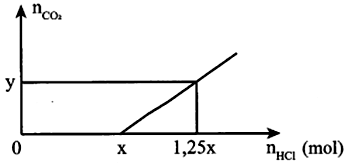
 Xem đáp án
Xem đáp án
Phản ứng theo thứ tự:
Ta có: X=0,08+0,06=0,14 mol-> 1,25x-x=0,25.0,14=0,035
Khi đó: .
Câu 23:
Cho 1 mol chất X (C9H8O4, chứa vòng benzen) tác dụng hết với NaOH dư, thu được 2 mol chất Y, 1 mol chất Z và 1 mol H2O. Chất Z tác dụng với dung dịch H2SO4 loãng thu được chất hữu cơ T. Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Độ bất bão hòa: và 1 mol X → 2 mol Y + 1 mol Z + 1 mol H2O
→ X có dạng
→ Công thức của X là HCOOC6H4CH2OOCH.
Phương trình hóa học:
HCOOC6H4CH2OOCH + 3NaOH → 2HCOONa + NaOC6H4CH2OH + H2O
(X) (Y) (Z)
2NaOC6H4CH2OH + H2SO4 → 2HOC6H4CH2OH + Na2SO4
(Y) (T)
→ T tác dụng với NaOH theo tỉ lệ mol 1 : 1.
Câu 24:
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic và MX<MY; Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X, Y, Z, T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 gam nước. Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa 0,04 mol Br2. Khối lượng muối thu được khi cho cùng lượng E trên tác dụng hết với dung dịch KOH dư là
 Xem đáp án
Xem đáp án
X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic → X và Y chứa một liên kết đôi C = C.
Bảo toàn khối lượng:
Ta thấy: Ancol là no, hai chức.
Quy đổi X thành C3H4O2 (0,04 mol); C3H8O2 (a mol); CH2 (b mol) và H2O (c mol).
Ta có hệ phương trình:
Axit gồm C3H4O2 (0,04 mol) và CH2 (0,02 mol).
→ Muối gồm C3H3COOK (0,04 mol) và CH2 (0,02 mol).
→ m=4,68 gam.
Câu 25:
Cho sơ đồ chuyển hoá giữa các hợp chất của crom:
Các chất X, Y, Z, T theo thứ tự là:
 Xem đáp án
Xem đáp án
Thứ tự các phản ứng xảy ra theo sơ đồ chuyển hóa là:
Cr(OH)3 + KOH → KCrO2 + 2H2O
→ X là KCrO2.
2KCrO2 + 3Cl2 + 8KOH → 2K2CrO4 + 6KCl + 4H2O
→ Y là K2CrO4.
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
→ Z là K2Cr2O7.
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + K2SO4 + 3Fe2(SO4)3 + 7H2O
→ T là Cr2(SO4)3.
Câu 26:
X và Y có công thức phân tử là C4H9O2N. X và Y đều không làm mất màu nước brom. Khi cho X tác dụng với NaOH thì X tạo ra muối X1 và vô cơ X2. Khi cho Y tác dụng với NaOH thì thu được muối Y1 và chất hữu cơ Y2. X1 và Y1 kế tiếp nhau trong dãy đồng đẳng. Các chất X2 và Y2 là
 Xem đáp án
Xem đáp án
Theo dữ kiện đề bài suy ra: X là H2NC3H6COOH và Y là H2NC2H4COOCH3.
→ Các chất X2 và Y2 lần lượt là H2O và CH3OH
Câu 27:
Hỗn hợp X gồm hai este no, đơn chức mạch hở và hai amin no, mạch hở, trong đó có một amin đơn chức và một amin hai chức (hai amin có số mol bằng nhau). Cho m gam X tác dụng vừa đủ 200 ml dung dịch KOH 1M. Mặt khác, đốt cháy hoàn toàn m gam X cần dùng 1,20 mol oxi, thu được CO2, H2O và 0,12 mol N2. Giá trị của m là
 Xem đáp án
Xem đáp án
Hỗn hợp X gồm hai este (0,2 mol); amin no, đơn chức, mạch hở (a mol) và amin no, hai chức, mạch hở (a mol)
Bảo toàn nguyên tố N: a+2a=0,24-> a=0,08
Quy đổi X thành CH2 (x mol); NH3 (0,24 mol); H2 ( mol); O2 (0,2 mol).
Ta có: 1,5x+0,24.0,75-0,08.0,5=1,2+0,2
->x=0,84->m=22,08 gam
Câu 28:
Thực hiện các thí nghiệm sau:
(a) Nhúng thanh Fe nguyên chất vào dung dịch CuSO4.
(b) Cho bột Fe vào dung dịch HNO3 đặc, nguội.
(c) Đốt cháy dây kim loại Fe trong khí Cl2.
(d) Cho hợp kim Fe-Cu vào dung dịch H2SO4 loãng.
(e) Nhúng miếng tôn (Fe-Zn) vào dung dịch muối ăn.
Số thí nghiệm xảy ra ăn mòn kim loại là
 Xem đáp án
Xem đáp án
Các thí nghiệm xảy ra ăn mòn kim loại là: (a), (c), (d).
Câu 29:
Hợp chất hữu cơ X (chứa C, H, O) trong đó oxi chiếm 50% về khối lượng. Từ chất X thực hiện chuyển hoá sau:
Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Gọi công thức của X là .
Ta có:
→ X là CH3OH.
Ta có quá trình: 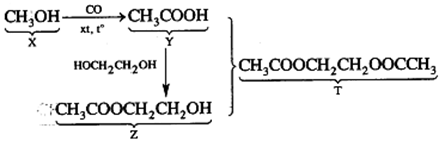
A đúng vì Z là tạp chức este, ancol nên vừa tác dụng được với kim loại Na, vừa tác dụng được với dung địch NaOH.
B đúng vì ta có phương trình hóa học:
CH3COOCH2CH2OOCCH3 + 2NaOH → 2CH3COONa + C2H4 (OH)2
C sai vì Z không hòa tan được Cu(OH)2 ở nhiệt độ thường.
2CH3COOH+Cu(OH)2 → (CH3COO)2Cu + 2H2O.
D đúng.
Câu 30:
Xà phòng hóa hoàn toàn 0,1 mol este E đơn chức, mạch hở bằng 26 gam dung dịch MOH 28% (M là kim loại kiềm) rồi tiến hành chưng cất sản phẩm thu được 26,12 gam chất lỏng và 12,88 gam chất rắn khan Y. Nung chất rắn Y trong bình kín với lượng O2 vừa đủ, sau khi các phản ứng xảy ra hoàn toàn thu được khí CO2, hơi nước và 8,97 gam một muối duy nhất. Cho các phát biểu liên quan tới bài toán:
(a) Thể tích CO2 (ở đktc) thu được là 5,264 lít.
(b) Tổng số nguyên tử C, H, O có trong một phân tử E là 21.
(c) Este E tạo bởi ancol có phân tử khối là 74.
(d) Este E có khả năng tham gia phản ứng tráng bạc.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Bảo toàn nguyên tố M:
Vậy kim loại M là K.
Trong dung dịch KOH có:
→ Ancol là C4H9OH nên (c) đúng.
Y gồm RCOOK (0,1 mol) và KOH dư ().
Ta có: (C2H5)
→ Công thức của E là C2H5COOC4H9 nên (b), (d) sai.
Bảo toàn nguyên tố C:
lít → (a) đúng.
Câu 31:
Chất X ( , là muối amoni của axit cacboxylic đa chức), chất Y ( , là muối amoni của một amino axit). Cho a gam E gồm X và Y (tỉ lệ mol tương ứng 3 : 5) tác dụng hoàn toàn với dung dịch NaOH dư, cô cạn dung dịch sau phản ứng, thu được 4,928 lít khí F (gồm hai amin kế tiếp nhau trong dãy đồng đẳng, có tỉ khối so với H2 bằng 383/22) và 19,14 gam hỗn hợp muối khan. Phần trăm khối lượng của Y trong E là
 Xem đáp án
Xem đáp án
Ta có:
Hỗn hợp F gồm CH3NH2 (x mol) và C2H5NH2 (y mol).
Ta có hệ phương trình:
Ta có quá trình:
Ta có: nF =2.3a+5a=0,22 mol-> a=0,02
Lại có: mmuoi =(MA +134).0,06+( MB+83).0,1 =19,14 gam
So sánh số mol của hai amin và hai muối, suy ra
Câu 32:
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho một nhúm bông vào ống nghiệm đựng dung dịch H2SO4 70%, đun nóng đồng thời khuấy đều đến khi thu được dung dịch đồng nhất.
Bước 2: Để nguội và trung hòa dung dịch thu được bằng dung dịch NaOH 10%.
Bước 3: Lấy dung dịch thu được sau khi trung hòa cho vào ống nghiệm đựng dung dịch AgNO3 trong NH3.
Bước 4: Ngâm ống nghiệm vào cốc nước nóng khoảng 700 C.
Cho các phát biểu sau:
(a) Sau bước 2, nếu nhỏ dung dịch I2 vào ống nghiệm thì thu được dung dịch có màu xanh tím.
(b) Thí nghiệm trên chứng minh xenlulozơ có nhiều nhóm OH.
(c) Sau bước 3, trên thành ống nghiệm xuất hiện lớp kim loại màu trắng bạc.
(d) Sau bước 4, có khí màu nâu đỏ bay ra.
(e) Thí nghiệm trên chứng minh được xenlulozơ có phản ứng thủy phân.
(g) Ở bước 3, xảy ra sự khử glucozơ thành amoni gluconat.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Ta có quá trình:
Bước 1:
Bước 2: H2SO4 + 2NaOH → Na2SO4 + H2O
Bước 3: C6H12O6 2Ag
Phát biểu đúng là (e).
Câu 33:
Cho m gam hỗn hợp E gồm peptit X và amino axit Y (tỉ lệ mol 1:1, trong đó khối lượng của X lớn hơn 20 gam), tác dụng với một lượng dung dịch NaOH vừa đủ thu được dung dịch F chứa (m+12,24 ) gam hỗn hợp muối natri của glyxin và alanin. Dung dịch F phản ứng tối đa 360 ml dung dịch HCl 2M, thu được dung dịch G chứa 63,72 gam hỗn hợp muối. Các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của X trong hỗn hợp E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Quy đổi Z thành C2H3ON (a mol); CH2 (b mol) và H2O (c mol).
Ta có:
Lại có:
Mặt khác:
Ta có:
Nếu Y là Ala thì X có số gốc Ala = 2 và số gốc Gly = 3
→ X là (Gly)3(Ala)2 → (Loại)
Vậy Y là Gly và X là (Gly)2(Ala)3.
->%mX =82,14% .
Câu 34:
Tiến hành điện phân dung dịch X chứa hỗn hợp CuSO4 và KCl (điện cực trơ, màng ngăn xốp) với cường độ dòng điện không đổi thu được kết quả như bảng sau:

Giả sử hiệu suất của phản ứng điện phân là 100%, các khí sinh ra không tan trong nước và nước không bay hơi trong quá trình điện phân. Giá trị của V là
 Xem đáp án
Xem đáp án
Tại t (s):
Tại 2t (s):
Ta thấy: -> Hai khí thoát ra là Cl2 và O2.
Ta có hệ phương trình:
Bảo toàn nguyên tố Cl: nKCl=2.0,08=0,16 mol
Tại 4t (s):
Tại anot:
Bảo toàn electron:
Tại catot:
Bảo toàn electron:
Bảo toàn ngueyen tố Cu:
Tại 3t (s):
→ Có khí thoát ra ở hai điện cực.
Tại catot:
Tại anot:
lít.
Câu 35:
Hỗn hợp X gồm Al, Fe2O3, Fe3O4, CuO, Cu trong đó oxi chiếm 25,39% về khối lượng hỗn hợp. Cho m gam hỗn hợp X tác dụng với 8,96 lít khí CO (ở đktc) sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z có tỉ khối so với hiđro là 19. Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư thu được dung dịch T và 7,168 lít khí NO (ở đktc, sản phẩm khử duy nhất). Cô cạn T thu được 3,456m gam muối khan. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Gọi số mol của CO2 và CO dư trong Z lần lượt là a và b mol.
Bảo toàn nguyên tố C: a + b = 0,4
Lại có: mZ=0,4.38=15,2
Ta có hệ phương trình:
Cho hỗn hợp Y tác dụng với dung dịch HNO3 loãng dư:
Câu 36:
Hỗn hợp X gồm ba este đơn chức, mạch hở được tạo thành từ một ancol với ba axit cacboxylic, trong đó có hai axit no là đồng đẳng kế tiếp nhau và một axit không no (có đồng phân hình học và có hai liên kết pi trong phân tử). Thủy phân hoàn toàn 5,88 gam X bằng dung dịch NaOH, thu được hỗn hợp muối và ancol Y. Cho toàn bộ Y vào bình đựng Na dư, phản ứng xong, thu được 896 ml khí (đktc) và khối lượng bình tăng 2,48 gam so với ban đầu. Mặt khác, đốt cháy hoàn toàn 5,88 gam X, thu được 3,96 gam H2O. Phần trăm khối lượng của este không no trong X có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Ta có:
→ Ancol là CH3OH.
Đặt công thức của este là
->a+b=0,08 (*)
Lại có: (**)
(***)
Từ (*), (**) và (***) suy ra: a=0,06; b=0,02; na+mb=0,08
-> 3a+m=4
Vì axit không no có đồng phân hình học và có hai liên kết pi trong phân tử nên
Câu 37:
Cho 30,24 gam hỗn hợp chất rắn X gồm Mg, MgCO3 và Mg(NO3)2 (trong đó, nguyên tố oxi chiếm 28,57% về khối lượng hỗn hợp) vào dung dịch chứa 0,12 mol HNO3 và 1,64 mol NaHSO4, khuấy đều cho các phản ứng xảy ra hoàn toàn thu được dung dịch Y chỉ chứa các muối trung hòa có khối lượng 215,08 gam và hỗn hợp khí Z gồm N2O, N2, CO2 và H2 (trong đó số mol của N2O bằng số mol của CO2). Tỉ khối hơi của Z so với He bằng a. Giá trị gần nhất của a là
 Xem đáp án
Xem đáp án
-> 24a+18b+1,64.23+1,64.96=215,08
Bảo toàn điện tích: 2a+b+1,64=1,64.2
Đặt số mol của Mg, MgCO3, Mg(NO3)2 lần lượt là x, y, z mol.
-> 24x+84y+148z=30,24(*)
Lại có: nO=0,54 mol-> 3y+6z=0,54 (**)
Bảo toàn nguyên tố Mg: x+y+z=0,8 (***)
Từ (*), (**) và (***) suy ra: x=0,68; y=0,06; z=0,06
->
Ta có:
Bảo toàn nguyên tố H:
Bảo toàn nguyên tố O:
Ta có:
Câu 38:
Hỗn hợp E gồm ancol X, axit caboxylic Y (đều no, đơn chức, mạch hở) và este z tạo bởi X và Y. Đốt cháy hoàn toàn m gam E cần dùng vừa đủ 0,18 mol O2, thu được 0,14 mol CO2. Cho m gam E vào 500ml dung dịch NaOH 0,1M (đun nóng), sau khi kết thúc các phản ứng, thu được dung dịch F. Cô cạn F, thu được 3,68 gam rắn khan G. Cho thêm bột CaO và 0,48 gam NaOH vào 3,68 gam rắn khan G, trộn đều rồi nung trong bình chân không, sau khi phản ứng xảy ra hoàn toàn, thu được a gam khí. Giá trị của a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Ta có quá trình: Theo bảo toàn nguyên tố C và bảo toàn electron cho phản ứng đốt cháy, ta có hệ phương trình:
Lại có: F + 0,012 mol NaOH
Phương trình hóa học:
C2H5COONa + NaOH C2H6 + Na2CO3
0,03 0,032 0,03 mol
.
Câu 39:
Hòa tan hết m gam hỗn hợp X gồm Mg (0,28 mol), Fe3O4, Fe(OH)2 và Cu(OH)2 vào dung dịch chứa 1,8 mol HCl và m gam NaNO3, thu đuợc dung dịch Y chứa (2m + 42,82) gam muối và hỗn hợp khí Z gồm 0,04 mol N2O và 0,05 mol NO. Cho dung dịch NaOH loãng (dư) vào Y, lọc kết tủa nung trong không khí tới khối lượng không đổi, thu được 43,2 gam rắn. Phần trăm so mol của Mg trong X là
 Xem đáp án
Xem đáp án
Bảo toàn khối lượng:
Đặt số mol của Fe3O4, Fe(OH)2 và Cu(OH)2 lần lượt là a, b và c mol.
Bảo toàn nguyên tố H:
Mặt khác:
Ta có: 43,2 gam chất rắn gồm:
Từ (*) và (**) suy ra:
Câu 40:
Cho các chất mạch hở: X là axit không no, mạch phân nhánh, có hai liên kết π; Y và Z là hai axit no, đơn chức; T là ancol no ba chức; E là este của X, Y, Z với T. Đốt cháy hoàn toàn m gam hỗn hợp M gồm X và E, thu được a gam CO2 và (a – 4,62) gam H2O. Mặt khác, m gam M phản ứng vừa đủ với 0,04 mol NaOH trong dung dịch. Cho 13,2 gam M phản ứng vừa đủ với dung dịch NaOH, thu được hỗn hợp muối khan G. Đốt cháy hoàn toàn G, thu được 0,4 mol CO2 và 14,24 gam gồm (Na2CO3 và H2O). Phần trăm khối lượng của E trong M có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Khi m gam M tác dụng với NaOH thì:
Quy đổi m gam M thành:
Ta có hệ phương trình:
Gọi số mol của X và E lần lượt là x và y mol.
Ta có hệ phương trình:
Trong 13,2 gam M (gấp 4 lần 3,3 gam) có CH2 (0,44 mol) và CO2 (0,16 mol).
->nNaOH= 0,16 mol
Khi đốt cháy hoàn toàn G:
Ta có:
→ G gồm CH3COONa, HCOONa, C3H5COONa và T: C3H5(OH)3.
→ E là (C3H5COO)(CH3COO)(C2H5COO)C3H5.
→ %mE=69,7% .
