Bộ đề thi môn Hóa học THPT Quốc gia năm 2022 có lời giải (30 đề)
Bộ đề thi môn Hóa học THPT Quốc gia năm 2022 có lời giải (30 đề) (Đề số 7)
-
26358 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Ở trạng thái cơ bản, cấu hình electron của nguyên tử Na (Z = 11) là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Lý thuyết kim loại kiềm.
Giải chi tiết:
Cấu hình electron của nguyên tử Na (Z = 11) là 1s22s22p63s1.
Câu 2:
Chất nào là monosaccarit?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết cacbohiđrat.
Giải chi tiết:
Glucozơ thuộc loại monosaccarit.
Câu 3:
Trong điều kiện thích hợp glucozơ lên men tạo thành C2H5OH và
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Lý thuyết cacbohiđrat.
Giải chi tiết:
Glucozơ lên men tạo thành C2H5OH và CO2: C6H12O6 2C2H5OH + 2CO2.
Câu 4:
Polime nào sau đây được sử dụng làm chất dẻo?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Lý thuyết polime.
Giải chi tiết:
Polietilen (PE) được sử dụng làm chất dẻo.
Câu 5:
Thủy phân 324 gam tinh bột với hiệu suất của phản ứng là 75%, khối lượng glucozơ thu được
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Phản ứng thủy phân tinh bột: (C6H10O5)n + nH2O nC6H12O6.
Hay viết gọn thành 1C6H10O5 → 1C6H12O6.
Tính nC6H10O5 ban đầu ⟹ nC6H10O5 pư = nC6H10O5 ban đầu.H% ⟹ nC6H12O6.
Giải chi tiết:
Phản ứng thủy phân tinh bột: (C6H10O5)n + nH2O nC6H12O6.
Hay viết gọn thành 1C6H10O5 → 1C6H12O6.
nC6H10O5 ban đầu = 324/162 = 2 mol
⟹ nC6H10O5 pư = 2.75% = 1,5 mol
⟹ nC6H12O6 = nC6H10O5 pư = 1,5 mol
⟹ mC6H12O6 = 1,5.180 = 270 gam.
Câu 6:
Cho x mol axit glutamic tác dụng vừa đủ với dung dịch HCl 1M, thu được dung dịch X. Dung dịch X tác dụng vừa đủ với dung dịch chứa y mol NaOH. Biểu thức liên hệ x và y là.
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Để đơn giản hóa, coi dung dịch X gồm axit glutamic và HCl.
⟹ nNaOH = 2nGlu + nHCl (do axit glutamic chứa 2 nhóm -COOH).
Giải chi tiết:
Axit glutamic chứa 1 nhóm -NH2 ⟹ nHCl = nGlu = x mol.
Để đơn giản hóa, coi dung dịch X gồm x mol axit glutamic và x mol HCl.
⟹ nNaOH = 2nGlu + nHCl (do axit glutamic chứa 2 nhóm -COOH).
⟹ y = 2x + x = 3x.
Câu 7:
Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C3H12N2O3). X là muối của axit hữu cơ đa chức, Y là muối của một axit vô cơ. Cho 3,86 gam E tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,06 mol hai khí (có tỉ lệ mol 1:5) và dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Từ CTPT ⟹ Các CTCT có thể có của X và Y.
⟹ Khi 1 mol X và Y tác dụng với NaOH đều sinh ra 2 mol khí.
- Đặt nX = a mol; nY = b mol
Lập hệ PT tìm a và b dựa vào khối lượng hỗn hợp E và tổng số mol hỗn hợp khí
- Từ tỉ lệ số mol 2 khí là 1 : 5 ⟹ CTCT thỏa mãn của X và Y
Viết PTHH của X, Y tác dụng với NaOH ⟹ thành phần của muối ⟹ giá trị của m.
Giải chi tiết:
- Từ CTPT ⟹ X có thể là CH2(COONH4)2 hoặc NH4OOC-COONH3CH3
Y có thể là (CH3NH3)2CO3 hoặc NH4CO3NH3C2H5
⟹ Khi 1 mol X và Y tác dụng với NaOH đều sinh ra 2 mol khí.
- Đặt nX = a mol; nY = b mol
⟹ ⟹ a = 0,01 mol; b = 0,02 mol
- Do tỉ lệ mol 2 khí là 1 : 5 ⟹ Hỗn hợp E gồm
NH4OOC-COONH3CH3 + 2NaOH → (COONa)2 + NH3 ↑ + CH3NH2 ↑ + 2H2O
0,01 → 0,01
(CH3NH3)2CO3 + 2NaOH → Na2CO3 + 2CH3NH2 ↑ + 2H2O
0,02 → 0,02
⟹ m = m(COONa)2 + mNa2CO3 = 0,01.134 + 0,02.106 = 3,46 gam.
Câu 8:
Chất nào dưới đây cho phản ứng tráng bạc?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Chất có phản ứng tráng gương (tráng bạc) là chất chứa nhóm -CHO trong phân tử. Một số loại chất có phản ứng tráng bạc thường gặp:
- Anđehit
- Glucozơ, Fructozơ (vì có thể chuyển thành glucozơ trong MT kiềm)
- Các chất có đầu là HCOO- (axit, este, muối)
Giải chi tiết:
HCOOH cho phản ứng tráng bạc vì có đầu HCOO-.
Câu 9:
Chất nào dưới đây tạo phức màu tím với Cu(OH)2?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Những peptit có từ 2 liên kết peptit trở lên (tripeptit) có phản ứng màu biure tạo phức màu tím với Cu(OH)2.
Giải chi tiết:
Ala-Gly-Val có phản ứng màu biure tạo phức màu tím với Cu(OH)2.
Câu 10:
Este nào sau đây có mùi chuối chín?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết ứng dụng của este.
Giải chi tiết:
Isoamyl axetat (CH3COOCH2CH2CH(CH3)2) có mùi chuối chín.
Câu 11:
Đốt cháy hoàn toàn 0,15 mol một amin X no, đơn chức, mạch hở bằng khí oxi vừa đủ thu được 1,2 mol hỗn hợp gồm CO2, H2O và N2. Số đồng phân bậc 1 của X là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
CTTQ của amin no, đơn chức, mạch hở là CnH2n+3N.
Phản ứng đốt cháy: CnH2n+3N + (1,5n + 0,75) O2 nCO2 + (n + 1,5) H2O + 0,5 N2
Giải chi tiết:
CTTQ của amin no, đơn chức, mạch hở là CnH2n+3N.
Phản ứng đốt cháy: CnH2n+3N + (1,5n + 0,75) O2 nCO2 + (n + 1,5) H2O + 0,5 N2
Từ đề bài ⟹ ⟹ n = 3 ⟹ Amin X là C3H9N.
⟹ Có 2 đồng phân amin bậc 1 có CTPT C3H9N là CH3CH2CH2NH2 và CH3CH(NH2)CH3.
Câu 12:
Cho dãy các chất: phenyl axetat, metyl axetat, etyl fomat, tripanmitin, vinyl axetat. Số chất trong dãy khi thủy phân trong dung dịch NaOH loãng, đun nóng sinh ra ancol là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Este RCOOR' thủy phân sinh ra ancol khi nhóm COO liên kết với nguyên tử C no của gốc R'.
Giải chi tiết:
Este RCOOR' thủy phân sinh ra ancol khi nhóm COO liên kết với nguyên tử C no của gốc R'.
- Phenyl axetat: CH3COOC6H5 + 2NaOH CH3COONa + C6H5ONa + H2O
- Metyl axetat: CH3COOCH3 + NaOH CH3COONa + CH3OH
- Etyl fomat: HCOOC2H5 + NaOH HCOONa + C2H5OH
- Tripanmitin: (C15H31COO)3C3H5 + 3NaOH 3C15H31COONa + C3H5(OH)3
- Vinyl axetat: CH3COOCH=CH2 + NaOH CH3COONa + CH3CHO
Vậy có 3 chất thỏa mãn: metyl axetat, etyl fomat, tripanmitin.
Câu 13:
Đun nóng tristearin trong dung dịch NaOH thu được glixerol và
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết về chất béo.
Giải chi tiết:
CTHH của tristearin là (C17H35COO)3C3H5.
PTHH: (C17H35COO)3C3H5 + 3NaOH 3C17H35COONa (natri panmitat) + C3H5(OH)3 (glixerol)
⟹ Thu được glixerol và C17H35COONa.
Câu 14:
Cho các cân bằng sau:
(1) 2SO2 (k) + O2 (k) ⇄ 2SO3 (k); (2) N2 (k) + 3H2 (k) ⇄ 2NH3 (k);
(3) CO2 (k) + H2 (k) ⇄ CO (k) + H2O (k); (4) 2HI (k) ⇄ H2 (k) + I2 (k).
Khi thay đổi áp suất của hệ, các cân bằng hóa học không bị chuyển dịch là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Những cân bằng nào có tổng số mol khí ở 2 vế bằng nhau, sẽ không chịu sự ảnh hưởng của áp suất (không bị chuyển dịch khi thay đổi áp suất).
Giải chi tiết:
- Các cân bằng (1), (2) có số mol khí ở hai vế khác nhau ⟹ Cân bằng bị chuyển dịch khi thay đổi áp suất.
- Các cân bằng (3), (4) có số mol khí ở hai vế bằng nhau ⟹ Cân bằng không bị chuyển dịch khi thay đổi áp suất.
Câu 15:
Một loại phân lân có chứa 35% Ca3(PO4)2 về khối lượng, còn lại là các chất không chứa photpho. Độ dinh dưỡng của loại phân lân này là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Độ dinh dưỡng của phân lân được tính bằng phần trăm về khối lượng của P2O5.
Giải chi tiết:
Xét trong 100 gam loại phân này có chứa 35 gam Ca3(PO4)2
⟹ nCa3(PO4)2 = 35/310 = 7/62 (mol)
BTNT P: nP2O5 = nCa3(PO4)2 = 7/62 (mol)
⟹ %mP2O5 = ≈ 16,03%.
Câu 16:
Hiệu ứng nhà kính là hiện tượng trái đất nóng lên do có bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại mà không bức xạ ra ngoài vũ trụ. Khí nào dưới đây là nguyên nhân gây nên hiệu ứng nhà kính?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Giải chi tiết:
Khí CO2 là nguyên nhân gây nên hiệu ứng nhà kính.
Câu 17:
Hình vẽ sau đây mô tả thí nghiệm điều chế chất hữu cơ Y:
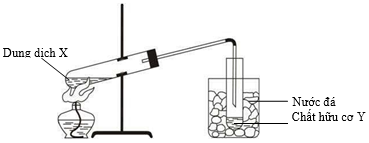
Phản ứng nào đã xảy ra trong thí nghiệm trên?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lựa chọn phản ứng phù hợp với hình vẽ thí nghiệm theo các tiêu chí:
- Trạng thái các chất phản ứng và sản phẩm phải phù hợp (rắn, lỏng, khí).
- Mỗi bộ phận trong bộ dụng cụ thí nghiệm đều phải có ý nghĩa (làm lạnh, ngưng tụ, …).
Giải chi tiết:
Phản ứng xảy ra trong hình vẽ thí nghiệm trên là:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Khi đó este sinh ra dễ bay hơi nên cần cốc nước đá để hơi este ngưng tụ thành dạng lỏng.
- Loại B, C vì phản ứng xảy ra ở điều kiện thường và các muối sinh ra không bay hơi.
- Loại D vì Cu(OH)2 là chất rắn.
Câu 18:
Este nào sau đây khi đốt cháy thu được số mol CO2 bằng số mol H2O?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Đốt cháy este no, đơn chức, mạch hở thu được số mol CO2 bằng số mol H2O.
Giải chi tiết:
Este đốt được nCO2 = nH2O ⟹ Este no, đơn chức, mạch hở ⟹ Este thỏa mãn là CH3COOCH3.
Câu 19:
Amin nào sau đây có lực bazơ mạnh nhất?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Cách sắp xếp tính bazơ của các amin: R-N
+ R đẩy e ⟹ làm tăng mật độ electron trên N ⟹ tăng tính bazơ.
+ R hút e ⟹ làm giảm tính bazơ.
Ghi nhớ: Amin thơm < NH3 < amin no < NaOH;
Amin no bậc 1 < amin no bậc 2.
Trong dãy đồng đẳng amin no đơn chức, mạch hở, mạch C càng dài ⟹ tính bazơ càng tăng (do gốc ankyl càng dài đẩy electron càng mạnh).
Giải chi tiết:
So sánh tính bazơ:
Benzenamin (C6H5NH2) < Amoniac (NH3) < Metanamin (CH3NH2) < Etanamin (C2H5NH2).
Amin có lực bazơ mạnh nhất trong dãy là etanamin.
Câu 20:
Số đipeptit tối đa có thể tạo ra từ một hỗn hợp gồm alanin và valin là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Ghép 2 gốc amino axit để tạo ra đipeptit (lưu ý đipeptit được tạo ra từ hỗn hợp trên có thể chứa 2 gốc amino axit giống nhau).
Giải chi tiết:
Từ hỗn hợp alanin (Ala) và valin (Val) có thể tạo ra tối đa 4 đipeptit: Ala-Ala; Val-Val; Ala-Val; Val-Ala.
Câu 21:
Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion rút gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion rút gọn.
Giải chi tiết:
Phản ứng NaOH + HCl → NaCl + H2O có phương trình ion thu gọn là H+ + OH- → H2O
A: NH4+ + OH- → NH3 ↑ + H2O
B: HCO3- + OH- → CO32- + H2O
C: H+ + OH- → H2O
D: Fe2+ + 2OH- → Fe(OH)2 ↓
Vậy phản ứng ở đáp án C có cùng phương trình ion thu gọn với phản ứng ở đề bài.
Câu 22:
Nhận biết sự có mặt của đường glucozơ trong nước tiểu, người ta có thể dùng thuốc thử nào trong các thuốc thử sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết về glucozơ.
Giải chi tiết:
Glucozơ có phản ứng tráng bạc ⟹ có thể dùng dung dịch AgNO3/NH3, to để nhận biết sự có mặt của glucozơ trong nước tiểu.
Câu 23:
Chất nào sau đây là hiđrocacbon?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Hiđrocacbon là hợp chất hữu cơ phân tử chỉ chứa C và H.
Giải chi tiết:
Hiđrocacbon là hợp chất hữu cơ phân tử chỉ chứa C và H ⟹ C2H6 là hiđrocacbon.
Câu 24:
Số nguyên tử hiđro trong phân tử glyxin là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết amino axit.
Giải chi tiết:
CTCT của glyxin là H2NCH2COOH ⟹ Glyxin có 5 nguyên tử H trong phân tử.
Câu 25:
Cho 2,9 gam hỗn hợp X gồm anilin, metyl amin, đimetyl amin phản ứng vừa đủ với 50 ml dung dịch HCl 1M thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Sơ đồ phản ứng: Amin + HCl → Muối
BTKL: mmuối = mamin + mHCl
Giải chi tiết:
nHCl = 0,05.1 = 0,05 mol
Sơ đồ phản ứng: Amin + HCl → Muối
BTKL: mmuối = mamin + mHCl = 2,9 + 0,05.36,5 = 4,725 gam.
Câu 26:
Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn este no, đơn chức, mạch hở, thu được CO2 và H2O có số mol bằng nhau.
(b) Trong phản ứng với dung dịch AgNO3 trong NH3, glucozơ là chất bị khử.
(c) Để rửa ống nghiệm có dính anilin có thể tráng ống nghiệm bằng dung dịch HCl.
(d) Tinh bột và xenlulozơ là hai chất đồng phân của nhau.
(e) Glucozơ và saccarozơ đều tác dụng với H2 (xúc tác Ni, đun nóng) tạo sobitol.
(f) Thành phần hợp chất hữu cơ nhất thiết phải có chứa nguyên tố cacbon và nguyên tố hiđro.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết tổng hợp về este, cacbohiđrat, amin.
Giải chi tiết:
- (a) đúng.
- (b) sai, trong phản ứng với dung dịch AgNO3 trong NH3, glucozơ là chất bị oxi hóa.
- (c) đúng (có phản ứng C6H5NH2 + HCl → C6H5NH3Cl).
- (d) sai, vì số mắt xích n của tinh bột và xenlulozơ khác nhau.
- (e) sai, saccarozơ không tác dụng với sobitol.
- (f) sai, thành phần hợp chất hữu cơ không nhất thiết phải chứa nguyên tố H.
Vậy có 2 phát biểu đúng.
Câu 27:
Cho 17,6 gam hỗn hợp X gồm Fe và Cu vào dung dịch HCl dư thấy có 4,48 lít khí H2 (đktc) thoát ra. Khối lượng Cu trong X là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Chỉ Fe có phản ứng với HCl, Cu không phản ứng:
Fe + 2HCl → FeCl2 + H2
Từ nH2 ⟹ nFe ⟹ mFe ⟹ mCu = mX - mFe
Giải chi tiết:
nH2 = 4,48/22,4 = 0,2 mol
Chỉ Fe có phản ứng với HCl, Cu không phản ứng:
Fe + 2HCl → FeCl2 + H2
0,2 ← 0,2 (mol)
⟹ mFe = 0,2.56 = 11,2 gam.
⟹ mCu = mX - mFe = 17,6 - 11,2 = 6,4 gam.
Câu 28:
C4H10O có bao nhiêu đồng phân ancol?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Cách viết đồng phân ancol:
- Viết các mạch C có thể có
- Xác định các vị trí mà nhóm OH có thể gắn vào
Giải chi tiết:
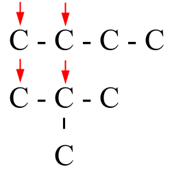
(mũi tên chỉ vị trí mà nhóm OH có thể gắn vào).
⟹ Có 4 đồng phân ancol.
Câu 29:
Đốt cháy hoàn toàn một lượng hỗn hợp X chứa glucozơ, fructozơ và saccarozơ cần dùng vừa đủ 37,632 lít khí O2 (đktc) thu được CO2 và H2O. Cho toàn bộ sản phẩm cháy qua dung dịch Ba(OH)2 dư thấy có m gam kết tủa xuất hiện. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Khi đốt cháy cacbohiđrat luôn có: nO2 = nCO2 (HS có thể tự chứng minh bằng cách viết PTHH).
Giải chi tiết:
nO2 = 37,632/22,4 = 1,68 mol
Hỗn hợp X chỉ chứa các cacbohiđrat nên ta có: nCO2 = nO2 = 1,68 mol
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O
1,68 → 1,68 (mol)
⟹ m = 1,68.197 = 330,96 gam.
Câu 30:
Đốt cháy hoàn toàn a mol triglixerit X thu được x mol CO2 và y mol H2O với x = y + 4a. Nếu thủy phân hoàn toàn X thu được hỗn hợp glixerol, axit oleic, axit stearic. Số nguyên tử H trong X là:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
- Công thức tính nhanh khi đốt cháy chất béo: (với k là độ bất bão hòa của chất béo)
⟹ độ bất bão hòa k của X.
- Từ đề bài X được cấu tạo từ gốc oleat và stearat, kết hợp với độ bất bão hòa k ⟹ CTCT của X.
Giải chi tiết:
- Công thức tính nhanh khi đốt cháy chất béo: (với k là độ bất bão hòa của chất béo)
⟹ ⟹ k = 5 ⟹ X có chứa 5 liên kết π.
Mà theo đề X được cấu tạo từ gốc oleat và stearat
⟹ CTCT của X là (C17H33COO)2C17H35COOC3H5
⟹ Trong phân tử X có chứa 106 nguyên tử H.
Câu 31:
Cho hỗn hợp E gồm 0,1 mol X (C11H27O6N3, là muối của lysin) và 0,15 mol Y (C5H14O4N2, là muối của axit cacboxylic hai chức) tác dụng hoàn toàn với dung dịch KOH, thu được hai amin no, đơn chức (kế tiếp trong dãy đồng đẳng) và dung dịch T. Cô cạn T, thu được hỗn hợp G gồm ba muối khan (trong đó có hai muối của hai axit cacboxylic có cùng số nguyên tử cacbon). Phần trăm khối lượng của muối có phân tử khối lớn nhất trong G là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Công thức cấu tạo của lysin là H2N-C4H8-CH(NH2)-COOH hoặc viết gọn thành (NH2)2-C5H9-COOH
- Lysin là amino axit có 1 nhóm -COOH, 2 nhóm NH2
Mà X là muối của lysin trong phân tử có 6O, 3N
⟹ 2 nhóm -NH2 trong lysin tạo muối với 2 phân tử axit cacboxylic
1 nhóm -COOH trong lysin tạo muối với 1 phân tử amin
- Y là muối của axit cacboxylic, Y chứa 2N ⟹ 2 nhóm -COOH của axit tạo muối với phân tử amin.
- Kết hợp với dữ kiện từ đề bài:
+ 2 amin thu được là 2 amin no, đơn chức kế tiếp trong dãy đồng đẳng.
+ Hỗn hợp G gồm 3 muối khan trong đó có 2 muối có cùng số C.
⟹ CTCT của X, Y.
⟹ Thành phần muối của hỗn hợp G ⟹ % khối lượng muối có PTK lớn nhất trong G.
Giải chi tiết:
- Lysin là amino axit có 1 nhóm -COOH, 2 nhóm NH2
Mà X là muối của lysin trong phân tử có 6O, 3N
⟹ 2 nhóm -NH2 trong lysin tạo muối với 2 phân tử axit cacboxylic
1 nhóm -COOH trong lysin tạo muối với 1 phân tử amin
- Y là muối của axit cacboxylic chứa 2N ⟹ 2 nhóm -COOH của axit tạo muối với phân tử amin.
- Kết hợp với dữ kiện từ đề bài:
+ 2 amin thu được là 2 amin no, đơn chức kế tiếp trong dãy đồng đẳng.
+ Hỗn hợp G gồm 3 muối khan trong đó có 2 muối có cùng số C.
⟹ X là (CH3COONH3)2-C5H9-COONH3CH3
Y là CH3NH3OOC-COONH3C2H5
(CH3COONH3)2-C5H9-COONH3CH3 + 3KOH → (NH2)2-C5H9-COOK + 2CH3COOK + 3CH3NH2 + 3H2O
0,1 mol → 0,1 mol → 0,2 mol
CH3NH3OOC-COONH3C2H5 + 2KOH → (COOK)2 + CH3NH2 + C2H5NH2 + 2H2O
0,15 mol → 0,15 mol
⟹ Hỗn hợp muối G gồm:
⟹ %mLys-K = 29,25%.
Câu 32:
Hỗn hợp E gồm 3 este mạch hở: X (CxH2xO2); Y (CnH2n-2O2) và este Z (CmH2m-4O4) đều tạo từ axit cacboxylic và ancol. Đốt cháy hoàn toàn 0,2 mol E bằng lượng oxi vừa đủ, thu được CO2 và H2O có tổng khối lượng 47,0 gam. Mặt khác, hiđro hóa hoàn toàn 0,2 mol E cần dùng 0,08 mol H2 (xúc tác Ni, t0). Nếu đun nóng 0,2 mol E với dung dịch NaOH vừa đủ, thu được hỗn hợp T chứa 2 ancol đều no có cùng số nguyên tử cacbon, dẫn hỗn hợp T qua bình đựng Na dư, thấy thoát ra 2,576 lít khí H2 (đktc).
Cho các phát biểu sau:
(1) Phần trăm khối lượng của Y trong E là 27,47%.
(2) Tổng số nguyên tử trong một phân tử Z là 20.
(3) Đốt cháy hoàn toàn 0,2 mol X cần dùng 0,7 mol O2.
(4) Đun nóng E với dung dịch KOH thu được tối đa 3 muối.
(5) Trong T có ancol C3H7OH.
(6) Khối lượng của T là 9,68 gam.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
- Khi dẫn T qua bình đựng Na:
nNaOH = nOH (T) = 2nH2
- Lập hệ 3 PT 3 ẩn nX, nY, nZ để tìm số mol mỗi este ban đầu dựa vào:
+ Tổng số mol của E.
+ Khi hidro hóa E cần 0,08 mol H2 (Y, Z chưa no bị hidro hóa).
+ Số mol NaOH phản ứng bằng số mol nhóm chức -COO-.
- Đặt nCO2 = a mol; nH2O = b mol
Lập hệ PT tìm a và b dựa vào:
+ Tổng khối lượng.
+ Chêch lệch số mol CO2 và H2O gây ra bởi Y (2π) và Z (3π).
- Hai ancol có cùng số C ⟹ Các ancol phải có ít nhất 2C
⟹ x ≥ 3; n ≥ 5; m ≥ 6
⟹ Nghiệm x, n, m phù hợp ⟹ CTCT các este ban đầu.
- Đối chiếu lại với các nhận định.
Giải chi tiết:
- Khi dẫn T qua bình đựng Na:
nOH (T) = 2nH2 = 2.0,115 = 0,23 mol ⟹ nNaOH = nOH (T) = 0,23 mol
- Khi hidro hóa E: nH2 = nY + nZ = 0,08 mol
- Ta có: nNaOH = nX + nY + 2nZ = 0,23 mol
⟹ ⟹
- Đặt nCO2 = a mol; nH2O = b mol
⟹ ⟹
- BTNT C: nCO2 = 0,12x + 0,05n + 0,03m = 0,79
Hai ancol có cùng số C ⟹ Các ancol phải có ít nhất 2C ⟹ x ≥ 3; n ≥ 5; m ≥ 6
Nhận thấy x = 3; n = 5; m = 6 là nghiệm duy nhất.
⟹ X là HCOOC2H5 (0,12 mol)
Y là CH2=CHCOOC2H5 (0,05 mol)
Z là CH2=CHCOO-CH2-CH2-OOCH (0,03 mol)
* Đối chiếu với các nhận định:
(1) đúng, %mY = 27,47%.
(2) sai, tổng số nguyên tử trong 1 phân tử Z là 18.
(3) đúng, C3H6O2 + 3,5O2 → 3CO2 + 3H2O.
(4) sai, chỉ thu được 2 muối là HCOONa và CH2=CHCOONa.
(5) sai, T chứa C2H5OH và C2H4(OH)2.
(6) đúng, mT = (0,12 + 0,05).46 + 0,03.62 = 9,68 gam.
Vậy có 3 nhận định đúng.
Câu 33:
Cho hỗn hợp E gồm hai este X và Y (MX < MY) phản ứng hoàn toàn với dung dịch NaOH, thu được sản phẩm muối của một axit cacboxylic đơn chức và hỗn hợp hai ancol no, đơn chức, kế tiếp trong dãy đồng đẳng. Mặt khác, đốt cháy hoàn toàn 27,2 gam E cần vừa đủ 1,5 mol O2, thu được 29,12 lít khí CO2 (đktc). Tên gọi của X và Y là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
- BTKL: mH2O = mE + mO2 - mCO2
- BTNT O: nO (E) = 2nCO2 + nH2O - 2nO2
- Este đơn chức: nE = nO (E)/2
- Tính số C trung bình:
- Công thức tính nhanh khi đốt cháy este: (với k là độ bất bão hòa của este)
⟹ giá trị của k
- Tính số CTB của hỗn hợp este kết hợp với k ⟹ Công thức các este.
Giải chi tiết:
*Khi đốt E:
nCO2 = 29,12/22,4 = 1,3 mol
BTKL: mH2O = mE + mO2 - mCO2 = 27,2 + 1,5.32 - 1,3.44 = 18 gam
⟹ nH2O = 1 mol
BTNT O: nO (E) = 2nCO2 + nH2O - 2nO2 = 2.1,3 + 1 - 2.1,5 = 0,6 mol
*Khi E + NaOH:
- Sản phẩm gồm muối của axit cacboxylic đơn chức và ancol đơn chức
⟹ X, Y đều là este đơn chức (chứa 2O).
⟹ nE = nO(E)/2 = 0,6/2 = 0,3 mol
⟹
- Sản phẩm gồm 1 muối và 2 ancol kế tiếp ⟹ X, Y hơn kém nhau 1 nguyên tử C
⟹ X có 4C và Y có 5C
- Công thức tính nhanh khi đốt cháy este: (với k là độ bất bão hòa của este)
⟹ k = = 2
⟹ Mỗi este chứa 1 liên kết đôi C=C
⟹ X: CH2=CHCOOCH3: metyl acrylat
Y: CH2=CHCOOCH2CH3: etyl acrylat.
Câu 34:
Để hòa tan hết 38,36 gam hỗn hợp R gồm Mg, Fe3O4, Fe(NO3)2 cần 0,87 mol dung dịch H2SO4 loãng, sau khi các phản ứng xảy ra hoàn toàn thu được 111,46 gam muối sunfat trung hòa và 5,6 lít (đktc) hỗn hợp khí X gồm hai khí không màu, tỉ khối hơi của X so với H2 là 3,8 (biết có một khí không màu hóa nâu ngoài không khí). Phần trăm khối lượng Mg trong R gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
- Xét hỗn hợp khí:
+) MX = 7,6 ⟹ Trong X chứa H2.
+) Khí không màu hóa nâu trong không khí là NO.
Tìm số mol NO, H2 trong X bằng phương pháp đường chéo hoặc đặt ẩn giải hệ.
- BTKL: mH2O = mR + mH2SO4 - mmuối - mX
- BTNT H: nNH4+ = (2nH2SO4 - 2nH2 - 2nH2O) : 4
- BTNT N: nFe(NO3)2 = (nNH4+ + nNO) : 2
- Ion H+ tham gia vào các quá trình sau:
4H+ + NO3- + 3e → NO + 2H2O
10H+ + NO3- + 3e → NH4+ + 3H2O
2H+ + 2e → H2
2H+ + O2- → H2O
⟹ nH+ = 4nNO + 10nNH4+ + 2nH2 + 2nO2-
⟹ nO2- ⟹ nFe3O4
⟹ mMg = mR - mFe(NO3)2 - mFe3O4 ⟹ %mMg
Giải chi tiết:
- Xét hỗn hợp khí X:
+) MX = 7,6 ⟹ Trong X chứa H2.
+) Khí không màu hóa nâu trong không khí là NO.
Đặt nNO = x mol và nH2 = y mol.
⟹ ⟹ x = 0,05; y = 0,2.
- BTKL: mH2O = mR + mH2SO4 - mmuối - mX = 38,6 + 0,87.98 - 111,46 - 1,9 = 10,26 g ⟹ nH2O = 0,57 mol.
- BTNT H: nNH4+ = (2nH2SO4 - 2nH2 - 2nH2O) : 4 = (2.0,87 - 2.0,2 - 2.0,57) : 4 = 0,05 mol.
- BTNT N: nFe(NO3)2 = (nNH4+ + nNO) : 2 = (0,05 + 0,05) : 2 = 0,05 mol.
- Ion H+ tham gia vào các quá trình sau:
4H+ + NO3- + 3e → NO + 2H2O
10H+ + NO3- + 3e → NH4+ + 3H2O
2H+ + 2e → H2
2H+ + O2- → H2O
⟹ nH+ = 4nNO + 10nNH4+ + 2nH2 + 2nO2-
⟹ nO2- = (2.0,87 - 4.0,05 - 10.0,05 - 2.0,2) : 2 = 0,32 mol
⟹ nFe3O4 = 0,32/4 = 0,08 mol
⟹ mMg = mR - mFe(NO3)2 - mFe3O4 = 38,36 - 0,05.180 - 0,08.232 = 10,8 gam.
⟹ %mMg = (10,8/38,36).100% ≈ 28,154%.
Câu 35:
Hỗn hợp X gồm phenyl axetat và axit axetic có tỉ lệ mol tương ứng là 1 : 2. Cho 0,3 mol hỗn hợp X phản ứng vừa đủ với dung dịch hỗn hợp KOH 1,5M và NaOH 2,5M thu được x gam hỗn hợp muối. Giá trị của x là:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Tính số mol mỗi chất trong hỗn hợp dựa vào tổng số mol và tỉ lệ mol.
- Sử dụng phương pháp trung bình:
Đặt công thức trung bình của KOH và NaOH là ⟹ .
- Xác định thành phần của muối ⟹ khối lượng muối.
Giải chi tiết:
Dễ thấy 0,3 mol hỗn hợp X gồm 0,1 mol CH3COOC6H5 và 0,2 mol CH3COOH.
Gọi công thức chung của NaOH và KOH là ⟹
Tóm tắt:
⟹ mmuối = 0,3.(15 + 44 + 29) + 0,1.(12.6 + 5 + 16 + 29) = 38,6 gam.
Câu 36:
Tiến hành thí nghiệm sau:
Bước 1: Cho vào ống nghiệm 2 ml nước cất.
Bước 2: Nhỏ tiếp vài giọt anilin vào ống nghiệm, sau đó nhúng giấy quỳ tím vào dung dịch trong ống nghiệm.
Bước 3: Nhỏ tiếp 1 ml dung dịch HCl đặc vào ống nghiệm.
Cho các phát biểu sau:
(a) Sau bước 2, dung dịch thu được trong suốt.
(b) Sau bước 2, giấy quỳ tím chuyển thành màu xanh.
(c) Sau bước 3, dung dịch thu được trong suốt.
(d) Sau bước 3, trong dung dịch có chứa muối phenylamoni clorua tan tốt trong nước.
(e) Sau bước 2, dung dịch bị vẩn đục.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Tính chất vật lí, hóa học của anilin.
Giải chi tiết:
- (a), (e) sai: sau bước 2, chất lỏng tách thành 2 lớp do anilin hầu như không tan trong nước và lắng xuống đáy ống nghiệm.
- (b) sai vì anilin có tính bazơ rất yếu, không làm đổi màu quỳ tím.
- (c), (d) đúng: anilin có phản ứng với HCl tạo muối phenylamoni clorua tan tốt trong nước tạo dung dịch trong suốt.
PTHH: C6H5NH2 + HCl → C6H5NH3+Cl- (phenylamoni clorua)
Vậy có 2 phát biểu đúng.
Câu 37:
Cho các phát biểu sau:
(1) Chất béo là trieste của glixerol với axit béo.
(2) Chất béo nhẹ hơn nước và không tan trong nước.
(3) Glucozơ thuộc loại monosaccarit.
(4) Các este bị thủy phân trong môi trường kiềm đều tạo muối và ancol.
(5) Tất cả các peptit đều có phản ứng với Cu(OH)2 tạo thành hợp chất màu tím.
(6) Dung dịch saccarozơ không tham gia phản ứng tráng bạc.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Lý thuyết tổng hợp chương Este - Lipit và chương Cacbohiđrat.
Giải chi tiết:
(1) đúng.
(2) đúng.
(3) đúng.
(4) sai, có các este thủy phân trong môi trường kiềm tạo anđehit, xeton, …
(5) sai, chỉ các peptit chứa từ 2 liên kết peptit trở lên (từ tripeptit) có phản ứng màu biure với Cu(OH)2 tạo thành hợp chất màu tím.
(6) đúng.
Vậy có 4 phát biểu đúng.
Câu 38:
Hỗn hợp X gồm a mol P và b mol S. Hoà tan hoàn toàn X trong dung dịch HNO3 đặc, nóng lấy dư 20% so với lượng cần phản ứng thu được dung dịch Y và thoát ra khí NO2 (sản phẩm khử duy nhất). Trung hoà dung dịch Y bằng NaOH thì cần bao nhiêu mol?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Cách 1: Tính toán theo các PTHH
P + 5HNO3 đ H3PO4 + 5NO2 + H2O
S + 6HNO3 đ H2SO4 + 6NO2 + 2H2O
Các phản ứng xảy ra khi trung hòa:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
HNO3 + NaOH → NaNO3 + H2O
Cách 2: Sử dụng bảo toàn e
- Khi X + HNO3:
Áp dụng bảo toàn e: nNO2 = 5nP + 6nS.
Bảo toàn nguyên tố N: nHNO3 pư = nNO2 ⟹ nHNO3 dư = 20%.nHNO3 pư.
- Khi trung hòa thì nOH- = nH+ ⟹ nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư.
Giải chi tiết:
Cách 1: Viết PTHH
P + 5HNO3 đ H3PO4 + 5NO2 + H2O
a → 5a → a (mol)
S + 6HNO3 đ H2SO4 + 6NO2 + 2H2O
b → 6b → b (mol)
⟹ nHNO3 pứ = 5a + 6b (mol)
⟹ nHNO3 dư = 20%.nHNO3 pứ = 20%.(5a + 6b) = a + 1,2b (mol)
⟹ Dung dịch Y gồm
Các phản ứng xảy ra khi trung hòa:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
HNO3 + NaOH → NaNO3 + H2O
⟹ nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư = 3a + 2b + (a + 1,2b) = 4a + 3,2b (mol)
Cách 2: Sử dụng bảo toàn e
- Khi X + HNO3:
Áp dụng bảo toàn e: 5nP + 6nS = nNO2 = 5a + 6b (mol)
Bảo toàn nguyên tố N: nHNO3 pư = nNO2 = 5a + 6b (mol)
⟹ nHNO3 dư = 20%.(5a + 6b) = a + 1,2b (mol)
- Khi trung hòa thì nOH- = nH+
⟹ nNaOH = 3nH3PO4 + 2nH2SO4 + nHNO3 dư = 3.a + 2.b + (a + 1,2b) = 4a + 3,2b (mol).
Câu 39:
Dung dịch X chứa a mol Ba(OH)2. Dung dịch Y chứa hỗn hợp gồm a mol NaOH và a mol Ba(OH)2. Sục khí CO2 đến dư vào dung dịch X cũng như dung dịch Y, sự phụ thuộc số mol kết tủa và số mol khí CO2 ở cả hai thí nghiệm theo hai đồ thị sau:
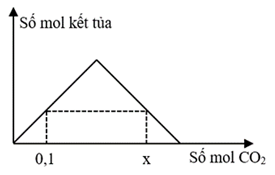
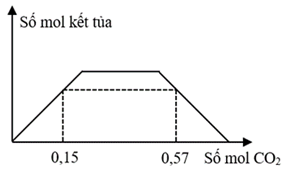
Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Khung đồ thị CO2 + Ca(OH)2/Ba(OH)2:
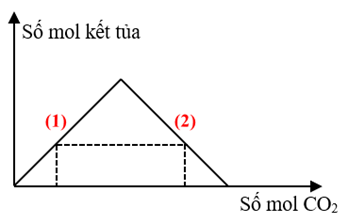
*Giai đoạn (1): CO2 + Ba(OH)2 → BaCO3 ↓ + H2O.
*Giai đoạn (2): CO2 + BaCO3 + H2O → Ba(HCO3)2.
Khung đồ thị CO2 + dd hỗn hợp NaOH + Ba(OH)2:
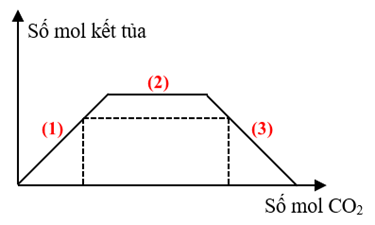
*Giai đoạn (1): CO2 + Ba(OH)2 → BaCO3 ↓ + H2O.
*Giai đoạn (2): CO2 + 2NaOH → Na2CO3 + H2O; CO2 + Na2CO3 + H2O → 2NaHCO3.
*Giai đoạn (3): CO2 + BaCO3 + H2O → Ba(HCO3)2.
Giải chi tiết:
Đồ thị có dạng hình tam giác thuộc về phản ứng của dung dịch X với CO2 (gọi là đồ thị 1), đồ thị hình thang cân thuộc về phản ứng của dung dịch Y với CO2 (gọi là đồ thị 2).
- Xét đồ thị 2, chia đồ thị 2 ra thành các giai đoạn như ở phần Phương pháp:
+ Khi nCO2 = 0,15 mol: nBaCO3 = nCO2 = 0,15 mol
+ Khi nCO2 = 0,57 mol:
Sản phẩm chứa:
BTNT C: nCO2 = nBaCO3 + nNaHCO3 + 2nBa(HCO3)2
⟹ a + 2(a - 0,15) + 0,15 = 0,57
⟹ 3a = 0,72
⟹ a = 0,24.
- Xét đồ thị 1:
Sản phẩm gồm:
BTNT C: nCO2 = nBaCO3 + 2nBa(HCO3)2 = 0,1 + 2.0,14 = 0,38 (mol).
Vậy x = 0,38.
Câu 40:
Đun nóng hỗn hợp etylen glicol và một axit cacboxylic mạch hở (X) có mặt H2SO4 đặc làm xúc tác, thu được các sản phẩm hữu cơ, trong đó có chất hữu cơ (Y) mạch hở. Đốt cháy hoàn toàn 24,0 gam Y cần dùng 0,825 mol O2, thu được CO2 và H2O có tỉ lệ mol tương ứng 3 : 2. Biết (Y) có công thức phân tử trùng với công thức đơn giản nhất.
Cho các nhận định sau:
(1) (X) tác dụng với H2 (xúc tác Ni, t0) theo tỉ lệ mol 1 : 2.
(2) Trong (Y) có một nhóm -CH3.
(3) Chất (Y) có công thức phân tử là C6H8O4.
(4) Chất (Y) có hai đồng phân thỏa mãn.
(5) Cho a mol (Y) tác dụng với Na dư thu được a mol H2.
Số nhận định không đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
- Tính số mol CO2, H2O dựa vào tỉ lệ mol và BTKL.
- Bảo toàn nguyên tố tính số mol của C, H, O trong Y.
⟹ Tỉ lệ số nguyên tử C : H : O = nC : nH : nO
⟹ CTĐGN ⟹ CTPT.
⟹ CTCT của Y thỏa mãn đề bài (lưu ý hợp chất tạp chức).
- Xét các nhận định để xác định các nhận định đúng/sai.
Giải chi tiết:
*Đặt nCO2 = 3x (mol); nH2O = 2x (mol)
BTKL: mY + mO2 = mCO2 + mH2O ⟹ 44.3x + 18.2x = 24 + 32.0,825 ⟹ x = 0,3 mol
⟹ nCO2 = 0,9 mol ⟹ nC = 0,9 mol
nH2O = 0,6 mol ⟹ nH = 1,2 mol
BTNT O: nO(Y) = 0,9.2 + 0,6 - 0,825.2 = 0,75 (mol)
⟹ C : H : O = 0,9 : 1,2 : 0,75 = 6 : 8 : 5
Do Y có CTPT trùng với CTĐGN ⟹ CTPT của Y là C6H8O5 (k = 3).
⟹ CTCT của Y thỏa mãn là:
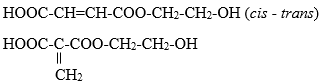
⟹ X là HOOC-CH=CH-COOH hoặc HOOC-C(=CH2)-COOH
*Xét các nhận định:
- (1) sai, X tác dụng với H2 (xúc tác Ni, t0) theo tỉ lệ mol 1 : 1.
- (2) sai, trong Y không có nhóm -CH3.
- (3) sai, CTPT của Y là C6H8O5.
- (4) sai, Y có 3 đồng phân thỏa mãn (lưu ý tính cả đồng phân hình học).
- (5) đúng, do Y có chứa 1 nhóm COOH và 1 nhóm OH.
Phản ứng tổng quát: HOOC-R-OH + 2Na → NaOOC-R-ONa + H2.
Vậy có 4 nhận định không đúng.
