[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề)
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (Đề 15)
-
12362 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Phản ứng hóa học nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học của các chất để xác định phản ứng hóa học viết sai.
Giải chi tiết:
D sai, sửa lại thành 2Fe + 3Cl2 2FeCl3.
Câu 2:
Chất dùng để tạo vị ngọt trong công nghiệp thực phẩm là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Giải chi tiết:
Chất dùng để tạo vị ngọt trong công nghiệp thực phẩm là saccarozơ.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Ta có: M → M2+ + 2e
Từ cấu hình electron của ion M2+ ⟹ Cấu hình electron của M (bằng cách thêm 2e) ⟹ ZM ⟹ Tên nguyên tố.
Giải chi tiết:
Ta có: M → M2+ + 2e
M2+: 1s22s22p6 ⟹ M: 1s22s22p63s2 ⟹ ZM = 12 ⟹ M là Mg.
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Viết công thức của glixerol.
Tính phần trăm khối lượng của O trong glixerol:
Giải chi tiết:
Glixerol có công thức C3H5(OH)3 ⟹ CTPT là C3H8O3.
⟹ %mO = = 52,17%.
Câu 5:
Kim loại cứng nhất là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào tính chất vật lí của kim loại.
Giải chi tiết:
Crom (Cr) là kim loại cứng nhất trong tất cả các kim loại.
Câu 6:
Thủy ngân dễ bay hơi và rất độc, nếu chẳng may nhiệt kế thủy ngân bị vỡ thì dùng chất nào trong các chất sau đây để khử độc thủy ngân?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Để khử độc thủy ngân ta cần chọn hóa chất phản ứng với Hg sinh ra chất có thể dễ dàng thu gom và xử lí.
Giải chi tiết:
Ta có thể khử độc thủy ngân bằng bột lưu huỳnh: S + Hg → HgS ↓. Sản phẩm HgS sinh ra dưới dạng chất rắn nên dễ dàng thu gom và xử lí.
Câu 7:
Muối nào có trữ lượng nhiều nhất trong nước biển?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Lý thuyết về hợp chất của clo.
Giải chi tiết:
Muối có trữ lượng nhiều nhất trong nước biển là natri clorua (NaCl).
Câu 8:
Khi đun nóng dung dịch canxi hiđrocacbonat thì có kết tủa xuất hiện. Tổng các hệ số tỉ lượng trong phương trình hóa học là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Viết PTHH xảy ra khi đun nóng dung dịch Ca(HCO3)2.
Tính tổng các hệ số tỉ lượng.
Giải chi tiết:
PTHH: Ca(HCO3)2 CaCO3 + CO2 + H2O
⟹ Tổng các hệ số tỉ lượng = 1 + 1 + 1 + 1 = 4.
Câu 9:
Hoà tan hoàn toàn hỗn hợp X gồm 0,1 mol CuO và 0,14 mol Al trong 500ml dung dịch HNO3 aM vừa đủ thu được dung dịch Y và 0,672 lít khí N2O duy nhất ở đktc. Tính khối lượng muối tạo thành trong dung dịch Y?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
So sánh thấy: ne do KL nhường (= 3nAl) > ne do khí nhận (= 8nN2O) ⟹ Sinh ra cả NH4+.
Quá trình trao đổi e:
Al0 → Al+3 + 3e 2N+5 + 8e → 2N+1 (N2O)
N+5 + 8e → N-3 (NH4NO3)
Áp dụng bảo toàn e tính được số mol NH4NO3.
Xác định thành phần của muối ⟹ khối lượng muối.
Giải chi tiết:
nN2O = 0,03 mol
Ta thấy: ne do KL nhường (= 3nAl) > ne do khí nhận (= 8nN2O) ⟹ Sinh ra cả NH4+.
Quá trình trao đổi e:
Al0 → Al+3 + 3e 2N+5 + 8e → 2N+1 (N2O)
0,14 → 0,42 (mol) 0,24 ← 0,03 (mol)
N+5 + 8e → N-3 (NH4NO3)
0,18 → 0,0225 (mol)
⟹ Muối chứa Cu(NO3)2 (0,1 mol); Al(NO3)3 (0,14 mol) và NH4NO3 (0,0225 mol)
⟹ mmuối = 0,1.188 + 0,14.213 + 0,0225.80 = 50,42 gam.
Câu 10:
Kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Phương pháp nhiệt luyện là dùng các chất khử như C, CO, H2, để khử các oxit của kim loại đứng sau Al trong dãy điện hóa tạo thành kim loại.
Giải chi tiết:
Phương pháp nhiệt luyện là dùng các chất khử như C, CO, H2, để khử các oxit của kim loại đứng sau Al trong dãy điện hóa tạo thành kim loại.
⟹ Kim loại Fe có thể điều chế bằng phương pháp nhiệt luyện.
Câu 11:
Thuốc thử dùng để nhận biết phenol là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết về phenol.
Giải chi tiết:
Dùng dung dịch Br2 để nhận biết phenol vì Br2 tạo kết tủa trắng được phenol.
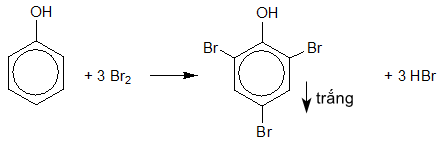
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết về amino axit.
Giải chi tiết:
Chất H2NCH2COOH có các tên gọi:
- Tên thường: Glyxin
- Tên bán hệ thống: Axit aminoaxetic
- Tên hệ thống: Axit 2-aminoetanoic
⟹ Tên gọi sai là: Axit α-amino propionic.
Câu 13:
Cho amin đơn chức X tác dụng với HNO3 loãng thu được muối amoni Y trong đó nitơ chiếm 22,95% về khối lượng. Vậy công thức phân tử của amin là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Coi amin là amin đơn chức bậc 1: RNH2 → RNH3NO3
Từ phần trăm khối lượng của N trong muối ⟹ giá trị R ⟹ gốc R ⟹ CTPT của amin.
⟹ CTPT là C3H9N.
Giải chi tiết:
Coi amin là amin đơn chức bậc 1: RNH2 → RNH3NO3
Ta có:
⟹ CTPT là C3H9N.
Câu 14:
C6H5NH2 là công thức hóa học của chất nào?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Giải chi tiết:
C6H5NH2 là công thức hóa học của anilin.
Câu 15:
Sắt tây là sắt được tráng
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết về hợp kim của sắt.
Giải chi tiết:
- Sắt tây là sắt được tráng một lớp mỏng kim loại thiếc (Sn) bảo vệ sắt không bị ăn mòn theo phương pháp bảo vệ bề mặt.
- Sắt tráng kẽm được gọi là tôn.
Câu 16:
Nhận định nào sau đây là không chính xác?
A. Dây điện bằng nhôm dần dần sẽ thay thế cho dây điện bằng đồng.
B. Sắt có thể được điều chế bằng phương pháp nhiệt luyện, phương pháp thủy luyện hoặc phương pháp điện phân dung dịch.
C. Người ta có thể mạ crom vào các đồ vật bằng kim loại để tạo độ sáng bóng thẩm mỹ cho đồ vật.
D. Tính oxi hóa tăng dần theo trật tự sau: Fe2+ < Cu2+ < H+ < Ag+.
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Lý thuyết chương đại cương về kim loại.
Giải chi tiết:
A đúng, dây điện bằng nhôm dần thay thế dây bằng đồng bởi tình trạng khan hiếm nguyên liệu, giá thành cao.
B đúng.
C đúng.
D sai, tính oxi hóa Fe2+ < H+ < Cu2+ < Ag+.
Câu 17:
Đốt cháy hoàn toàn a gam este X tạo bởi ancol no, đơn chức, mạch hở và axit không no (có một liên kết đôi), đơn chức, mạch hở thu được 8,96 lít CO2 (đktc) và 5,4 gam H2O. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Cách 1: Tính theo PTHH:
CnH2n-2O2 → nCO2 + (n-1)H2O
0,4/n ← 0,4 0,3 (mol)
⟹ 0,3n = 0,4.(n - 1) ⟹ giá trị của n ⟹ khối lượng este.
Cách 2: Dùng công thức tính nhanh
Chất hữu cơ (chứa C, H, O) có độ bất bão hòa k (là tổng π + vòng) khi đốt cháy có công thức tính nhanh:
Giải chi tiết:
Ta có nCO2 = 0,4 mol và nH2O = 0,3 mol.
Cách 1: Tính theo PTHH:
CnH2n-2O2 → nCO2 + (n-1)H2O
0,4/n ← 0,4 0,3 (mol)
⟹ 0,3n = 0,4.(n - 1) ⟹ n = 4 ⟹ CTPT: C4H6O2
⟹ neste = 0,4/n = 0,1 mol ⟹ meste = 0,1.86 = 8,6 gam.
Cách 2: Dùng công thức tính nhanh (ở phần phương pháp)
Độ bất bão hòa của X là k = 2.
⟹ neste = nCO2 - nH2O = 0,1 mol
⟹ ⟹ CTPT: C4H6O2
⟹ meste = 0,1.86 = 8,6 gam.
Câu 18:
Cho m gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi kết thúc các phản ứng lọc bỏ phần dung dịch thu được m gam bột rắn. Thành phần % theo khối lượng của Zn trong hỗn hợp bột ban đầu là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
- Giả sử nZn = 1 mol và nFe = x mol.
Zn + Cu2+ → Zn2+ + Cu
Fe + Cu2+ → Fe2+ + Cu
Theo đề bài khối lượng chất rắn ban đầu và khối lượng chất rắn sau phản ứng đều bằng m gam
⟹ khối lượng kim loại tan ra bằng khối lượng kim loại tạo thành.
⟹ nZn pư + nFe pư = mCu tạo thành ⟹ giá trị của x.
- Tính phần trăm khối lượng kim loại Zn theo công thức:
Giải chi tiết:
Giả sử nZn = 1 mol và nFe = x mol.
Zn + Cu2+ → Zn2+ + Cu
1 → 1 (mol)
Fe + Cu2+ → Fe2+ + Cu
x → x (mol)
Theo đề bài khối lượng chất rắn ban đầu và khối lượng chất rắn sau phản ứng đều bằng m gam
⟹ Khối lượng kim loại tan ra bằng khối lượng kim loại tạo thành.
⟹ nZn pư + nFe pư = mCu tạo thành
⟹ 65.1 + 56x = 64.(1 + x)
⟹ x = 0,125 mol
Câu 19:
Soda khan dùng trong công nghiệp thủy tinh, đồ gốm, bột giặt, … có công thức là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết về hợp chất của kim loại kiềm.
Giải chi tiết:
Soda khan là Na2CO3.
Câu 20:
Protein có trong lòng trắng trứng được gọi là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Lý thuyết về protein.
Giải chi tiết:
Protein có trong lòng trắng trứng được gọi là anbumin.
Câu 21:
Phương trình ion thu gọn Ca2+ + CO32- → CaCO3 là của phản ứng xảy ra giữa cặp chất nào sau đây?
1. CaCl2 + Na2CO3. 2. Ca(OH)2 + CO2.
3. Ca(HCO3)2 + NaOH. 4. Ca(NO3)2 + (NH4)2CO3.
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Cách chuyển đổi các phương trình phân tử sang phương trình ion thu gọn:
+ Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion, các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ.
+ Lược bỏ những ion không tham gia phản ứng ta được phương trình ion thu gọn.
Giải chi tiết:
1. CaCl2 + Na2CO3 → CaCO3 ↓ + 2NaCl
→ PT ion thu gọn: Ca2+ + CO32- → CaCO3
2. Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
→ PT ion thu gọn: Ca2+ + 2OH- + CO2 → CaCO3 + H2O
3. Ca(HCO3)2 + 2NaOH → CaCO3 ↓ + Na2CO3 + 2H2O
→ PT ion thu gọn: Ca2+ + 2HCO3- + 2OH- → CaCO3 + CO32- + 2H2O
4. Ca(NO3)2 + (NH4)2CO3 → CaCO3 ↓ + 2NH4NO3
→ PT ion thu gọn: Ca2+ + CO32- → CaCO3
Câu 22:
Polime nào sau đây được điều chế bằng phản ứng trùng hợp?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết về polime.
Giải chi tiết:
Tơ nitron được điều chế bằng phương pháp trùng hợp:
nCH2=CH-CN [-CH2-CH(CN)-]n
Câu 23:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Kim loại tan được trong nước ở điều kiện thường:
+ Tất cả các kim loại kiềm (nhóm IA).
+ Một số kim loại kiềm thổ (nhóm IIA) trừ Be, Mg.
Giải chi tiết:
Al không tan trong nước ở nhiệt độ thường.
Câu 24:
Phân lân supephotphat kép sản xuất trong thực tế thường chỉ chứa 40% P2O5 về khối lượng. Tính phần trăm về khối lượng của Ca(H2PO4)2 trong loại phân này?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Giả sử nP2O5 = 1 mol ⟹ mP2O5 ⟹ mphân bón = mP2O5.(100%:%P2O5).
BTNT "P" ⟹ nCa(H2PO4)2 = nP2O5 ⟹ mCa(H2PO4)2.
Tính %mCa(H2PO4)2 = (mCa(H2PO4)2/mphân bón).100%.
Giải chi tiết:
Giả sử nP2O5 = 1 mol; mP2O5 = 142 gam ⟹ mphân bón = 142.(100/40) = 355 gam.
BTNT "P" ⟹ nCa(H2PO4)2 = nP2O5 = 1 mol ⟹ mCa(H2PO4)2 = 234 gam.
⟹ %mCa(H2PO4)2 = (234/355).100% = 65,9%.
Câu 25:
Đốt cháy hoàn toàn x gam chất hữu cơ Z (chứa C, H, O) thu được a gam CO2 và b gam nước. Biết rằng 3a = 11b và 11x = 3a + 11b và tỉ khối của Z so với không khí nhỏ hơn 3. Vậy công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
- Từ 3a = 11b và 11x = 3a + 11b ta tự chọn giá trị a; b ⟹ giá trị x.
- Khi đó tính được số mol CO2, H2O.
+ BTNT "C" → nC = nCO2.
+ BTNT "H" → nH = 2nH2O.
+ BTKL → mO = mhchc Z - mC - mH → nO.
Suy ra tỉ lệ nguyên tử của các nguyên tố C : H : O ⟹ CTĐGN.
- Từ giả thiết MZ < 3.Mkk ⟹ CTPT của Z.
Giải chi tiết:
Chọn a = 11; b = 3 ⟹ x = 6.
Khi đó nCO2 = 0,25 mol; nH2O = 1/6 mol.
+ BTNT "C" → nC = nCO2 = 0,25 mol.
+ BTNT "H" → nH = 2nH2O = 1/3 mol.
+ BTKL → mO = mhchc Z - mC - mH = 6 - 12.0,25 - 1/3 = 8/3 gam → nO = 1/6.
Ta có C : H : O = 0,25 : 1/3 : 1/6 = 3 : 4 : 2 ⟹ CTPT Z có dạng (C3H4O2)n.
Mà theo đề MZ < 3.Mkk = 3.29 = 87 ⟹ 72n < 87 ⟹ n < 1,21 ⟹ n = 1 thỏa mãn.
Vậy CTPT của Z là C3H4O2.
Câu 26:
Hợp chất X đơn chức có công thức phân tử là C8H8O2 và chứa vòng benzen. Chất X tác dụng với NaOH chỉ theo tỉ lệ mol 1:1. Số đồng phân cấu tạo của X thỏa mãn điều kiện trên là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Độ bất bão hòa (tổng π + vòng):
Mà vòng bezen có độ bất bão hòa là 4 (3 π + 1 vòng) ⟹ phía ngoài vòng có 1 π.
X đơn chức và tác dụng NaOH theo tỉ lệ 1:1 ⟹ X là axit đơn chức hoặc este đơn chức (không phải este của phenol).
Viết các CTCT thỏa mãn tính chất của X.
Giải chi tiết:
Độ bất bão hòa (tổng π + vòng):
Mà vòng bezen có độ bất bão hòa là 4 (3 π + 1 vòng) ⟹ phía ngoài vòng có 1 π.
X đơn chức và tác dụng NaOH theo tỉ lệ 1:1 ⟹ X là axit đơn chức hoặc este đơn chức (không phải este của phenol).
Vậy có 6 CTCT thỏa mãn tính chất của X là:
(1): HCOOCH2C6H5;
(2): C6H5COOCH3;
(3) (4) (5): o, m, p - CH3C6H4COOH;
(6): C6H4CH2COOH.
Câu 27:
Kết luận nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết tổng hợp về hiđrocacbon, axit cacboxylic, este, cacbohiđrat.
Giải chi tiết:
A đúng.
B đúng, do CTTQ của hiđrocacbon là CnH2n+2-2k (k là độ bất bão hòa) thì (2n+2-2k) luôn là số chẵn.
C sai, trong máu người nồng độ giữ ổn định khoảng 0,1%.
D đúng, do este không tạo được liên kết H với nước như axit.
Câu 28:
Cho các chất: ancol etylic, etylen glicol, glucozơ, đimetyl ete và axit fomic. Số chất tác dụng được với Cu(OH)2 ở nhiệt độ thường là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Một số loại chất hữu cơ phản ứng với Cu(OH)2 ở nhiệt độ thường đã học:
- Chất có chứa nhiều nhóm OH liền kề.
- Axit cacboxylic.
Giải chi tiết:
Các chất tác dụng với Cu(OH)2 ở nhiệt độ thường gồm: etylen glicol, glucozơ, axit fomic (3 chất).
Câu 29:
Hòa tan 50 gam tinh thể CuSO4.5H2O vào 200 ml dung dịch HCl 0,6 M thu được dung dịch X. Đem điện phân dung dịch X (các điện cực trơ) với cường độ dòng điện 1,34A trong 4 giờ (biết hiệu suất điện phân là 100%). Khối lượng kim loại thoát ra ở catot và thể tích khí thoát ra ở anot (ở đktc) lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Tính số mol:
nCu2+ = nCuSO4.5H2O
nCl- = nHCl
ne = It/F (lưu ý: t tính bằng đơn vị giây)
- Tính toán theo các bán phản ứng điện phân ở các điện cực:
Catot (-): Cu2+ + 2e → Cu
Anot (+): Cl- → ½ Cl2 + 1e
H2O → 2H+ + ½ O2 + 2e
Giải chi tiết:
nCu2+ = nCuSO4.5H2O = 50/250 = 0,2 mol.
nCl- = nHCl = 0,2.0,6 = 0,12 mol.
ne = It/F = 1,34.4.3600/96500 = 0,2 mol
Catot (-): Cu2+ + 2e → Cu
0,2 → 0,1 (mol) ⟹ mKL ở catot = 0,1.64 = 6,4 gam.
Anot (+): Cl- → ½ Cl2 + 1e
0,12 → 0,06 → 0,12 (mol)
H2O → 2H+ + ½ O2 + 2e
0,02 ← 0,08 (mol)
⟹ ∑nkhí ở anot = nCl2 + nO2 = 0,06 + 0,02 = 0,08 mol ⟹ Vkhí ở anot = 0,08.22,4 = 1,792 lít.
Câu 30:
Cho sơ đồ phản ứng sau:
(a) Este X (C6H10O4) + 2NaOH X1 + X2 + X3
(b) X2 + X3 C3H8O + H2O
Cho các phát biểu sau:
(1) X có hai đồng phân cấu tạo.
(2) Từ X1 có thể điều chế CH4 bằng 1 phản ứng.
(3) X không phản ứng với H2 và không có phản ứng tráng bạc.
(4) Trong X chứa số nhóm -CH2- bằng số nhóm -CH3.
Số phát biểu sai là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
- Tính độ bất bão hòa của X: k = (2C + 2 - H)/2 = 2 ⟹ X chứa 2 π.
- Từ PTHH (b) ⟹ C3H8O là ete ⟹ CTCT là CH3-O-C2H5 ⟹ X2: CH3OH; X3: C2H5OH (hoặc ngược lại).
- Từ (a) và CTCT của X2, X3 ⟹ CTCT của X chỉ có thể là CH3OOC-CH2-COOCH2CH3.
⟹ X1: NaOOC-CH2-COONa.
- Từ đó xác định tính đúng/sai của các nhận định.
Giải chi tiết:
- X có độ bất bão hòa: k = (2C + 2 - H)/2 = 2 ⟹ X chứa 2 π.
- Từ PTHH (b) ⟹ C3H8O là ete ⟹ CTCT là CH3-O-C2H5 ⟹ X2: CH3OH; X3: C2H5OH (hoặc ngược lại).
- Từ (a) và CTCT của X2, X3 ⟹ CTCT của X chỉ có thể là CH3OOC-CH2-COOCH2CH3.
⟹ X1: NaOOC-CH2-COONa.
- Xét các phát biểu:
(1) sai, X chỉ có duy nhất 1 CTCT.
(2) đúng, PTHH: NaOOC-CH2-COONa + 2NaOH 2Na2CO3 + CH4.
(3) đúng.
(4) đúng, X là CH3OOC-CH2-COOCH2CH3 có 2 nhóm -CH3 và 2 nhóm -CH2-.
Vậy có 1 phát biểu sai.
Câu 31:
Dẫn lượng dư hỗn hợp X gồm hơi nước và khí cacbon monooxit qua m gam cacbon nung đỏ thu được hỗn hợp Y gồm CO, H2, CO2 và hơi nước. Cho hỗn hợp Y đi qua bình đựng CuO, Fe2O3 dư nung nóng thu được hỗn hợp chất rắn Z và hỗn hợp khí và hơi T. Cho hỗn hợp Z tác dụng với dung dịch HNO3 loãng dư thu được 8,064 lít khí NO (đktc) là sản phẩm khử duy nhất. Hấp thụ hoàn toàn T vào dung dịch Ba(OH)2 dư thấy xuất hiện 59,1 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tính giá trị của m?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Gọi số mol CO và C ban đầu lần lượt là x và y (mol).
Xét cả quá trình nhận thấy C và CO ban đầu chuyển hóa hết thành CO2 (trong hỗn hợp T).
Nhận thấy cả quá trình chỉ có quá trình cho, nhận electron của C, C+2 (CO) và N+5 (HNO3 tạo NO).
Áp dụng bảo toàn electron và bảo toàn nguyên tố (bảo toàn nguyên tố C) ⟹ x và y ⟹ m.
Giải chi tiết:
Gọi số mol CO và C ban đầu lần lượt là x và y (mol).
* Xét cả quá trình nhận thấy C và CO ban đầu chuyển hóa hết thành CO2 (trong hỗn hợp T).
Bảo toàn nguyên tố C ⟹ nCO + nC = nCO2 (T) = nBaCO3
⟹ x + y = 0,3 (1).
* Nhận thấy cả quá trình chỉ có sự cho, nhận electron của C0 (C tạo CO2), C+2 (CO tạo CO2) và N+5 (HNO3 tạo NO).
Quá trình trao đổi e:
C+2 → C+4 + 2e ; N+5 + 3e → N+2
x → 2x (mol) 1,08 → 0,36 (mol)
C0 → C+4 + 4e
y → 4y (mol)
Áp dụng định luật bảo toàn e ⟹ ne(cho) = ne(nhận)
⟹ 2x + 4y = 1,08 (2).
* Từ (1) và (2) ⟹ x = 0,06 và y = 0,24.
Vậy m = mC = 12y = 2,88 gam.
Câu 32:
Cho 12,4 gam hỗn hợp X gồm 2 ancol (rượu) đơn chức, bậc 1 là đồng đẳng kế tiếp qua H2SO4 đặc ở 140oC, thu được 9,7 gam hỗn hợp 3 ete. Nếu oxi hoá X thành anđehit rồi cho hỗn hợp anđehit thu được tác dụng hết với lượng dư AgNO3 trong dung dịch NH3 thì thu được m gam Ag. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Gọi công thức trung bình của 2 ancol đơn chức, bậc I trong X là
* Xét phản ứng ete hóa:
Sử dụng bảo toàn khối lượng ⟹ mH2O ⟹ nH2O.
Dựa vào PTHH ⟹ nX ⟹ MX ⟹ Hai ancol đồng đẳng kế tiếp trong X.
Gọi số mol hai ancol lần lần là x và y (mol)
Dựa vào khối lượng X và số mol X ⟹ x và y.
* Xét phản ứng oxi hóa X tạo anđehit → Ag.
Dựa vào số mol hai ancol ⟹ số mol 2 anđehit ⟹ số mol Ag ⟹ m.
Giải chi tiết:
Gọi công thức trung bình của 2 ancol đơn chức, bậc I trong X là
* Xét phản ứng ete hóa:
Bảo toàn khối lượng ⟹ mH2O = mX – mete = 2,7 g ⟹ nH2O =2,7/18 = 0,15 mol.
Theo PTHH ⟹ nX = 2nH2O = 0,3 mol.
Ta có:
⟹ Ancol nhỏ hơn chắc chắn phải là CH3OH.
Vì hai ancol đồng đẳng kế tiếp ⟹ ancol còn lại là CH3CH2OH.
* Gọi số mol CH3OH và C2H5OH trong X lần lượt là x và y (mol).
Ta có hệ phương trình:
* Xét phản ứng oxi hóa X tạo anđehit → Ag.
HCH2OH HCHO 4Ag
CH3CH2OH CH3CHO 2Ag
Dựa vào dãy chuyển hóa ⟹ nAg = 4nHCHO + 2nCH3CHO = 4nCH3OH + 2nC2H5OH = 0,8 mol.
Vậy khối lượng bạc thu được là m = mAg = 0,8.108 = 86,4 gam.
Câu 33:
Hỗn hợp X gồm 2 chất có công thức phân tử là C3H12N2O3 và C2H8N2O3. Cho 3,40 gam X phản ứng vừa đủ với dung dịch NaOH (đun nóng), thu được dung dịch Y chỉ gồm các chất vô cơ và 0,04 mol hỗn hợp 2 chất hữu cơ đơn chức (đều làm xanh giấy quỳ tím ẩm). Cô cạn Y, thu được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
X + NaOH → dung dịch Y chỉ gồm các chất vô cơ và hỗn hợp 2 chất hữu cơ (amin làm quỳ tím hóa xanh)
⟹ X gồm 2 muối của axit vô cơ.
⟹ X gồm hai hợp chất là (CH3NH2)2CO3 (C3H12N2O3) và C2H5NH3NO3 (C2H8N2O3).
Gọi số mol C3H12N2O3 và C2H8N2O3 lần lượt là x và y (mol).
Dựa vào khối lượng X và số mol hỗn hợp 2 amin ⟹ x và y ⟹ m.
Giải chi tiết:
X + NaOH → dung dịch Y chỉ gồm các chất vô cơ và hỗn hợp 2 chất hữu cơ (amin làm quỳ tím hóa xanh)
⟹ X gồm 2 muối của axit vô cơ.
⟹ X gồm hai hợp chất là (CH3NH2)2CO3 (C3H12N2O3) và C2H5NH3NO3 (C2H8N2O3).
* Gọi số mol C3H12N2O3 và C2H8N2O3 lần lượt là x và y (mol).
Ta có mX = 124x + 108y = 3,4 (1)
* Xét X + NaOH
(CH3NH2)2CO3 + 2NaOH → 2CH3NH2 ↑ + Na2CO3 + 2H2O
x → 2x x (mol)
C2H5NH3NO3 + NaOH → C2H5NH2 ↑ + NaNO3 + H2O
y → y y (mol)
Hỗn hợp 2 chất hữu cơ thu được là CH3NH2 và C2H5NH2 (amin làm xanh quỳ tím ẩm)
⟹ nhh = 2x + y = 0,04 (2)
Từ (1) và (2) ⟹ x = 0,01 và y = 0,02.
Cô cạn dung dịch Y thu được hỗn hợp muối khan là Na2CO3 0,01 mol và NaNO3 0,02 mol.
Vậy m = mNa2CO3 + mNaNO3 = 0,01.106 + 0,02.85 = 2,76 gam.
Câu 34:
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearat và natri oleat. Đốt cháy hoàn toàn m gam X cần vừa đủ 6,44 mol O2, thu được H2O và 4,56 mol CO2. Mặt khác, m gam X tác dụng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
X là triglixerit được tạo bởi C3H5(OH)3 và 2 axit là axit stearic (C17H35COOH) và axit oleic (C17H33COOH).
Vì hai axit tạo nên X đều là C17 ⟹ Số C của X là (17 + 1).3 + 3 = 57.
Giả sử X có k liên π (C=C) ⟹ X có tất cả số liên kết π là k + 3 (3 liên kết ở -COO-).
⟹ X có công thức phân tử là C57H57.2+2-2.(k+3)O6 hay C57H110-2kO6
* X + O2 → CO2 + H2O
Sử dụng bảo toàn nguyên tố C, H, O ⟹ số H(X) ⟹ k ⟹ nBr2 = k.nX (mol).
Giải chi tiết:
X là triglixerit được tạo bởi C3H5(OH)3 và 2 axit là axit stearic (C17H35COOH) và axit oleic (C17H33COOH).
Vì hai axit tạo nên X đều là C17 ⟹ Số C của X là (17 + 1).3 + 3 = 57.
Giả sử X có k liên π (C=C) ⟹ X có tất cả số liên kết π là k + 3 (3 liên kết ở -COO-).
⟹ X có công thức phân tử là C57H57.2+2-2.(k+3)O6 hay C57H110-2kO6
* X (C57H110-2kO6) + O2 → CO2 + H2O
Bảo toàn nguyên tố C ⟹ 57.nX = nCO2 ⟹ nX = nCO2/57 = 4,56/57 = 0,08 mol.
Bảo toàn nguyên tố O ⟹ nH2O = 6nX + 2nO2 – 2nCO2 = 4,24 mol.
Bảo toàn nguyên tố H ⟹ số H(X) = 110 – 2k = 2nH2O/nX = 106 ⟹ k = 2.
* Xét X + Br2
X có 2 liên kết π trong C=C ⟹ a = nBr2 = 2nX = 0,16 mol.
Câu 35:
Nén 10 ml một hiđrocacbon A và 55 ml O2 trong một bình kín. Bật tia lửa điện để đốt cháy hoàn toàn thu được (V + 30) ml hỗn hợp X rồi sau đó làm lạnh hỗn hợp X thu được V ml hỗn hợp khí Y. Biết tỉ lệ thể tích cũng là tỉ lệ số mol. Vậy công thức phân tử của A và giá trị của V có thể là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
* TH1: Y gồm CO2 và A dư.
* TH2: Y gồm CO2 và O2 dư.
Sử dụng bảo toàn nguyên tố và dựa vào dữ kiện đáp án ⟹ CTPT của A và V.
Giải chi tiết:
X gồm khí và hơi có tổng thể tích là VX = V + 30 (ml). Sau khi làm lạnh nước bị ngưng tụ còn lại hỗn hợp khí Y có tổng thế tích là VY = V (ml).
⟹ VH2O = VX – VY = 30 ml.
* TH1: Y gồm CO2 và A dư
Bảo toàn nguyên tố O ⟹ VCO2 = (2VO2 – VH2O)/2 = 40 ml.
Gọi công thức đơn giản nhất của A là CxHy
⟹ x : y = VCO2 : 2VH2O = 40 : 60 = 2 : 3 ⟹ CTĐGN của A là C2H3
Nhận thấy VA (pứ) < 10 ⟹ Số H(A) = 2VH2O/VA < 2.30/10 = 6 ⟹ Loại vì không có CTPT thỏa mãn của A.
* TH2: Y gồm CO2 và O2 dư
Bảo toàn nguyên tố O ⟹ 2VO2 = 2VY + VH2O ⟹ V = VY = 40 ml.
Bảo toàn nguyên tố H ⟹ Số H(A) = 2VH2O/VA = 6.
Ta có VCO2 < VY < 40 ⟹ Số C(A) < VCO2/VA = 4.
⟹ A chỉ có thể là C2H6 hoặc C3H6.
Dựa vào đáp án ⟹ A là C3H6 và V = 40 ml.
Câu 36:
Tiến hành thí nghiệm sau đây:
Bước 1: Rót vào 2 ống nghiệm (đánh dấu ống 1, ống 2) mỗi ống khoảng 5 ml dung dịch H2SO4 loãng và cho mỗi ống một mấu kẽm.
Bước 2: Nhỏ thêm 2-3 giọt dung dịch CuSO4 vào ống 1, nhỏ thêm 2-3 giọt dung dịch MgSO4 vào ống 2.
Ta có các kết luận sau:
(1) Sau bước 1, có bọt khí thoát ra cả ở 2 ống nghiệm.
(2) Sau bước 1, kim loại kẽm trong 2 ống nghiệm đều bị ăn mòn hóa học.
(3) Có thể thay dung dịch H2SO4 loãng bằng dung dịch HCl loãng.
(4) Sau bước 2, kim loại kẽm trong 2 ống nghiệm đều bị ăn mòn điện hóa.
(5) Sau bước 2, lượng khí thoát ra ở ống nghiệm 1 tăng mạnh.
Số kết luận đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức tổng hợp về đại cương kim loại.
Giải chi tiết:
(1) đúng, vì sau bước 1, trong cả hai ống nghiệm xảy ra phản ứng giữa Zn và dung dịch axit H2SO4.
PTHH: Zn + H2SO4 → ZnSO4 + H2 ↑
(2) đúng, vì Zn tác dụng trực tiếp với axit H2SO4 (bị ăn mòn) → ăn mòn hóa học.
(3) đúng, vì axit HCl loãng và H2SO4 loãng có tính chất hóa học tương tự nhau (bản chất là H+ + Zn).
(4) sai,
- Ở ống nghiệm 1, Zn phản ứng với dung dịch CuSO4 tạo ra Cu bám mẩu kẽm (Zn – Cu) cùng nhúng trong dung dịch chất điện li trong ống nghiệm ⟹ ăn mòn điện hóa.
- Ở ống nghiệm 2, Zn không phản ứng với dung dịch MgSO4 ⟹ không xảy ra ăn mòn điện hóa.
(5) đúng, vì sau khi nhỏ CuSO4 vào ống nghiệm 1 sẽ làm cho lượng khí thoát ra nhiều và nhanh hơn.
Câu 37:
Hỗn hợp X chứa ba este đều mạch hở gồm hai este đơn chức và một este đa chức, không no chứa một liên kết đôi C=C; trong mỗi phân tử este chỉ chứa một loại nhóm chức. Đốt cháy hoàn toàn m gam X cần vừa đủ 0,775 mol O2 thu được CO2 và 0,63 mol H2O. Nếu thủy phân m gam X trên trong dung dịch NaOH (dư), thu được hỗn hợp Y chứa 2 ancol no có cùng số nguyên tử cacbon và hỗn hợp Z chứa 0,22 mol hai muối. Mặt khác, đốt cháy hoàn toàn Y thu được 0,4 mol CO2 và 0,6 mol H2O. Tính phần trăm khối lượng của este có phân tử khối lớn nhất trong X?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
* Xét X + NaOH
X (-COO-) + NaOH → 0,22 mol 2 muối + 2 ancol no, cùng số C (Y)
⟹ X gồm các este được tạo bởi 2 axit và 2 ancol.
Y + O2 → CO2 + H2O
Vì ancol trong Y no ⟹ nY = nCO2 – nH2O
Bảo toàn nguyên tố C ⟹ Hai ancol trong Y.
⟹ Dạng các este trong X, gọi số mol các este.
Dựa vào bảo toàn nguyên tố, và công thức nCO2 – nH2O = k.nhchc (với k là số liên kết π trong hợp chất hữu cơ)
⟹ Số mol lần lượt các este ⟹ %meste.
Giải chi tiết:
* Xét X + NaOH
X (-COO-) + NaOH → 0,22 mol 2 muối (-COONa) + 2 ancol no, cùng số C (Y)
⟹ X gồm các este được tạo bởi 2 axit và 2 ancol.
⟹ n-COO- (X) = n-COONa (muối) = 0,22 mol.
* Xét Y + O2 → CO2 + H2O
Vì ancol trong Y no ⟹ nY = nCO2 – nH2O = 0,2 mol.
Bảo toàn nguyên tố C ⟹ Số C(Y) = nCO2/nY = 0,4/0,2 = 2.
Vì 2 ancol no, cùng số C ⟹ Hai ancol lần lượt là C2H6O và C2H6O2.
* X gồm 3 este đều mạch hở gồm hai este đơn chức và một este đa chức, không no chứa một liên kết đôi C=C; trong mỗi phân tử este chỉ chứa một loại nhóm chức.
⟹ 2 este đơn chức được tạo bởi ancol C2H5OH và axit đơn chức; este còn lại là este hai chức được tạo bởi C2H4(OH)2 và axit đơn chức.
Ta có nX = nancol = 0,2 mol.
* Xét X + O2
X (-COO-) + O2 → CO2 + H2O
Bảo toàn nguyên tố O ⟹ 2n-COO- (X) + 2nO2 = 2nCO2 + nH2O ⟹ nCO2 = 0,68 mol.
Bảo toàn nguyên tố C ⟹ Ctb (X) = nCO2/nX = 0,68/0,2 = 3,4
⟹ Trong X chắc chắn chứa 1 este là HCOOC2H5 (C = 3)
⟹
(với x, y và z lần lượt là số mol của este trong X)
Ta có
Giả sử axit RCOOH có số C trong R là n.
Bảo toàn nguyên tố C ⟹ 3.0,17 + (n + 3).0,01 + (n + 4).0,02 = 0,68 ⟹ n = 2.
Mà axit RCOOH không no, chứa 1 liên kết C=C ⟹ Axit là CH2=CHCOOH.
⟹ X gồm HCOOC2H5 0,17 mol ; C2H3COOC2H5 0,01 mol và C2H3COOC2H4OOCH 0,02 mol.
Ta có mX = 16,46 g và este có khối lượng phân tử lớn nhất là C2H3COOC2H4OOCH có m = 2,88 gam.
Vậy %meste = 2,88.100%/16,46 = 17,5%.
Câu 38:
Cho các phản ứng sau:
1. Fe3O4 + H2SO4 đặc nóng →
2. Toluen + dung dịch KMnO4 (to) →
3. Fomandehit + H2 (xúc tác Ni, to) →
4. Etilen + dung dịch brom →
5. FeS + H2SO4 đặc nóng →
6. Cu + dung dịch Fe2(SO4)3 →
7. Glucozơ + dung dịch AgNO3/NH3 (to) →
8. Glixerol + Cu(OH)2 →
Số các phản ứng thuộc loại phản ứng oxi hoá - khử là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Phản ứng oxi hóa – khử là phản ứng có sự tham gia của chất khử (chất nhường electron) và chất oxi hóa (chất nhận electron).
Dựa vào kiến thức tổng hợp về tính chất hóa học của các hợp chất.
Giải chi tiết:
Các phản ứng thuộc loại phản ứng oxi hóa – khử là 1, 2, 3, 4, 5, 6, 7.
1. 2Fe3O4 + 10H2SO4(đ) 3Fe2(SO4)3 + SO2 ↑ + 10H2O
2. C6H5CH3 + 2KMnO4 C6H5COOK + 2MnO2 + KOH + H2O
3. HCHO + H2 CH3OH
4. C2H4 + Br2 → C2H4Br2
5. 2FeS + 10H2SO4(đ) Fe2(SO4)3 + 9SO2 ↑ + 10H2O
6. Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
7. HOCH2[CHOH]4CHO + 2AgNO3 + 3NH3 + H2O HOCH2[CHOH]4COONH4 + 2Ag ↓ + 2NH4NO3
⟹ Có tất cả 7 phản ứng oxi hóa – khử.
Câu 39:
Dẫn từ từ 4,928 lít CO2 ở đktc vào bình đựng 500 ml dung dịch X gồm Ca(OH)2 xM và NaOH yM thu được 20 gam kết tủa. Mặt khác cũng dẫn 8,96 lít CO2 đktc vào 500 ml dung dịch X trên thì thu được 10 gam kết tủa. Giá trị của x, y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Nhận thấy cùng lượng dung dịch X, với lượng CO2 tăng lên ở (2) thì khối lượng kết tủa (2) giảm so với (1)
⟹ Ở thí nghiệm 2 có sự hòa tan kết tủa.
* Xét thí nghiệm 2:
Bảo toàn nguyên tố và bảo toàn điện tích ⟹ Phương trình liên hệ giữa x và y.
* Xét thí nghiệm 1:
- TH1: Kết tủa đã tan 1 phần.
- TH2: Kết tủa chưa tan
Bảo toàn nguyên tố và bảo toàn điện tích ⟹ Phương trình liên hệ giữa x và y ⟹ x và y.
Giải chi tiết:
Nhận thấy cùng lượng dung dịch X, với lượng CO2 tăng lên ở (2) thì khối lượng kết tủa (2) giảm so với (1)
⟹ Ở thí nghiệm 2 có sự hòa tan kết tủa.
* Xét thí nghiệm 2:
Bảo toàn nguyên tố C ⟹ nHCO3- = nCO2 – nCaCO3 = 0,3 mol.
Bảo toàn nguyên tố Ca ⟹ nCa2+ = nCa(OH)2 – nCaCO3 = 0,5x – 0,1 (mol).
Bảo toàn nguyên tố Na ⟹ nNa+ = nNaOH = 0,5y mol.
Bảo toàn điện tích ⟹ 2nCa2+ + nNa+ = nHCO3-
⟹ 2.(0,5x – 0,1) + 0,5y = 0,3
⟹ x + 0,5y = 0,5 (1).
* Xét thí nghiệm 1:
- TH1: Kết tủa đã tan 1 phần.
Bảo toàn điện tích ⟹ 2nCa2+ + nNa+ = nHCO3-
⟹ 2.(0,5x – 0,2) + 0,5y = 0,02
⟹ x + 0,5y = 0,42 ⟹ Vô lí (Do (1)) ⟹ Loại.
- TH2: Kết tủa chưa tan
PTHH: 2OH- + CO2 → CO32- + H2O
⟹ nOH-(pứ) = 2nCO2 = 0,44 mol.
⟹ nOH-(dư) = x + 0,5y – 0,44 mol.
Bảo toàn điện tích ⟹ nNa+ = 2nCO32- + nOH-
⟹ 0,5y = 2.0,02 + x + 0,5y – 0,44
⟹ x = 0,4 (2) ⟹ (1): y = 0,2.
Vậy giá trị x và y lần lượt là 0,4 và 0,2.
Câu 40:
Cho các phát biểu sau:
(1) Khi đun nóng triolein trong nồi kín rồi sục dòng khí hiđro có xúc tác Ni sau đó để nguội thu được khối chất rắn là panmitin.
(2) Chất béo trong cơ thể có tác dụng đảm bảo sự vận chuyển và hấp thụ các chất hòa tan được trong chất béo.
(3) Trong phân tử tinh bột gồm nhiều mắt xích β-glucozơ liên kết với nhau tạo thành hai dạng: amilozơ và amilopectin.
(4) Đimetylamin có tính bazơ lớn hơn etylamin.
(5) Benzen va toluen là nguyên liệu rất quan trọng cho công nghiệp hóa học, dùng để tổng hợp dược phẩm, phẩm nhuộm, thuốc nổ, polime, …
(6) HNO3 đặc nguội và H2SO4 đặc nguội làm thụ động hóa Al, Fe, Cu.
(7) Ống thép (dẫn dầu, dẫn nước, dẫn khí đốt) ở dưới đất cũng được bảo vệ bằng phương pháp điện hóa.
(8) Các axit cacboxylic tan nhiều trong nước là do các phân tử axit cacboxylic và các phân tử nước tạo được liên kết hiđro.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức tổng hợp về các hợp chất đã học.
Giải chi tiết:
(1) sai, vì khối chất rắn thu được là tristearin.
(2) đúng.
(3) sai, vì trong phân tử tinh bột gồm nhiều mắt xích α-glucozơ liên kết với nhau
(4) đúng, vì amin bậc 2 có tính bazơ mạnh hơn amin bậc 1 (cùng công thức phân tử).
(5) đúng.
(6) sai, vì HNO3 đặc nguội và H2SO4 đặc nguội làm thụ động hóa Al, Fe, Cr (không phải Cu).
(7) đúng.
(8) đúng.
