[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (30 đề)
[Năm 2022] Đề thi thử môn Hóa THPT Quốc gia có lời giải (Đề 16)
-
12938 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại và hợp chất của chúng.
Giải chi tiết:
PTHH sai: Cu + H2SO4 (dung dịch loãng) → CuSO4 + H2.
Vì Cu không phản ứng với axit H2SO4(loãng), chỉ phản ứng với axit H2SO4(đặc) tạo khí SO2.
Câu 2:
Polime nào dưới đây điều chế bằng phản ứng trùng hợp?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào kiến thức về vật liệu polime.
Giải chi tiết:
Polietilen (-CH2-CH2-)n được điều chế bằng phản ứng trùng hợp etilen (CH2=CH2).
Câu 3:
Số liên kết peptit trong phân tử Ala-Gly-Ala-Gly là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Số liên kết peptit = Số mắt xích – 1.
Giải chi tiết:
Phân tử Ala-Gly-Ala-Gly có 4 mắt xích.
Số liên kết peptit trong phân tử là 4 – 1 = 3 (liên kết peptit).
Câu 4:
Cho glixerol phản ứng với hỗn hợp axit béo gồm C17H35COOH và C15H31COOH trong điều kiện thích hợp. Số trieste được tạo ra tối đa thu được là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
* Cách 1: Dựa vào phản ứng este hóa để xác định sản phẩm trieste được tạo thành.
* Cách 2: Áp dụng công thức: Số loại trieste được tạo = với n : số axit béo.
Giải chi tiết:
* Cách 1: Coi C17H35COOH và C15H31COOH lần lượt là R1COOH và R2COOH.
Các trieste được tạo thành là
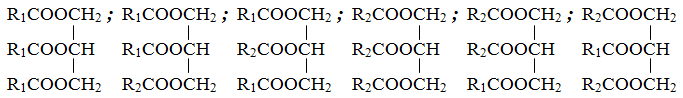
⟹ Số trieste được tạo ra tối đa thu được là 6.
* Cách 2: Số axit béo có thể tạo nên trieste là 2.
Số loại trieste được tạo =
⟹ Số trieste được tạo ra tối đa thu được là 6.
Câu 5:
Chất X (có M = 60 và chứa C, H, O). Chất X phản ứng được với dung dịch NaOH đun nóng. X không tác dụng Na, NaHCO3. Tên gọi của X là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Chất X phản ứng được với dung dịch NaOH đun nóng. X không tác dụng Na, NaHCO3 ⟹ X là este.
MX = 60 ⟹ X là este đơn chức ⟹ CTPT, CTCT và tên gọi của X.
Giải chi tiết:
Chất X phản ứng được với dung dịch NaOH đun nóng. X không tác dụng Na, NaHCO3 ⟹ X là este.
MX = 60 ⟹ X là este đơn chức.
Gọi công thức của X là RCOOR’
⟹ MR + MR’ = 60 – 12 – 16.2 = 16
⟹ MR = 1 (H) và MR’ = 15 (CH3) → thỏa mãn.
Vậy CTCT của X là HCOOCH3 (metyl fomat).
Câu 6:
Cho dãy các chất: C2H2, C2H4, C2H5OH, CH2=CH-COOH, C6H5NH2 (anilin), C6H5OH (phenol), C6H6 (benzen). Số chất trong dãy phản ứng được với nước brom là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào tính chất hóa học của các hợp chất hữu cơ đã học.
Giải chi tiết:
Các chất phản ứng được với nước brom là C2H2, C2H4, CH2=CH-COOH, C6H5NH2, C6H5OH (5 chất).
C2H2 + 2Br2 → C2H2Br4.
C2H4 + Br2 → C2H4Br2.
CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH.
C6H5NH2 + 3Br2 → C6H2(Br3)NH2 ↓ + 3HBr.
C6H5OH + 3Br2 → C6H2(Br3)OH ↓ + 3HBr.
Câu 7:
Công thức phân tử của của saccarozơ là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào kiến thức về các hợp chất cacbohiđrat.
Giải chi tiết:
Công thức phân tử của của saccarozơ là C12H22O11.
Câu 8:
Xà phòng hóa chất nào sau đây thu được glixerol?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Khi cho trieste (được tạo bởi glixerol) phản ứng với dung dịch NaOH (xà phòng hóa) thu được sản phẩm là glixerol.
Giải chi tiết:
Xà phòng hóa tristearin thu được glixerol.
PTHH: (C17H35COO)3C3H5 + 3NaOH 3C17H35COONa + C3H5(OH)3.
Câu 9:
Đốt cháy hoàn toàn este X bằng lượng oxi vừa đủ, dẫn toàn bộ sản phẩm cháy vào bình dung dịch Ca(OH)2 dư, thấy xuất hiện 20 gam kết tủa và khối lượng bình tăng 12,4 gam. Công thức chung của X là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
X + O2 → CO2 + H2O
Dẫn sản phẩm cháy vào bình dung dịch Ca(OH)2 dư
⟹ nCO2 = nCaCO3.
mbình tăng = mCO2 + mH2O ⟹ mH2O ⟹ nH2O.
So sánh số mol CO2 và H2O ⟹ Công thức chung của X.
Giải chi tiết:
X + O2 → CO2 + H2O
Dẫn sản phẩm cháy vào bình dung dịch Ca(OH)2 dư
⟹ nCO2 = nCaCO3 = 0,2 mol.
mbình tăng = mCO2 + mH2O = 12,4
⟹ mH2O = 12,4 – 0,2.44 = 3,6 g
⟹ nH2O = 3,6/18 = 0,2 mol.
Nhận thấy nCO2 = nH2O = 0,2 ⟹ Este X no, đơn chức, mạch hở.
Vậy công thức chung của X là CnH2nO2.
Câu 10:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Dựa vào kiến thức về tính chất vật lí và ứng dụng của este.
Giải chi tiết:
C sai, vì este rất ít tan trong nước.
Câu 11:
Kim loại dẫn điện tốt nhất là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào tính chất vật lí (độ dẫn điện) của kim loại.
Giải chi tiết:
Kim loại dẫn điện tốt nhất là Ag.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức tổng hợp về các hợp chất cacbohiđrat.
Giải chi tiết:
X là glucozơ (đường nho) và Y là sobitol.
PTHH: C6H12O6 + H2 C6H14O6.
Câu 13:
Chất nào sau đây là amin bậc 2?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Amin có dạng R-NH-R’ là amin bậc 2.
Giải chi tiết:
Đimetylamin (CH3-NH-CH3) là amin bậc 2.
Câu 14:
Đốt cháy hoàn toàn một lượng hỗn hợp gồm etyl axetat và etyl propionat thu được 15,68 lít khí CO2 (đktc). Khối lượng H2O thu được là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Nhận thấy hai este đều no, đơn chức, mạch hở (CH3COOC2H5 và C2H5COOC2H5)
⟹ Khi đốt cháy hai este thu được nH2O = nCO2 ⟹ mH2O.
Giải chi tiết:
Nhận thấy hai este đều no, đơn chức, mạch hở (CH3COOC2H5 và C2H5COOC2H5)
⟹ Khi đốt cháy hai este thu được nH2O = nCO2 = 15,68/22,4 = 0,7 mol.
Vậy khối lượng nước thu được là mH2O = 0,7.18 = 12,6 gam.
Câu 15:
Cho các chất: etyl fomat, glucozơ, saccarozơ, tinh bột, glyxin. Số chất bị thủy phân trong môi trường axit là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào tính chất hóa học của các hợp chất.
Giải chi tiết:
Các chất bị thủy phân trong môi trường axit là etyl fomat, saccarozơ, tinh bột (3 chất).
HCOOC2H5 + H2O HCOOH + C2H5OH.
C12H22O11 + H2O 2C6H12O6.
(-C6H10O5-)n + nH2O nC6H12O6.
Câu 16:
Tơ nào sau đây thuộc loại tơ thiên nhiên?
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức về vật liệu polime.
Giải chi tiết:
Tơ tằm thuộc loại tơ thiên nhiên.
Câu 17:
Este CH3COOCH3 có tên gọi là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào kiến thức danh pháp của este.
Giải chi tiết:
Este CH3COOCH3 có tên gọi là metyl axetat.
Câu 18:
Cho các chất: (1) metylamin; (2) amoniac; (3) etylamin; (4) anilin; (5) đimetylamin. Thứ tự tính bazơ tăng dần là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Sắp xếp tính bazơ tăng dần của các hợp chất amin:
Amin thơm < NH3 < amin no bậc 1 < amin no bậc 2 (amin no cùng công thức phân tử).
Giải chi tiết:
Thứ tự tính bazơ tăng dần là (4) anilin < (2) amoniac < (1) metylamin < (3) etylamin < (5) đimetylamin.
Câu 19:
Cho các chất sau: fructozơ, glucozơ, etyl axetat, Val-Gly-Ala. Số chất phản ứng với Cu(OH)2 trong môi trường kiềm, tạo dung dịch màu xanh lam là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào tính chất hóa học của các hợp chất.
Giải chi tiết:
Các chất phản ứng với Cu(OH)2 trong môi trường kiềm, tạo dung dịch màu xanh lam là fructozơ, glucozơ.
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào công thức của alanin ⟹ Số nguyên tử H.
Giải chi tiết:
Công thức của alanin là H2N-CH(CH3)-COOH (C3H7NO2).
Vậy số nguyên tử H của alanin là 7.
Câu 21:
Hợp kim nào sau đây Fe bị ăn mòn điện hoá học khi tiếp xúc với không khí ẩm?
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào kiến thức về ăn mòn điện hóa.
Hợp kim: kim loại nào có tính khử mạnh hơn thì bị ăn mòn khi tiếp xúc với không khí ẩm.
Giải chi tiết:
Hợp kim Fe-C: Fe có tính khử mạnh hơn C nên Fe bị ăn mòn điện hoá học khi tiếp xúc với không khí ẩm.
Câu 22:
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Dựa vào tính chất hóa học của kim loại và axit HNO3.
Giải chi tiết:
Fe, Al và Cr bị thụ động trong dung dịch HNO3 đặc, nguội (không phản ứng).
Kim loại Cu tan trong dung dịch HNO3 đặc, nguội.
PTHH: Cu + 4HNO3(đ) → Cu(NO3)2 + 2NO2 ↑ + 2H2O
Câu 23:
X là một este không no trong phân tử chứa 2 liên kết pi (π), mạch hở. Đốt cháy hoàn toàn 4,3 gam X cần vừa đủ 7,2 gam O2. Số công thức cấu tạo thỏa mãn điều kiện X là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Gọi công thức phân tử của X là CnH2n-2Ox (x = 2 hoặc 4).
Dựa vào phương trình đốt cháy X ⟹ Phương trình liên hệ giữa nX và nO2
⟹ Phương trình liên hệ giữa n và x ⟹ CTPT của X ⟹ CTCT của X.
Giải chi tiết:
Gọi công thức phân tử của X là CnH2n-2Ox (x = 2 hoặc 4).
PTHH:
Theo PTHH ⟹
+ Xét x = 2 ⟹ n = 4 ⟹ X là C4H6O2 → thỏa mãn.
+ Xét x = 4 ⟹ n = -71/11 ⟹ Loại.
Các đồng phân este C4H6O2 là
HCOOCH2-CH=CH2 ; HCOOCH=CH-CH3 ; HCOOC(CH3)=CH2
CH3COOCH=CH2 ; CH2=CHCOOCH3
⟹ Có tất cả 5 công thức cấu tạo thỏa mãn.
Câu 24:
Hỗn hợp X gồm phenyl axetat, metyl benzoat, benzyl fomat và etyl phenyl oxalat. Thủy phân hoàn toàn 73,8 gam X trong dung dịch NaOH (dư, đun nóng), có 0,8 mol NaOH phản ứng, thu được m gam hỗn hợp muối và 21,8 gam hỗn hợp Y gồm các ancol. Cho toàn bộ Y tác dụng với Na dư, thu được 4,48 lít khí H2 (đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
* Ta có:
Este của ancol: Este + NaOH → muối + ancol
⟹ nNaOH = nancol.
Este của phenol: Este + 2NaOH → muối + H2O
⟹ nNaOH = 2nH2O
* X gồm CH3COOC6H5 ; C6H5COOCH3 ; HCOOCH2C6H5 ; C2H5OOC-COOC6H5
X + NaOH → muối + ancol Y + H2O
⟹ nNaOH = nY + 2nH2O.
* Dựa vào phản ứng Y + Na ⟹ nY ⟹ nH2O.
Sử dụng bảo toàn khối lượng ⟹ m.
Giải chi tiết:
* X gồm CH3COOC6H5 ; C6H5COOCH3 ; HCOOCH2C6H5 ; C2H5OOC-COOC6H5
Ancol Y (ancol đơn chức) + Na → 0,5H2
⟹ nY = 2nH2 = 2.0,2 = 0,4 mol.
* X + NaOH → muối + ancol Y + H2O
⟹ nNaOH = nY + 2nH2O = 0,8 ⟹ nH2O = 0,2 mol.
BTKL ⟹ mX + mNaOH = m + mY + mH2O
⟹ m = 73,8 + 0,8.40 – 21,8 – 0,2.18 = 80,4 gam.
Câu 25:
Cho 54 gam glucozơ lên men rượu với hiệu suất 75% thu được m gam C2H5OH. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
PTHH: C6H12O6 2C2H5OH + 2CO2
Dựa vào PTHH ⟹ nC2H5OH (LT) ⟹ nC2H5OH (TT) (Do H = 75%) ⟹ m.
Giải chi tiết:
nC6H12O6 = 54/180 = 0,3 mol.
PTHH: C6H12O6 2C2H5OH + 2CO2
Theo PTHH ⟹ nC2H5OH (LT) = 2nC6H12O6 = 0,6 mol.
Do H = 75% ⟹ nC2H5OH (TT) = 0,6.75%/100% = 0,45 mol.
Vậy m = mC2H5OH = 0,45.46 = 20,7 gam.
Câu 26:
Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu bằng dung dịch H2SO4 loãng, dư thu được V lít H2 (đktc) và 6,4 gam chất rắn không tan. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Hỗn hợp chất rắn chỉ có Fe phản ứng với H2SO4 tạo khí H2; chất rắn không tan là Cu.
Dựa vào phản ứng của Fe với H2SO4 ⟹ nH2 ⟹ V.
Giải chi tiết:
Chất rắn không tan là Cu (m = 6,4 g)
⟹ mFe = 12 – 6,4 = 5,6 g ⟹ nFe = 5,6/56 = 0,1 mol.
PTHH: Fe + H2SO4 → FeSO4 + H2
Theo PTHH ⟹ nH2 = nFe = 0,1 mol.
Vậy V = 0,1.22,4 = 2,24 lít.
Câu 27:
Cho các chất sau: axit glutamic, amoni propionat, trimetylamin, metyl amoni axetat, nilon-6,6. Số chất vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH (trong điều kiện thích hợp) là
 Xem đáp án
Xem đáp án
Đáp án B
Phương pháp giải:
Hợp chất lưỡng tính vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH (trong điều kiện thích hợp).
Giải chi tiết:
Các hợp chất vừa phản ứng được với dung dịch HCl, vừa phản ứng được với dung dịch NaOH (trong điều kiện thích hợp) là axit glutamic, amoni propionat, metyl amoni axetat, nilon-6,6 (4 chất).
Axit glutamic: HOOC-CH(NH2)-CH2-CH2-COOH phản ứng với HCl vì có nhóm –NH2 và phản ứng với NaOH vì có nhóm –COOH.
Amoni propionat: C2H5COONH4 phản ứng với HCl (C2H5COO-) và phản ứng với NaOH (NH4+).
Metyl amoni axetat: CH3COOH3NCH3 phản ứng với HCl (CH3COO-) và phản ứng với NaOH (CH3NH3+).
Nilon-6,6: (-HN-[CH2]6-NH-CO-[CH2]4-CO-)n (thủy phân peptit trong môi trường axit hoặc bazơ).
Câu 28:
Đốt cháy hoàn toàn 2 amin no đơn chức đồng đẳng liên tiếp thu được CO2 và H2O theo tỉ lệ số mol nCO2 : nH2O = 1 : 2. Công thức phân tử của 2 amin là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Gọi công thức trung bình của 2 amin no, đơn chức là
Giả sử số mol của 2 amin là 1 mol.
Dựa vào phương trình đốt cháy ⟹ Tỉ lệ nCO2/nH2O ⟹ ⟹ CTPT của 2 amin.
Giải chi tiết:
Gọi công thức trung bình của 2 amin no, đơn chức là
Giả sử số mol của 2 amin là 1 mol.
PTHH:
Theo PTHH ⟹
Vì 2 amin đồng đẳng, liên tiếp nên hai amin là CH3NH2 và C2H5NH2.
Câu 29:
Thủy phân hoàn toàn a gam triglixerit X trong dung dịch NaOH, thu được glixerol và dung dịch chứa m gam hỗn hợp muối (gồm natri stearat; natri panmitat và C17HyCOONa). Đốt cháy hoàn toàn a gam X cần 1,55 mol O2, thu được H2O và 1,1 mol CO2. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
X là trieste được tạo bởi glixerol, axit stearic C17H35COOH, axit panmitic C15H31COOH và C17HyCOONa.
⟹ Số C(X) và số O(X).
* X + O2 → CO2 + H2O.
Bảo toàn nguyên tố C, O ⟹ nX và nH2O.
Bảo toàn khối lượng ⟹ a.
* X + 3NaOH → muối + C3H5(OH)3
Ta có nNaOH = 3nX và nglixerol = nX.
Bảo toàn khối lượng ⟹ m.
Giải chi tiết:
X là trieste được tạo bởi glixerol C3H5(OH)3, axit stearic C17H35COOH, axit panmitic C15H31COOH và C17HyCOONa.
⟹ Số C(X) = 3 + 18 + 16 + 18 = 55 và số O(X) = 6.
* X + O2 → CO2 + H2O.
BTNT C ⟹ 55.nX = nCO2 ⟹ nX = 1,1/55 = 0,02 mol.
BTNT O ⟹ 6nX + 2nO2 = 2nCO2 + nH2O ⟹ nH2O = 1,02 mol.
BTKL ⟹ a = mX = mCO2 + mH2O – mO2 = 17,16 gam.
* X + 3NaOH → muối + C3H5(OH)3
Ta có nNaOH = 3nX = 0,06 mol và nglixerol = nX = 0,02 mol.
BTKL ⟹ m = mmuối = mX + mNaOH – mglixerol = 17,72 gam.
Câu 30:
Dẫn 3,36 lít khí CO (đktc) qua m gam hỗn hợp gồm Fe2O3 và MgO (tỉ lệ mol 1 : 1) nung nóng thu được hỗn hợp khí có tỉ khối hơi so với He bằng 10,2. Các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Dựa vào bảo toàn nguyên tố và tỉ khối hơi của hỗn hợp khí so với He ⟹ a và b.
Dựa vào phản ứng CO + Fe2O3 ⟹ x ⟹ m. (Với x là số mol của Fe2O3 và MgO).
Giải chi tiết:
Gọi a và b lần lượt là số mol của CO và CO2 trong hỗn hợp khí.
Gọi x là số mol của Fe2O3 và MgO(hai chất có tỉ lệ số mol 1:1).
* Xét hỗn hợp khí:
BTNT C ⟹ nCO (dư) + nCO2 = nCO (bđ) = a + b = 0,15 (1).
Ta có dkhí/He = 10,2 ⟹ Mkhí = 10,2.4 = 40,8
⟹ mkhí = nCO (dư) + nCO2 = 28a + 44b = 40,8.0,15 = 6,12 (2).
Từ (1) và (2) ⟹ a = 0,03 và b = 0,12.
* Xét phản ứng:
Fe2O3 + 3CO 2Fe + 3CO2
Theo PTHH ⟹ nFe2O3 = x = nCO2/3 = 0,04 mol.
Vậy m = mFe2O3 + mMgO + 160.0,04 + 40.0,04 = 8 gam.
Câu 31:
Cho 0,1 mol hỗn hợp X gồm metyl axetat và etyl axetat tác dụng với 200 ml dung dịch NaOH 1M, đun nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn Y thu được m gam chất rắn khan. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
- Nhận thấy 2 este đều có chung dạng là CH3COOR'.
- PTHH: CH3COOR' + NaOH → CH3COONa + R'OH
- Tính theo PTHH ⟹ thành phần chất rắn ⟹ khối lượng chất rắn.
Giải chi tiết:
Metyl axetat: CH3COOCH3.
Etyl axetat: CH3COOC2H5.
⟹ 2 este đều có chung dạng là CH3COOR'.
CH3COOR' + NaOH → CH3COONa + R'OH
Pư: 0,1 → 0,1 → 0,1 (mol)
⟹ Chất rắn chứa CH3COONa (0,1 mol) và NaOH dư (0,2 - 0,1 = 0,1 mol).
⟹ mchất rắn = 0,1.82 + 0,1.40 = 12,2 gam.
Câu 32:
Cho các phát biểu sau:
(a) Thủy phân este trong môi trường kiềm gọi là phản ứng xà phòng hóa.
(b) Các este có nhiệt độ sôi thấp hơn axit và ancol có cùng số nguyên tử cacbon.
(c) Poliisopren là hiđrocacbon.
(d) Có thể dùng Cu(OH)2 để phân biệt Ala-Ala và Ala-Ala-Ala.
(e) Tơ nilon-6,6 được trùng hợp bởi hexametylenđiamin và axit ađipic.
(g) Chất béo lỏng dễ bị oxi hóa bởi oxi không khí hơn chất béo rắn.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Lý thuyết tổng hợp về este, peptit, polime.
Giải chi tiết:
(a) đúng.
(b) đúng, vì este không tạo được liên kết H giữa các phân tử như axit và ancol có cùng số nguyên tử C.
(c) đúng, vì poliisopren là chất hữu cơ có thành phần C, H.
(d) đúng, vì Ala-Ala không tạo hợp chất màu tím; Ala-Ala-Ala tạo được hợp chất màu tím.
(e) sai, tơ nilon-6,6 được trùng ngưng bởi hexametylenđiamin và axit ađipic.
(g) đúng, vì chất béo lỏng có các liên kết đôi C=C nên dễ bị oxi hóa bởi không khí hơn so với các chất béo rắn.
⟹ 5 phát biểu đúng.
Câu 33:
Cho các chất sau: C2H5OH, C6H5OH, C6H5NH2, C6H5ONa (dung dịch), NaOH (dung dịch), CH3COOH (dung dịch), HCl (dung dịch loãng). Cho từng cặp chất tác dụng với nhau ở điều kiện thích hợp, số cặp chất có phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Dựa vào tính chất đã được học của các chất để xác định các chất phản ứng với nhau.
Giải chi tiết:
(1) C2H5OH + CH3COOH ⇄ CH3COOC2H5 + H2O (H2SO4 đặc, to)
(2) C2H5OH + HCl → C2H5Cl + H2O (to)
(3) C6H5OH + NaOH → C6H5ONa + H2O
(4) C6H5NH2 + CH3COOH → CH3COONH3C6H5
(5) C6H5NH2 + HCl → C6H5NH3Cl
(6) C6H5ONa + CH3COOH → C6H5OH + CH3COONa
(7) C6H5ONa + HCl → C6H5OH + NaCl
(8) NaOH + CH3COOH → CH3COONa + H2O
(9) NaOH + HCl → NaCl + H2O
Câu 34:
Cho các phát biểu sau:
(a) Dung dịch lòng trắng trứng bị đông tụ khi đun nóng.
(b) Trong phân tử lysin có một nguyên tử nitơ.
(c) Dung dịch alanin làm đổi màu quỳ tím.
(d) Tristearin có phản ứng cộng H2 (xúc tác Ni, t°).
(e) Tinh bột là đồng phân của xenlulozơ.
(g) Anilin là chất lỏng, hầu như không tan trong nước.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Lý thuyết tổng hợp về este, cacbohiđrat, amin - amino axit - peptit.
Giải chi tiết:
(a) đúng, do hiện tượng đông tụ protein khi đun nóng.
(b) sai, Lys có 2 nguyên tử N do có 2 nhóm NH2.
(c) sai, Ala có số nhóm NH2 = COOH nên không làm đổi màu quỳ tím.
(d) sai, tristearin là chất béo no nên không cộng H2.
(e) sai.
(g) đúng.
⟹ 2 phát biểu đúng.
Câu 35:
Hỗn hợp A gồm MgO, Fe2O3, FeS và FeS2. Người ta hòa tan hoàn toàn m gam A trong H2SO4 đặc nóng dư thu SO2, dung dịch sau phản ứng chứa 155m/67 gam muối. Mặt khác hòa tan m gam A trên vào HNO3 đặc nóng dư thu 14,336 lít hỗn hợp khí gồm SO2 và NO2 có tổng khối lượng là 29,8 gam. Cô cạn dung dịch sau phản ứng thu 28,44 gam muối. Biết trong A oxi chiếm 10m/67 về khối lượng. Phần trăm FeS trong A gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Phương pháp giải:
Quy đổi hỗn hợp thành Mg, Fe, O, S.
Lưu ý: MgO không có phản ứng oxi hóa - khử với HNO3 nên không có khả năng tạo NH4+.
Giải chi tiết:
Quy đổi hỗn hợp thành Mg, Fe, O, S.
Lưu ý: MgO không có phản ứng oxi hóa - khử với HNO3 nên không có khả năng tạo NH4+.
(1) 67.mO = 10.mhh A ⟹ 67.16z = 10.(24x + 56y + 16z + 32t) ⇔ 240x + 560y - 912z + 320t = 0
(2) 67.mmuối (TN1) = 155.mhh A ⟹ 67.(120x + 400.0,5y) = 155.(24x + 56y + 16z + 32t)
⟹ 4320x + 4720y - 2480z -4960t = 0
(3) Áp dụng bảo toàn e: 2nMg + 3nFe + 4nSO2 + 6nSO42- = 2nO + nNO2
⟹ 2x + 3y + 4.0,02 + 6.(t - 0,02) = 2z + 0,62
(4) mmuối (TN2) = 24x + 56y + 96.(t - 0,02) + 62.(2x + 3y - 2t + 0,04)
Giải hệ 4 phương trình trên được
Quy đổi ngược lại:
Giải hệ
⟹ %mFeS ≈ 32,8% gần nhất với 33%.
Câu 36:
Hỗn hợp E gồm ba este mạch hở, đều có bốn liên kết pi (π) trong phân tử, trong đó có một este đơn chức là este của axit metacrylic và hai este hai chức là đồng phân của nhau. Đốt cháy hoàn toàn 12,22 gam E bằng O2, thu được 0,37 mol H2O. Mặt khác, cho 0,36 mol E phản ứng vừa đủ với 234 ml dung dịch NaOH 2,5M, thu được hỗn hợp X gồm các muối của các axit cacboxylic không no, có cùng số nguyên tử cacbon trong phân tử; hai ancol không no, đơn chức có khối lượng m1 gam và một ancol no, đơn chức có khối lượng m2 gam. Tỉ lệ m1 : m2 có giá trị gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Phương pháp giải:
Giải chi tiết:
nNaOH = 0,234.2,5 = 0,585 mol
*Xét phản ứng thủy phân hỗn hợp E trong NaOH:
Đặt n este đơn chức = x và n este hai chức = y (mol)
⟹ nE = x + y = 0,36 mol và nNaOH = x + 2y = 0,585
Giải hệ thu được x = 0,135 và y = 0,225
⟹ x : y = 3 : 5
*Xét phản ứng đốt cháy E:
Do X, Y đều chứa 4 liên kết π nên ta giả sử E gồm:
CnH2n-6O2 (3a mol) và CmH2m-6O4 (5a mol)
nCO2 - nH2O = 3nE ⟹ nCO2 - 0,37 = 3.8a ⟹ nCO2 = 24a + 0,37 (mol)
Mặt khác: mE = mC + mH + mO ⟹ 12(24a + 0,37) + 0,37.2 + 3a.32 + 5a.64 = 12,22 ⟹ a = 0,01 mol
⟹ nCO2 = 24.0,01 + 0,37 = 0,61 mol; n este đơn chức = 0,03 và n este hai chức = 0,05 (mol)
BTNT "C": nCO2 = 0,03n + 0,05m = 0,61 chỉ có nghiệm n = 7 và m = 8 thỏa mãn (Do các axit đều 4C và ancol không no tối thiểu 3C nên n ≥ 7 và m ≥ 8)
Do thủy phân E trong NaOH thu được hỗn hợp X gồm các muối của các axit cacboxylic không no, có cùng số nguyên tử cacbon trong phân tử; hai ancol không no, đơn chức và một ancol no, đơn chức nên ta suy ra cấu tạo của các chất trong E là:
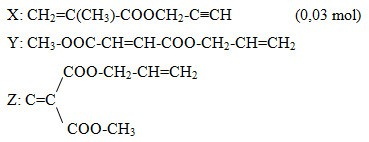
Ancol đa chức gồm: CH≡C-CH2-OH (0,03 mol) và CH2=CH-CH2-OH (0,05 mol)
⟹ m1 = 0,03.56 + 0,05.58 = 4,58 gam
Ancol đơn chức gồm: CH3OH (0,05 mol)
⟹ m2 = 0,05.32 = 1,6 gam
⟹ m1 : m2 = 4,58 : 1,6 = 2,8625 gần nhất với 2,9.
Câu 37:
Hỗn hợp E chứa ba peptit đều mạch hở gồm peptit X (C4H8O3N2), peptit Y (C7HxOyNz) và peptit Z (C11HnOmNt). Đun nóng 56,84 gam E với dung dịch NaOH vừa đủ thu được hỗn hợp T gồm 3 muối của glyxin, alanin và valin. Đốt cháy toàn bộ T cần dùng 2,31 mol O2, thu được CO2, H2O, N2 và 46,64 gam Na2CO3. Phần trăm khối lượng của X trong E là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Gly có 2C; Ala có 3C; Val có 5C.
Peptit X có 4C ⟹ X: Gly2
Peptit Y có 7C ⟹ Y: Gly2Ala hoặc GlyVal
Peptit được tạo từ các a.a no có 1 nhóm NH2, 1 nhóm COOH nên quy đổi thành CONH, CH2, H2O (lưu ý: số mol H2O bằng số mol peptit).
- Kết hợp bảo toàn nguyên tố, bảo toàn khối lượng xác định được số nguyên tử N trung bình là 4,4
⟹ E có chứa 1 peptit là pentapeptit trở lên
- Kết hợp với số nguyên tử C của X, Y, Z ⟹ Z phải là Gly4Ala ⟹ Y là GlyVal (vì sản phẩm thu được có Val).
- Từ đó xác định số mol của X, Y, Z ⟹ phần trăm khối lượng của X.
Giải chi tiết:
Gly có 2C; Ala có 3C; Val có 5C.
Peptit X có 4C ⟹ X: Gly2
Peptit Y có 7C ⟹ Y: Gly2Ala hoặc GlyVal
Peptit được tạo từ các a.a no có 1 nhóm NH2, 1 nhóm COOH nên quy đổi thành CONH, CH2, H2O (lưu ý: số mol H2O bằng số mol peptit).
+) BTNT "Na": nNaOH = 2nNa2CO3 = 0,88 mol = nCONH = nCOONa.
Sơ đồ:
+) BTKL phản ứng đốt cháy muối T:
0,88.67 + 0,88.16 + 14a + 2,31.32 = 106.0,44 + 44.(a + 0,44) + 18.(a + 0,88) + 0,44.28
⟹ a = 1,1
+) mE = mCONH + mCH2 + mH2O ⟹ 0,88.43 + 14.1,1 + 18b = 56,84 ⟹ b = 0,2.
+) ⟹ E có chứa 1 peptit là pentapeptit trở lên
Kết hợp với số nguyên tử C của X, Y, Z ⟹ Z phải là Gly4Ala ⟹ Y là GlyVal (vì sản phẩm thu được có Val).
⟹ ⟹ ⟹
⟹ %mX = 4,64%.
Câu 38:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Để dễ tính toán ta tự chọn giá trị của x và y theo tỉ lệ đề bài cho ⟹ nion KL = x ⟹ nNO3- = 2,5x.
Sơ đồ:
+) BTNT "H" ⟹ nH2O = ½ nHNO3
+) BTNT "N" ⟹ nN(khí Z) = nHNO3 - nNO3-
+) BTNT "O" ⟹ nO(khí Z) = 3nHNO3 - 3nNO3- - nH2O
Từ đó tính được tỉ lệ số nguyên tử N : O trong khí Z ⟹ Khí Z.
Giải chi tiết:
Để dễ tính toán ta giả sử x = 8; y = 25 (mol).
⟹ nion KL = x = 8 mol ⟹ nNO3- = 2,5.8 = 20 mol.
Sơ đồ:
+) BTNT "H" ⟹ nH2O = ½ nHNO3 = ½.25 = 12,5 mol
+) BTNT "N" ⟹ nN(khí Z) = nHNO3 - nNO3- = 25 - 20 = 5 mol
+) BTNT "O" ⟹ nO(khí Z) = 3nHNO3 - 3nNO3- - nH2O = 3.25 + 3.20 - 12,5 = 2,5 mol
⟹ Khí Z có tỉ lệ N : O = 5 : 2,5 = 2 : 1
⟹ Khí Z là N2O.
Câu 39:
Tiến hành điện phân dung dịch chứa a mol CuSO4 bằng điện cực trơ đến khi khối lượng dung dịch giảm 16 gam thì dừng điện phân. Nhúng thanh Mg vào dung dịch sau điện phân, kết thúc phản ứng thấy khí H2 thoát ra, đồng thời khối lượng thanh kim loại không đổi so với trước phản ứng. Biết các phản ứng xảy ra hoàn toàn. Giá trị a là
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
Do nhúng Mg vào dd sau điện phân thì khối lượng thanh Mg không đổi nên chứng tỏ dd sau điện phân có chứa Cu2+ để sinh ra Cu bù vào lượng Mg bị tan.
Catot: Cu2+ + 2e → Cu
Anot: H2O → 2H+ + ½ O2 + 2e
Dựa vào khối lượng dung dịch giảm tính được lượng Cu2+ bị điện phân.
Từ đó xác định thành phần dung dịch sau điện phân.
Khi nhúng Mg vào dd sau điện phân:
Mg + Cu2+ → Mg2+ + Cu
Mg + 2H+ → Mg2+ + H2
Khối lượng thanh Mg không đổi nên lượng Mg tan ra bằng lượng Cu bám vào ⟹ giá trị của a.
Giải chi tiết:
Do nhúng Mg vào dd sau điện phân thì khối lượng thanh Mg không đổi nên chứng tỏ dd sau điện phân có chứa Cu2+ để sinh ra Cu bù vào lượng Mg bị tan.
Giả sử nCu2+ bị điện phân = b (mol).
Catot: Cu2+ + 2e → Cu
b → 2b → b
Anot: H2O → 2H+ + ½ O2 + 2e
2b ← 0,5b ← 2b
Ta có: mdd giảm = mCu + mO2 ⟹ 64b + 32.0,5b = 16 ⟹ b = 0,2.
Dung dịch sau điện phân có chứa: Cu2+ dư (a - 0,2); H+ (0,4) và SO42- (a)
Khi nhúng Mg vào dd sau điện phân:
Mg + Cu2+ → Mg2+ + Cu
(a-0,2) ← (a-0,2) → (a-0,2)
Mg + 2H+ → Mg2+ + H2
0,2 ← 0,4
Khối lượng thanh Mg không đổi nên lượng Mg tan ra bằng lượng Cu bám vào
⟹ 24.(a - 0,2 + 0,2) = 64.(a - 0,2)
⟹ a = 0,32.
Câu 40:
 Xem đáp án
Xem đáp án
Đáp án A
Phương pháp giải:
+) BTĐT cho dd muối: nNH4+ = 2nSO42- - 2nCu2+ - 2nMg2+ - nK+
+) BTNT "H": 2nH2SO4 = 4nNH4+ + 2nH2O ⟹ nH2O
+) BTNT "N": nN(X) = nKNO3 - nNH4+
+) BTNT "O": nO(X) = 3nKNO3 - nH2O
⟹ mX = mN(X) + mO(X) ⟹ MX = mX : nX ⟹ dX/H2.
Giải chi tiết:
+) BTĐT cho dd muối: nNH4+ = 2nSO42- - 2nCu2+ - 2nMg2+ - nK+ = 0,01 mol
+) BTNT "H": 2nH2SO4 = 4nNH4+ + 2nH2O ⟹ nH2O = 0,14 mol
+) BTNT "N": nN(X) = nKNO3 - nNH4+ = 0,06 mol
+) BTNT "O": nO(X) = 3nKNO3 - nH2O = 0,07 mol
⟹ mX = mN(X) + mO(X) = 0,06.14 + 0,07.16 = 1,96 gam
⟹ MX = mX : nX = 1,96 : 0,05 = 39,2 ⟹ dX/H2 = 19,6
