Chuyên đề ôn thi THPTQG môn Hóa Học cực hay có đáp án (Chuyên đề 1)
-
2968 lượt thi
-
40 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 3:
Khí biogaz sản xuất từ chất thải chăn nuôi được sử dụng làm nguồn nhiên liệu trong sinh hoạt ở nông thôn. Tác dụng của việc sử dụng khí biogaz là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 9:
Cho đồ thị biểu diễn nhiệt độ sôi của ba chất sau:
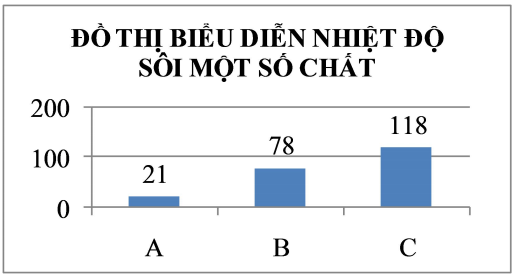
Chất A, B, C lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án A
Câu 10:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Quỳ tím |
Quỳ tím chuyển màu đỏ |
|
Y |
Nước brom |
Kết tủa màu trắng |
|
Z |
Dung dịch AgNO3 trong NH3 |
Kết tủa Ag trắng sáng. |
|
T |
Cu(OH)2 |
Dung dịch có màu xanh lam. |
Các dung dịch X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 18:
Chất X vừa tác dụng được với axit, vừa tác dụng được với bazơ. Chất X là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 20:
Cho các chất: saccarozơ, glucozơ, frutozơ, etyl fomat, axit fomic và anđehit axetic. Trong các chất trên, số chất vừa có khả năng tham gia phản ứng tráng bạc vừa có khả năng phản ứng với Cu(OH)2 ở điều kiện thường là
 Xem đáp án
Xem đáp án
Đáp án B
Các chất tham gia phản ứng là: glucozơ, frutozơ, axit fomic
Câu 21:
Cho 1,2 gam một axit cacboxylic đơn chức X tác dụng vừa hết với dung dịch NaOH, thu được 1,64 gam muối. X là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 22:
Cho 15 gam hỗn hợp các amin gồm anilin, metylamin, đimetylamin, đietylmetylamin tác dụng vừa đủ với 50 ml dung dịch HCl 1M. Khối lượng sản phẩm thu được là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 23:
Trộn 50 ml dung dịch H3PO4 1M với V ml dung dịch KOH 1M, thu được muối trung hòa. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 25:
Đốt cháy hoàn toàn 0,6 mol hỗn hợp E chứa ancol X; este đơn chức Y và anđehit Z (X, Y, Z đều no, mạch hở và có cùng số nguyên tử hiđro) có tỉ lệ mol tương ứng 3 : 1 : 2 thu được 24,64 lít CO2 (đktc) và 21,6 gam nước. Mặt khác, cho 0,6 mol hỗn hợp E trên tác dụng với dung dịch AgNO3 dư trong NH3, đun nóng thu được m gam Ag. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án D
PS : Vì Z là hợp chất no nên chỉ cần tìm được số C và H là có thể tìm được công thức của nó.
Câu 26:
Đốt cháy hoàn toàn 0,15 mol một este X, thu được 10,08 lít khí CO2 (đktc) và 8,1 gam H2O. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 27:
Hòa tan 1,12 gam Fe bằng 300 ml dung dịch HCl 0,2M, thu được dung dịch X và khí H2. Cho dung dịch AgNO3 dư vào X, thu được khí NO (sản phẩm khử duy nhất của N+5) và m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 28:
Cho m gam phenol (C6H5OH) tác dụng với natri dư thấy thoát ra 0,56 lít khí H2 (đktc), giá trị m của là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 29:
Cho 31,9 gam hỗn hợp Al2O3, ZnO, FeO, CaO tác dụng hết với CO dư, đun nóng thu được 28,7 gam hỗn hợp X. Cho X tác dụng với dung dịch HCl dư, thu được V lít khí H2 (đktc). V có giá trị là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 30:
Hai hợp chất hữu cơ X và Y có cùng công thức phân tử là C3H7NO2, đều là chất rắn ở điều kiện thường. Chất X phản ứng với dung dịch NaOH, giải phóng khí. Chất Y có phản ứng trùng ngưng. Các chất X và Y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Hai hợp chất hữu cơ X và Y có cùng công thức phân tử là C3H7NO2, đều là chất rắn ở điều kiện thường.
Chất X phản ứng với dung dịch NaOH, giải phóng khí, suy ra X là muối amoni, có công thức là CH2=CHCOONH4 (amoni acrylat) hoặc HCOOH3NCH=CH2 (vinylamoni fomat).
Chất Y có phản ứng trùng ngưng, suy ra Y là amino axit, có công thức là H2NCH2CH2COOH (axit 3 – aminopropanoic) hoặc CH3CH(H2N)COOH (axit 2 – aminopropanoic). Vậy căn cứ vào các phương án suy ra X và Y lần lượt là amoni acrylat và axit 2-aminopropionic.
Phương trình phản ứng:
Câu 31:
Đun nóng 250 gam dung dịch glucozơ với dung dịch AgNO3 /NH3 thu được 15 gam Ag, nồng độ của dung dịch glucozơ là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 32:
Cho từ từ chất X vào dung dịch Y, sự biến thiên lượng kết tủa Z tạo thành trong thí nghiệm được biểu diễn trên đồ thị sau:
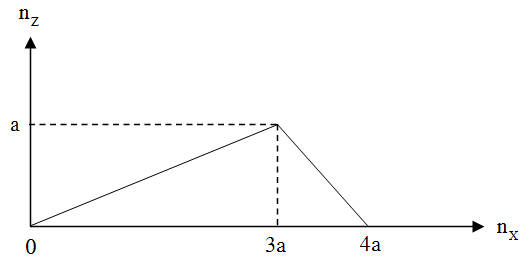
Thí nghiệm nào sau đây ứng với thí nghiệm trên?
 Xem đáp án
Xem đáp án
Đáp án D
Dựa vào đồ thị, ta thấy: Khi cho từ từ X vào dung dịch Y, phản ứng thứ nhất tạo kết tủa Z và lượng kết tủa tăng dần đến cực đại là a mol, phản ứng này cần 3a mol X. Phản ứng thứ hai hòa tan Z từ từ đến hết, phản ứng này cần a mol chất X.
Suy ra: Đây là thí nghiệm cho từ từ đến dư dung dịch NaOH vào dung dịch Al(NO3)3.
Phương trình phản ứng:
Câu 33:
Cho bột nhôm dư vào 100 ml dung dịch CuSO4 0,2M đến khi phản ứng xảy ra hoàn toàn, thu được m gam Cu. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 34:
Cho tất cả các đồng phân đơn chức, mạch hở, có cùng công thức phân tử C2H4O2 lần lượt tác dụng với: Na, NaOH, NaHCO3. Số phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Đáp án D
C2H4O2 có hai đồng phân đơn chức, mạch hở là CH3COOH và HCOOCH3. Axit axetic phản ứng được với cả ba chất Na, NaOH, NaHCO3; metyl fomat chỉ phản ứng được với NaOH. Vậy số phản ứng xảy ra là 4.
Phương trình phản ứng:
Câu 35:
Cho 50 gam CaCO3 tác dụng vừa đủ với dung dịch HCl 20% (d=1,2g/ml). Khối lượng dung dịch HCl đã dùng là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 36:
Cho hỗn hợp gồm Na2O, CaO, Al2O3 và MgO vào lượng nước dư, thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào X, thu được kết tủa là
 Xem đáp án
Xem đáp án
Đáp án C
Giải thích:
Câu 37:
Cho m gam Mg tác dụng với dung dịch hỗn hợp Cu(NO3)2 và H2SO4 đun nóng, khuấy đều để phản ứng xảy ra hoàn toàn, thu được dung dịch X, 0,896 lít (đktc) hỗn hợp khí Y trong đó có một khí hóa nâu khi để ngoài không khí có tỉ khối so với He là 4 và 1,76 gam hỗn hợp 2 kim loại không tan có cùng số mol. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 38:
Tiến hành điện phân (với điện cực trơ, hiệu suất 100% dòng điện có cường độ không đổi) dung dịch X gồm 0,2 mol CuSO4 và 0,15 mol HCl, sau một thời gian điện phân thu được dung dịch Y có khối lượng giảm 14,125 gam so với khối lượng dung dịch X. Cho 15 gam bột Fe vào Y đến khi kết thúc các phản ứng thu được m gam chất rắn. Biết các khi sinh ra hòa tan không đáng kể trong nước. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 39:
Hỗn hợp X gồm hai chất hữu cơ no, mạch hở (đều chứa C, H, O), trong phân tử mỗi chất có hai nhóm chức trong số các nhóm -OH, -CHO, -COOH. Cho m gam X phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 4,05 gam Ag và 1,86 gam một muối amoni hữu cơ. Cho toàn bộ lượng muối amoni hữu cơ này vào dung dịch NaOH (dư, đun nóng), thu được 0,02 mol NH3. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 40:
Cho 14,19 gam hỗn hợp gồm 3 amino axit (phân tử chỉ chứa một nhóm cacboxyl và một nhóm amino) vào dung dịch chứa 0,05 mol axit oxalic, thu được dung dịch X. Thêm tiếp 300 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được 26,19 gam chất rắn khan Y. Hòa tan Y trong dung dịch HCl dư, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C