Chuyên đề ôn thi THPTQG môn Hóa Học cực hay có đáp án (Chuyên đề 4)
-
2995 lượt thi
-
40 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 2:
Chất nào dưới đây khi tham gia phản ứng trùng ngưng tạo thành tơ nilon – 6?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 4:
Để bảo vệ vỏ tàu biển làm bằng thép, người ta thường gắn vào vỏ tàu (phần ngâm dưới nước) những tấm kim loại :
 Xem đáp án
Xem đáp án
Đáp án D
Câu 5:
Cho một vật bằng nhôm vào dung dịch NaOH. Số phản ứng hóa học đã xảy ra là
 Xem đáp án
Xem đáp án
Đáp án B
+ Những vật bằng nhôm có lớp Al2O3 bảo vệ.
+ Phương trình phản ứng:
Câu 6:
Cho dung dịch NaOH vào dung dịch muối clorua X, lúc đầu thấy xuất hiện kết tủa màu trắng hơi xanh, sau đó chuyển sang màu nâu đỏ. Công thức của X là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 8:
Khi dùng phễu chiết có thể tách riêng hai chất lỏng X và Y. Xác định các chất X, Y tương ứng trong hình vẽ?
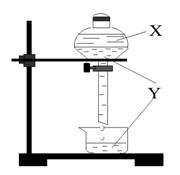
Phễu chiết có tác dụng tách riêng các chất lỏng có khối lượng riêng khác nhau và không bị hòa tan vào nhau. Vậy X, Y không thể là NaOH và phenol; H2O và axit axetic; nước muối và nước đường. X, Y là benzen và H2O.
 Xem đáp án
Xem đáp án
Đáp án C
Câu 10:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bẳng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Quỳ tím |
Chuyển màu hồng |
|
Y |
Dung dịch I2 |
Có màu xanh tím |
|
Z |
Dung dịch AgNO3 trong NH3 |
Kết tủa Ag |
|
T |
Nước brom |
Kết tủa trắng |
Các dung dịch X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án D
Câu 15:
Tỉ khối hơi của một este đơn chức X so với khí cacbonic là 2. Công thức phân tử của X là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 16:
Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ
 Xem đáp án
Xem đáp án
Đáp án D
Câu 18:
Biết rằng mùi tanh của cá (đặc biệt cá mè) là hỗn hợp các amin (nhiều nhất là trimetylamin) và một số chất khác. Để khử mùi tanh của cá trước khi nấu ta có thể dùng dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 20:
Trong các chất: triolein, saccarozơ, tinh bột, anbumin, glucozơ, glyxin, alanin, fructozơ. Số chất có thể tham gia phản ứng thủy phân là
 Xem đáp án
Xem đáp án
Đáp án C
Các chất tham gia phản ứng thủy phân là: triolein, saccarozơ, tinh bột, anbumin
Câu 21:
Đun nóng hỗn hợp X gồm 0,1 mol CH3OH và 0,2 mol C2H5OH với H2SO4 đặc ở 140oC, khối lượng ete thu được là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 22:
Khi thủy phân hoàn toàn 0,2 mol peptit X mạch hở (X tạo bởi các amino axit có một nhóm amino và một nhóm cacboxylic) bằng lượng dung dịch KOH gấp đôi lượng cần phản ứng, cô cạn dung dịch thu được hỗn hơp chất rắn tăng so với khối lượng X là 108,4 gam. Số liên kết peptit trong X là
 Xem đáp án
Xem đáp án
Đáp án D
+ Giả sử X có n gốc amino axit thì số liên kết là n-1
+ Sơ đồ phản ứng:
+Theo giả thiết và BTKL, ta có:
Câu 23:
Phân kali clorua sản xuất từ quặng xinvinit (chứa NaCl và KCl) thường chỉ có độ dinh dưỡng bằng 50%. Hàm lượng phần trăm của KCl trong phân bón đó là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 24:
Thực hiện các thí nghiệm với hỗn hợp gồm Ag và Cu (hỗn hợp X) :
(a) Cho X vào bình chứa một lượng dư khí O3 (ở điều kiện thường).
(b) Cho X vào một lượng dư dung dịch HNO3 (đặc)
(c) Cho X vào một lượng dư dung dịch hỗn hợp gồm NaNO3 và HCl.
(d) Cho X vào một lượng dư dung dịch FeCl3.
Thí nghiệm mà Cu bị oxi hóa còn Ag không bị oxi hóa là
 Xem đáp án
Xem đáp án
Đáp án A
Hỗn hợp X gồm Ag và Cu. Thí nghiệm mà Cu bị oxi hóa còn Ag không bị oxi hóa là (d): Cho X vào một lượng dư dung dịch FeCl3.
Phương trình phản ứng:
Ở thí nghiệm (a), cả Ag và Cu đều bị oxi hóa:
Ở thí nghiệm (b), cả Cu và Ag đều bị oxi hóa:
Câu 25:
X, Y là hai hợp chất hữu cơ đơn chức phân tử chỉ chứa C, H, O. Khi đốt cháy X, Y với số mol bằng nhau hoặc khối lượng bằng nhau đều thu được CO2 với tỉ lệ mol tương ứng 2 : 3 và H2O với tỉ lệ mol tương ứng 1 : 2. Số cặp chất X, Y thỏa mãn là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 26:
Đốt cháy hoàn toàn 1 mol chất béo, thu được lượng CO2 và H2O hơn kém nhau 6 mol. Mặt khác, a mol chất béo trên tác dụng tối đa với 600 ml dung dịch Br2 1M. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 27:
Cho 1,37 gam Ba vào 100,0 ml dung dịch Al2(SO4)3 0,03M, thu được chất rắn có khối lượng là
 Xem đáp án
Xem đáp án
Đáp án C
+ Bài toán tương đương với:
Câu 28:
Cho 22,4 lít hỗn hợp khí X (đktc) gồm CH4, C2H4, C2H2 và H2 có tỉ khối đối với H2 là 7,3 đi chậm qua ống sứ đựng bột Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối đối với H2 là 73/6. Số mol H2 đã tham gia phản ứng là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 29:
Cho 55,86 gam hỗn hợp X gồm K2CO3, KOH, CaCO3 và Ca(OH)2 tác dụng với dung dịch HCl dư, thu được 5,376 lít CO2 (đktc) và dung dịch Y. Cô cạn dung dịch Y thu được 33,525 gam muối kali và m gam muối canxi. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 30:
Hai chất hữu cơ X, Y là đồng phân của nhau và có công thức phân tử là C3H7O2N. X tác dụng với NaOH thu được muối X1 có công thức phân tử là C2H4O2NNa; Y tác dụng với NaOH thu được muối Y1 có công thức phân tử là C3H3O2Na. Công thức cấu tạo của X, Y là
 Xem đáp án
Xem đáp án
Đáp án D
Sơ đồ phản ứng:
Theo bảo toàn nguyên tố ta thấy : Chất còn lại trong sơ đồ (1) là CH4O hay CH3OH; chất còn lại trong sơ đồ (2) là NH3 và H2O.
Vậy các chất X, Y là:
Câu 31:
Lên men 45 gam glucozơ để điều chế ancol etylic, hiệu suất phản ứng 80% thu được V lít khí CO2 (đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình phản ứng:
Câu 32:
Cho từ từ chất X vào dung dịch Y, sự biến thiên lượng kết tủa Z tạo thành trong thí nghiệm được biểu diễn trên đồ thị sau:
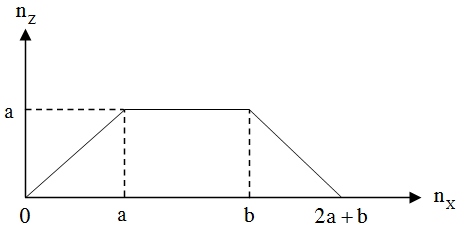
Phát biểu sau đây đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Dựa vào đồ thị, ta thấy: Khi cho từ từ X vào dung dịch Y, lượng kết tủa Z tăng dần lên cực đại là a mol, phản ứng này cần a mol chất X. Sau đó lượng kết tủa không đổi một thời gian, phản ứng này cần b mol chất X. Cuối cùng kết tủa bị hòa tan từ từ đến hết, phản ứng này cần a mol chất X.
Suy ra: Đây là phản ứng cho từ từ khí CO2 vào dung dịch chứa đồng thời NaOH và Ca(OH)2. X là CO2, dung dịch Y là NaOH và Ca(OH)2 và kết tủa Z là CaCO3.
Phương trình phản ứng xảy ra theo thứ tự sau:
Câu 33:
Điện phân hoàn toàn 200 ml dung dịch AgNO3 với 2 điện cực trơ, thu được một dung dịch có pH=2. Xem thể tích dung dịch thay đổi không đáng kể thì khối lượng Ag bám ở catot là
 Xem đáp án
Xem đáp án
Đáp án C
Cách 1: Tính theo phản ứng:
Cách 2: Tính theo bảo toàn nguyên tố và bảo toàn diện tích:
Câu 34:
Chất nào sau đây không tham gia phản ứng cộng với H2 (xúc tác Ni, to)?
 Xem đáp án
Xem đáp án
Đáp án C
Chất không tham gia phản ứng cộng H2 (to, Ni) là C2H2O4, nó là axit oxalic, có công thức cấu tạo là HOOC-
Câu 35:
Cho 6 lít hỗn hợp CO2 và N2 (đktc) đi qua dung dịch KOH tạo ra 2,07 gam K2CO3 và 6 gam KHCO3. Thành phần phần trăm về thể tích của CO2 trong hỗn hợp là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 36:
Cho bột Fe vào dung dịch hỗn hợp NaNO3 và HCl đến khi các phản ứng kết thúc, thu được dung dịch X, hỗn hợp khí NO, H2 và chất rắn không tan. Các muối trong dung dịch X là
 Xem đáp án
Xem đáp án
Đáp án B
Tính oxi hóa của mạnh hơn H+ nên phản ứng giải phóng H2 chứng tỏ đã hết.
Chất rắn không tan là Fe còn dư nên muối sắt trong dung dịch là Fe2+.
Vậy dung dịch X có các muối FeCl2, NaCl.
Câu 37:
Cho 27,04 gam hỗn hợp rắn X gồm Fe, FeO, Fe3O4, Fe2O3 và Fe(NO3)2 vào dung dịch chứa 0,88 mol HCl và 0,04 mol HNO3, khuấy đều cho các phản ứng xảy ra hoàn toàn, thu được dung dịch Y (không chứa ion NH4+) và 0,12 mol hỗn hợp khí Z gồm NO2 và N2O. Cho dung dịch AgNO3 đến dư vào dung dịch Y, thấy thoát ra 0,02 mol khí NO (sản phẩm khử duy nhất), đồng thời thu được 133,84 gam kết tủa. Biết tỉ lệ mol của FeO, Fe3O4, Fe2O3 trong X lần lượt là 3:2:1. Phần trăm số mol của Fe có trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 38:
Rót từ từ dung dịch chứa a mol HCl vào dung dịch hỗn hợp chứa a mol NaHCO3 và b mol Na2CO3, thu được (a+b)/7 mol khí CO2 và dung dịch X. Hấp thụ a mol CO2 vào dung dịch hỗn hợp chứa a mol Na2CO3 và b mol NaOH, thu được dung dịch Y. Tổng khối lượng chất tan trong 2 dung dịch X và Y là 59,04 gam. Cho dung dịch BaCl2 dư vào dung dịch Y thu được m1 gam kết tủa. Giá trị của m1 là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 39:
Hỗn hợp X gồm một anđehit, một axit cacboxylic và một este (trong đó axit và este là đồng phân của nhau). Đốt cháy hoàn toàn 0,2 mol X cần 0,625 mol O2, thu được 0,525 mol CO2 và 0,525 mol nước. Tính phần trăm khối lượng của anđehit có trong khối lượng hỗn hợp X?
 Xem đáp án
Xem đáp án
Đáp án A
Câu 40:
Hỗn hợp E gồm chất X (C3H10N2O4) và chất Y (C7H13N3O4), trong đó X là muối của axit đa chức, Y là tripeptit. Cho 27,2 gam E tác dụng với dung dịch NaOH dư, đun nóng thu được 0,1 mol hỗn hợp 2 khí. Mặt khác 27,2 gam E phản ứng với dung dịch HCl thu được m gam chất hữu cơ. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
