Chuyên đề ôn thi THPTQG môn Hóa Học cực hay có đáp án (Chuyên đề 6)
-
2997 lượt thi
-
40 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Cho các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của dạng oxi hóa như sau: Fe2+/Fe, Cu2+/Cu, Fe3+/Fe2+. Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 3:
Chất Z có phản ứng với dung dịch HCl, còn khi phản ứng với dung dịch nước vôi trong tạo ra chất kết tủa. Chất Z là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 4:
Cho hỗn hợp các kim loại Fe, Mg, Zn vào cốc đựng dung dịch CuSO4 dư, thứ tự các kim loại tác dụng với muối là:
 Xem đáp án
Xem đáp án
Đáp án B
Câu 6:
Sự thiếu hụt nguyên tố (ở dạng hợp chất) nào sau đây gây bệnh loãng xương?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 7:
Khí X được điều chế bằng cách cho axit phản ứng với kim loại hoặc muối và được thu vào ống nghiệm theo cách sau:
Khí X được điều chế bằng phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 8:
Kết luận nào sau đây phù hợp với thực nghiệm? Nung một chất hữu cơ X với lượng dư chất oxi hóa CuO, người ta thấy thoát ra khí CO2, hơi H2O và khí N2.
 Xem đáp án
Xem đáp án
Đáp án B
Câu 10:
Thực hiện thí nghiệm đối với ác dung dịch và có kết quả ghi theo bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Quỳ tím |
Hóa đỏ |
|
Y |
Dung dịch iot. |
Xuất hiện màu xanh tím |
|
Z |
Cu(OH)2 ở điều kiện thường |
Xuất hiện phức xanh lam |
|
T |
Cu(OH)2 ở điều kiện thường |
Xuất hiện phức màu tím |
|
P |
Nước Br2 |
Xuất hiện kết tủa màu trắng |
Các chất X, Y, Z, T, P lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 15:
Trường hợp nào dưới đây tạo ra sản phẩm là ancol và muối natri của axit cacboxylic?
 Xem đáp án
Xem đáp án
Đáp án A
Câu 16:
Cho phương trình hóa học của hai phản ứng sau:
FeO + CO Fe + CO2
3FeO + 10HNO3 3Fe(NO3)3 + NO + 5H2O
Hai phản ứng trên chứng tỏ FeO là chất
 Xem đáp án
Xem đáp án
Đáp án D
Câu 21:
Thực hiện phản ứng crackinh butan, thu được hỗn hợp sản phẩm X gồm 5 hiđrocacbon có khối lượng mol trung bình là 32,65 gam/mol. Hiệu suất phản ứng crackinh là
 Xem đáp án
Xem đáp án
Đáp án A
+ Phản ứng crackinh butan:
+ Suy ra:
Câu 22:
Thủy phân hoàn toàn 1 mol pentapeptit X mạch hở thì thu được 3 mol glyxin, 1 mol alanin và 1 mol valin. Khi thủy phân không hoàn toàn X thì trong sản phẩm thấy có các đipeptit Ala-Gly, Gly-Ala và tripeptip Gly-Gly-Val. Công thức của X và phần trăm khối lượng của N trong X là:
 Xem đáp án
Xem đáp án
Đáp án D
Câu 23:
Để phân biệt các dung dịch riêng biệt: NaCl, MgCl2, AlCl3, FeCl3, có thể dùng dung dịch
 Xem đáp án
Xem đáp án
Đáp án D
Thuốc thử cần dùng là dung dịch NaOH:
|
Dung dịch |
Phương trình phản ứng |
Hiện tượng |
|
NaCl |
|
Không có hiện tượng xảy ra. |
|
MgCl2 |
|
Tạo kết tủa trắng không tan. |
|
AlCl3 |
|
Tạo kết tủa trắng keo, sau đó kết tủa tan hết. |
|
FeCl3 |
|
Tạo kết tủa màu nâu đỏ. |
Câu 24:
Cho V lít dung dịch chứa đồng thời Ba(OH)21M và NaOH 0,5M vào 200 ml dung dịch H2SO4 1M và HCl 1M. Sau khi các phản ứng xảy ra kết thúc, thu được dung dịch có pH=7. Giá trị V là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 25:
Oxi hóa 4,2 gam sắt trong không khí, thu được 5,32 gam hỗn hợp X gồm sắt và các oxit sắt. Hòa tan hết X bằng 200 ml dung dịch HNO3 a mol/l, sinh ra 0,448 lít NO (ở đktc, sản phẩm khử duy nhất của N+5). Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án B
Chú ý : Nếu cho rằng X tan hết trong HNO3 tạo thành Fe(NO3)3 thì tính được:
Đây là kết quả sai! Thực tế ở bài này muối tạo thành gồm cả Fe(NO3)2 và Fe(NO3)3.
Câu 26:
Geranial (3,7-đimetyloct-2,6-đien-1-al) có trong tinh dầu xả có tác dụng sát trùng, giảm mệt mỏi, chống căng thẳng... Để phản ứng cộng hoàn toàn 15,2 gam Geranial cần tối đa bao nhiêu lít H2 (đktc)?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 27:
Hỗn hợp X gồm vinyl axetat; etylen glicol điaxetat; axit acrylic; axit oxalic. Đốt cháy m gam X cần vừa đủ 9,184 lít O2 (đktc), thu được 8,96 lít CO2 (đktc) và 5,4 gam H2O. Mặt khác, cho hỗn hợp X phản ứng với dung dịch NaOH 1M, thể tích dung dịch NaOH tối đa phản ứng được (ở điều kiện thích hợp) là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 28:
Hòa tan hoàn toàn hỗn hợp Mg, Al, Fe và Cu trong dung dịch HNO3 (loãng dư) thu được dung dịch X. Cho dung dịch NaOH dư vào dung dịch X được kết tủa Y. Nung kết tủa Y đến khi phản ứng nhiệt phân kết thúc thu được tối đa bao nhiêu oxit?
 Xem đáp án
Xem đáp án
Đáp án D
Giải thích:
Câu 29:
Khi lên men 360 gam glucozơ với hiệu suất 100%, khối lượng ancol etylic thu được là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 30:
Hòa tan hoàn toàn 11,2 gam CaO vào H2O, thu được dung dịch X. Sục khí CO2 vào dung dịch X, qua quá trình khảo sát người ta lập đồ thị của phản ứng như sau:
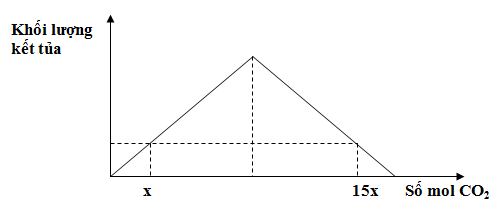
Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án A
+ Ta có đồ thị:
Câu 31:
Khi cho 5,6 gam Fe tác dụng với 250 ml dung dịch AgNO3 1M thì sau khi phản ứng kết thúc thu được bao nhiêu gam chất rắn?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 32:
Cho 7,8 gam kali tác dụng với 1 lít dung dịch HCl 0,1M, sau phản ứng thu được dung dịch X và V lít H2 (đktc). Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị của V và m lần lượt là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 33:
Hợp chất X có công thức C8H14O4. Từ X thực hiện các phản ứng (theo đúng tỉ lệ mol):
(a) X + 2NaOH X1 + X2 + H2O (b) X1 + H2SO4 X3 + Na2SO4
(c) nX3 + nX4 nilon-6,6 + 2nH2O (d) 2X2 + X3 X5 + 2H2O
Phân tử khối của X5 là
 Xem đáp án
Xem đáp án
Đáp án B
Từ (b) và (c), suy ra X3 là axit ađipic, X1 là NaOOC(CH2)4COONa. Áp dụng bảo toàn nguyên tố cho phản ứng (a), suy ra X2 là C2H5OH và X là HOOC(CH2)4COOC2H5. Từ (d) suy ra X5 là C2H5OOC(CH2)4COOC2H5 và Phương trình phản ứng minh họa:
Câu 34:
Thuỷ phân este Z trong môi trường axit thu được hai chất hữu cơ X và Y (MX < MY). Bằng một phản ứng có thể chuyển hoá X thành Y. Chất Z không thể là
 Xem đáp án
Xem đáp án
Đáp án C
Thuỷ phân este Z trong môi trường axit thu được hai chất hữu cơ X và Y (MX < MY). Bằng một phản ứng có thể chuyển hoá X thành Y. Suy ra Z không thể là metyl propionat.
Chất Z ở các phương án còn lại đều thỏa mãn:
Câu 35:
Hỗn hợp M gồm Lys–Gly–Ala, Lys–Ala–Lys–Lys–Lys–Gly và Ala–Gly trong đó oxi chiếm 21,3018% về khối lượng. Cho 0,16 mol M tác dụng vừa đủ với dung dịch HCl thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 36:
X là este no, đơn chức; Y là este đơn chức; không no chứa một liên kết đôi C=C (X, Y đều mạch hở). Đốt cháy hoàn toàn 14,4 gam hỗn hợp E chứa X, Y cần dùng 14,336 lít O2 (đktc) thu được 9,36 gam nước. Mặt khác, thủy phân hoàn toàn E trong môi trường axit thu được hỗn hợp chứa 2 axit cacboxylic A, B (MA < MB) và ancol Z duy nhất. Cho các nhận định sau:
(1) X, A đều cho được phản ứng tráng gương.
(2) X, Y, A, B đều làm mất màu dung dịch Br2 trong môi trường CCl4.
(3) Y có mạch cacbon phân nhánh, từ Y điều chế thủy tinh hữu cơ bằng phản ứng trùng hợp.
(4) Đun Z với H2SO4 đặc ở 170oC thu được anken tương ứng.
(5) Nhiệt độ sôi tăng dần theo thứ tự X < Y < Z < A < B.
(6) Tính axit giảm dần theo thứ tự A > B > Z.
Số nhận định đúng là:
 Xem đáp án
Xem đáp án
Đáp án D
+ Vậy có 3 kết luận đúng là : (1), (5), (6).
+ (2) sai vì nhóm -CHO chỉ làm mất màu dung dịch Br2 trong nước. (3) sai vì Y có thể có các công thức cấu tạo khác nhau:
|
|
|
|
(4) sai vì CH3OH là ancol có 1 nguyên tử C nên khi tách nước ở 140 hay 170oC cũng chỉ tạo ra ete.
Câu 37:
Điện phân điện cực trơ màng ngăn xốp, dung dịch X chứa a gam Cu(NO3)2 và b gam NaCl đến khi có khí thoát ra ở cả 2 điện cực thì dừng lại, thu được dung dịch Y và 0,51 mol khí Z. Dung dịch Y hòa tan tối đa 12,6 gam Fe giải phóng NO (sản phẩm khử duy nhất) và dung dịch T. Dung dịch T cho kết tủa với dung dịch AgNO3. Tổng giá trị của (a + b) là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 38:
Dung dịch X gồm CuCl2 0,2M; FeCl2 0,3M; FeCl3 0,3M. Cho m gam bột Mg vào 100 ml dung dịch X khuấy đều đến khi phản ứng kết thúc thu được dung dịch Y. Thêm dung dịch KOH dư vào Y được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 5,4 gam chất rắn T. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 39:
Hỗn hợp X gồm Cu và Fe3O4. Khử m gam hỗn hợp X bằng khí CO dư (đun nóng), thu được 0,798m gam hỗn hợp kim loại. Cho m gam hỗn hợp X tác dụng với dung dịch HCl lấy dư, thu được dung dịch Y và chất rắn Z. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư, thu được 427,44 gam kết tủa và V lít khí NO (đktc). Mặt khác, cho m gam hỗn hợp X tác dụng với dung dịch HNO3 loãng dư thu được 2,75V lít NO (sản phẩm khử duy nhất, đktc). Giá trị gần nhất của V là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 40:
Xà phòng hoá hoàn toàn m gam một este no, đơn chức, mạch hở E bằng 26 gam dung dịch MOH 28% (M là kim loại kiềm). Cô cạn hỗn hợp sau phản ứng thu được 24,72 gam chất lỏng X và 10,08 gam chất rắn khan Y. Đốt cháy hoàn toàn Y, thu được sản phẩm gồm CO2, H2O và 8,97 gam muối cacbonat khan. Mặt khác, cho X tác dụng với Na dư, thu được 12,768 lít khí H2 (đktc). Phần trăm khối lượng muối trong Y có giá trị gần nhất với
 Xem đáp án
Xem đáp án
Đáp án B
