Chuyên đề ôn thi THPTQG môn Hóa Học cực hay có đáp án (Chuyên đề 10)
-
2967 lượt thi
-
40 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
Những tính chất vật lí chung của kim loại (tính dẫn điện, tính dẫn nhiệt, tính dẻo, ánh kim) được gây nên chủ yếu bởi
 Xem đáp án
Xem đáp án
Đáp án A
Câu 2:
Trong số các polime sau đây: tơ tằm, sợi bông, len lông cừu, tơ visco, tơ nilon-6, tơ axetat, tơ nitron, thì những polime có nguồn gốc từ xenlulozơ là:
 Xem đáp án
Xem đáp án
Đáp án B
Câu 3:
Khí nào sau đây có trong không khí đã làm cho đồ dùng bằng bạc lâu ngày bị xám đen?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 4:
Cho dãy các kim loại: Ag, Cu, Al, Mg. Kim loại trong dãy có tính khử yếu nhất là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 7:
Cho các dung dịch sau: NaHCO3, Na2S, Na2SO4, Fe(NO3)2, FeS, Fe(NO3)3 lần lượt vào dung dịch HCl. Số trường hợp có khí thoát ra là
 Xem đáp án
Xem đáp án
Đáp án C
Các trường hợp có khí thoát ra là: NaHCO3, Na2S, Fe(NO3)2, FeS
Câu 10:
X, Y, Z, T là một trong bốn chất: triolein, glyxin, tristearin, anilin. Cho bảng số liệu sau:
|
|
X |
Y |
Z |
T |
|
Nhiệt độ nóng chảy |
71,5 |
235 |
-6,3 |
-5,5 |
|
Nước brom |
Không hiện tượng |
Không hiện tượng |
Kết tủa trắng |
Mất màu nước brom |
Nhận định nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 11:
Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
 Xem đáp án
Xem đáp án
Đáp án C
Câu 12:
Để chuyển hoá ankin thành anken, ta thực hiện phản ứng cộng H2 trong điều kiện có xúc tác là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 19:
Để bảo vệ con người khỏi sự ô nhiễm không khí, một công ty của Anh đã cho ra đời sản phẩm khẩu trang khá đặc biệt, không những có thể lọc sạch bụi mà còn có thể loại bỏ đến 99% các virus, vi khuẩn và khí ô nhiễm.

Theo em trong loại khẩu trang này có chứa chất nào trong số các chất sau?
 Xem đáp án
Xem đáp án
Đáp án B
Câu 21:
Cho hỗn hợp X gồm 0,1 mol C2H4 và 0,1 mol CH4 qua 100 gam dung dịch Br2 thấy thoát ra hỗn hợp khí Y có tỉ khối so với H2 là 9,2. Vậy nồng độ phần trăm của dung dịch Br2 là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 22:
X có công thức phân tử là C3H10N2O2. Cho 10,6 gam X phản ứng với một lượng vừa đủ dung dịch NaOH đun nóng, thu được 9,7 gam muối khan và khí Y bậc 1 làm xanh quỳ ẩm. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 23:
Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3.
(b) Nung FeS2 trong không khí.
(c) Nhiệt phân KNO3.
(d) Cho dung dịch AgNO3 tác dụng với dung dịch Fe(NO3)2 dư.
(e) Cho Fe vào dung dịch CuSO4.
(g) Cho Zn vào dung dịch FeCl3 (dư).
(h) Cho Mg dư vào dung dịch FeCl3.
(i) Cho Ba vào dung dịch CuSO4 (dư).
(k) Dẫn khí CO (dư) qua bột CuO nóng.
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là
 Xem đáp án
Xem đáp án
Đáp án D
Trong các thí nghiệm trên, có 5 thí nghiệm sau khi các phản ứng thu được kim loại là (a), (d), (e), (h), (k).
Phương trình phản ứng:
Câu 24:
Điều chế NH3 từ hỗn hợp gồm N2 và H2 (tỉ lệ mol tương ứng là 1 : 3). Tỉ khối của hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9. Hiệu suất phản ứng là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 25:
Cho 30,8 gam hỗn hợp X gồm Fe, FeO, FeCO3, Mg, MgO và MgCO3 tác dụng vừa đủ với dung dịch H2SO4 loãng, thu được 7,84 lít (đktc) hỗn hợp khí Y gồm CO2, H2 và dung dịch Z chỉ chứa 60,4 gam hỗn hợp muối sunfat trung hòa. Tỉ khối của Y so với He là 6,5. Khối lượng của MgSO4 có trong dung dịch Z là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 26:
Cho m gam một axit cacboxylic X tác dụng với NaHCO3 dư, thu được 2,24 lít CO2 (đktc). Mặt khác, cũng m gam axit trên tác dụng với Ca(OH)2 dư, thu được 9,1 gam muối. Tên của X là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 27:
Hỗn hợp gồm phenyl axetat và metyl axetat có khối lượng 7,04 gam thủy phân trong NaOH dư, sau phản ứng thu được 9,22 gam hỗn hợp muối. Thành phần phần trăm theo khối lượng của phenyl axetat trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
Đáp án C
Câu 28:
Cho các phản ứng xảy ra theo sơ đồ sau:
Đốt cháy X2 trên ngọn lửa đèn khí không màu thấy xuất hiện ngọn lửa màu vàng tươi. X5 là chất nào dưới đây?
 Xem đáp án
Xem đáp án
Đáp án D
+ Đốt cháy X2 trên ngọn lửa đèn khí không màu thấy xuất hiện ngọn lửa màu vàng tươi, suy ra X2 là hợp chất của Na.
+ Điện phân dung dịch X1 thu được X2, khí X3 và khí H2 nên X2 là NaOH.
+ X2 phản ứng với Y1, suy ra Y1 có chứa ion phản ứng được với ion . Mặt khác, phản ứng tạo ra nước nên Y1 chứa ion
+ X2 tác dụng với Y1 theo tỉ lệ 1 : 1 hoặc 2 : 1. Suy ra X4 chứa ion còn X5 chứa ion
+ Vậy kết hợp với đáp án suy ra X5 là Na2CO3.
Câu 29:
Cho m gam glucozơ tác dụng với lượng dư dung dịch AgNO3/NH3 thu được 86,4 gam Ag. Nếu lên men hoàn toàn m gam glucozơ rồi cho khí CO2 thu được hấp thụ vào nước vôi trong dư thì lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 30:
Cho m gam) hỗn hợp (Na và Ba) vào nước dư, thu được V lít khí H2 (đktc) và dung dịch X. Hấp thu khí CO2 từ từ đến dư vào dung dịch X. Lượng kết tủa được thể hiện trên đồ thị như sau:
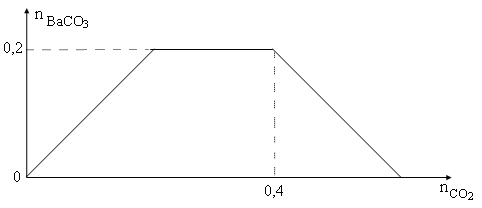
Giá trị của m và V lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
+ Căn cứ vào bản chất phản ứng và số liệu trên đồ thị, ta thấy lượng CO2 nhỏ nhất để tạo ra 0,2 mol BaCO3 là 0,2 mol.
Câu 31:
Điện phân nóng chảy hoàn toàn 5,96 gam MCln, thu được 0,04 mol Cl2. Kim loại M là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 32:
Cho 300 ml dung dịch gồm Ba(OH)2 0,5M và KOH x mol/lít vào 50 ml dung dịch Al2(SO4)3 1M. Sau khi kết thúc các phản ứng thu được 36,9 gam kết tủa. Giá trị của x là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 33:
Cho sơ đồ chuyển hoá sau:
C3H4O2 + NaOH ® X + Y
X + H2SO4 loãng ® Z + T
Biết Y và Z đều có phản ứng tráng gương. Hai chất Y, Z tương ứng là
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng:
Câu 34:
Cho tất cả các đồng phân đơn chức, mạch hở, có cùng công thức phân tử C2H4O2 lần lượt tác dụng với kim loại Na và các dung dịch NaOH, NaHCO3, AgNO3/NH3. Số phản ứng xảy ra là
 Xem đáp án
Xem đáp án
Đáp án C
C2H4O2 có hai đồng phân đơn chức, mạch hở là CH3COOH và HCOOCH3. Axit axetic phản ứng được với cả ba chất Na, NaOH, NaHCO3; metyl fomat phản ứng được với NaOH và AgNO3/NH3. Vậy số phản ứng xảy ra là 5.
Phương trình phản ứng :
Câu 35:
Thủy phân hết 0,05 mol hỗn hợp E gồm hai peptit mạch hở X (CxHyOzN3) và Y (CnHmO6Nt), thu được hỗn hợp gồm 0,07 mol glyxin và 0,12 mol alanin. Mặt khác, thủy phân hoàn toàn 0,1 mol Y trong dung dịch HCl dư, thu được m gam hỗn hợp muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 36:
X là este đơn chức; Y là este hai chức (X, Y đều mạch hở). Đốt cháy 21,2 gam hỗn hợp E chứa X, Y thu được x mol CO2 và y mol H2O với x = y + 0,52. Mặt khác, đun nóng 21,2 gam E cần dùng 240 ml dung dịch KOH 1M thu được một muối duy nhất và hỗn hợp F chứa 2 ancol đều no. Dẫn toàn bộ F qua bình đựng Na dư thấy khối lượng bình tăng 8,48 gam. Số nguyên tử H (hiđro) có trong este Y là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 37:
Thực hiện phản ứng nhiệt nhôm hỗn hợp X gồm Al và Fe2O3 trong điều kiện không có không khí thu được 28,92 gam hỗn hợp Y, nghiền nhỏ, trộn đều và chia hỗn hợp Y thành hai phần. Phần một tác dụng với dung dịch NaOH dư thu được 1,008 lít H2 (đktc) và 3,36 gam chất rắn không tan. Phần hai tan vừa hết trong 608 ml dung dịch HNO3 2,5M thu được 3,808 lít NO (đktc) và dung dịch Z chứa m gam hỗn hợp muối. Các phản ứng xảy ra hoàn toàn. Giá trị m gần giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Câu 38:
Điện phân 225 ml dung dịch AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 4,02A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 18,9 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 21,75 gam rắn T và khí NO (sản phẩm khử duy nhất của N+5). Phát biểu nào sau đây sai?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 39:
Hòa tan hoàn toàn 8,6 gam hỗn hợp Al, Mg, Fe, Zn vào 100 gam dung dịch gồm KNO3 1M và H2SO4 2M, thu được dung dịch X chứa 43,25 gam muối trung hòa và hỗn hợp khí Y (trong đó H2 chiếm 4% khối lượng Y). Cho một lượng KOH vào X, thu được dung dịch chỉ chứa một chất tan và kết tủa Z (không có khí thoát ra). Nung Z trong không khí đến khối lượng không đổi được 12,6 gam chất rắn. Nồng độ phần trăm của FeSO4 trong X gần giá trị nào nhất sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Câu 40:
X, Y là 2 axit đơn chức cùng dãy đồng đẳng, T là este 2 chức tạo bởi X, Y với ancol no mạch hở Z. Đốt cháy 8,58 gam hỗn hợp E gồm X, Y, T thì thu được 7,168 lít CO2 và 5,22 gam H2O. Mặt khác, đun nóng 8,58 gam E với dung dịch AgNO3/NH3 dư thì thu được 17,28 gam Ag. Tính khối lượng chất rắn thu được khi cho 8,58 gam E phản ứng với 150 ml dung dịch NaOH 1M?
 Xem đáp án
Xem đáp án
Đáp án A
