Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P11)
-
3060 lượt thi
-
50 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Trong phòng thí nghiệm, người ta tiến hành thí nghiệm của kim loại Cu với HNO3 đặc. Biện pháp xử lí tốt nhất để khí tạo thành khi thoát ra ngoài it gây ô nhi ễm môi trường nhất là
 Xem đáp án
Xem đáp án
Do khí thoát ra chủ yếu là NO2 nên dùng chất kiềm tẩm vào bông nút chặt ống nghiệm sẽ phản ứng với NO2
tạo muối, không thoát ra ngoài môi trường gây ô nhiễm.
=>A
Câu 2:
Cho a gam Na vào 160 ml dung dịch gồm Fe2(SO4)3 0,125M và Al2(SO4)3 0,25M. Tách kết tủa rồi nung đến khối lượng không đổi thì thu được 5,24 gam chất rắn. Giá trị a nào sau đây là phù hợp?
 Xem đáp án
Xem đáp án
n Fe2(SO4)3 = 0,02 mol ; n Al2(SO4)3 = 0,04 mol
Chất rắn chắc chắn có Fe2O3 , có thể có Al2O3
=> n Fe2O3 = n Fe2(SO4)3 = 0,02 mol
=> nAl2O3 = 0,02 mol => n Al(OH)3 = 0,04 mol < n Al3+ .
Xét 2 TH:
+/ TH1: tạo kết tủa , kết tủa không tan
=> n NaOH = 3n Al(OH)3 + 6nFe3+ = 0,24 mol = n Na
=> a = 5,52g .Không có đáp án => Loại
+/TH2: kết tủa tan 1 phần:
=> n Al(OH)3 = 4nAl3+ - n NaOH => n NaOH = 0,28 mol
=> tổng số mol NaOH phản ứng là : 0,28 + 0,02.2.3 = 0,4 mol
=>a =9,2g
=>B
Câu 3:
Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Trộn 0,015 mol ancol no X với 0,02 mol ancol no Y rồi cho tác dụng hết với Na được 1,008 lít H2.
Thí nghiệm 2: Trộn 0,02 mol ancol X với 0,015 mol ancol Y rồi cho hợp tác dụng hết với Na được 0,952 lít H2.
Thí nghiệm 3: Đốt cháy hoàn toàn một lượng hỗn hợp ancol như trong thí nghiệm 1 rồi cho tất cả sản phẩm cháy đi qua bình đựng CaO mới nung, dư thấy khối lượng bình tăng thêm 6,21 gam. Biết thể tích các khi đo ở đktc. Công thức 2 ancol là
 Xem đáp án
Xem đáp án
+/TN1: n H2 = 0,045 mol => Do 2(nX +nY) < 2nH2 < 3(nX +nY)
=>trong hỗn hợp có 1 ancol 2 chức, 1 ancol 3 chức
Ta thấy X là 2 chức còn Y 3 chức Do ở TN2, số mol X tăng , Y giảm khiến số mol H2 giảm.
=> Chỉ có đáp án B thỏa mãn
=>B
Câu 4:
Cho các thí nghiệm sau :
- Cho dung dịch AlCl3 dư vào dung dịch NaOH
- Cho Ba kim loại vào dung dịch NH4HCO3
- Cho Zn vào dung dịch KOH dư
- Cho dung dịch NH4Cl vào dung dịch NaAlO2 (hay Na[Al(OH)4]
- Cho dung dịch Mg(HSO4)2 vào dung dịch BaCl2
Số thí nghiệm sau khi hoàn thành không có kết tủa là:
 Xem đáp án
Xem đáp án
Thí nghiệm không có kết tủa là:
Cho Zn vào KOH dư : Zn + 2KOH → K2ZnO2 + H2
=>A
Câu 5:
Nung 10,84 gam hỗn hợp X gồm 2 muối natri của 2 axit cacboxylic (một axit đơn chức và một axit hai chức) với NaOH dư thu được 2,24 lít khí metan (đktc). Hãy cho biết, nếu đốt cháy hoàn toàn hỗn hợp X bằng oxi thì thu được bao nhiêu gam Na2CO3?
 Xem đáp án
Xem đáp án
Do X + NaOH dư => CH4
=>X gồm CH3COONa và CH2(COONa)2 có số mol lần lượt là x và y mol
=> x + y = 0,1 mol
Và m X= 82x + 148y = 10,84
=>x= 0,06 mol ; y= 0,04 mol
=>Khi đốt X , theo bảo toàn Na
=> n Na2CO3 = 0,5(n CH3COONa + 2nCH2(COONa)2 ) = 0,07 mol
=>m Na2CO3 = 7,42g
=>C
Câu 6:
Hỗn hợp X gồm chất Y (C2H8N2O4) và chất Z (C5H10N2O3); trong đó, Y là muối của axit đa chức, Z là đipeptit mạch hở. Cho 33,2 gam X tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,3 mol khí. Mặt khác 33,2 gam X tác dụng với dung dịch HCl dư, thu được m gam chất hữu cơ. Giá trị của m là:
 Xem đáp án
Xem đáp án
Y là muối axit đa chức , X + NaOH tạo khí nên Y là muối của amoni hoặc amin khí vì Z là peptit nên không phản ứng tạo khí được
=>Y phải là: (COONH4)2
=> n khí = n NH3 = 2nY => n Y = 0,15 mol
=>n Z = 0,1 mol
=> Z + HCl → muối hữu cơ
Y + 2HCl → (COOH)2 + 2 NH4Cl
=> m chất hữu cơ = m axit oxalic + m muối hữu cơ
= m axit oxalic + m Z + m HCl phản ứng với Z
= 31,75g
=>D
Câu 7:
Cho các dãy chuyển hóa:
Glyxin X;
GlyxinY
Trong đó A, B là 2 chất vô cơ khác nhau. Các chất X và Y:
 Xem đáp án
Xem đáp án
H2NCH2COOH + HCl → ClH3NCH2COOH
H2NCH2COOH + NaOH → H2NCH2COONa + H2O
=>D
Câu 8:
Nhận xét nào đúng khi điện phân dung dịch chứa hỗn hợp HCl và H2SO4?
 Xem đáp án
Xem đáp án
Do chỉ có H+ và Cl- bị điện phân tạo H2 nên nồng độ H+ trong dung dịch giảm dần
=> pH dung dịch tăng lên. Sau đó khi nước bị điện phân thì dù số mol H+ vẫn không đổi nhưng nồng độ tăng do lượng nước giảm => pH tăng
=>D
Câu 9:
Dãy nào sau đây gồm các kim loại được sắp xếp theo chiều tăng dần về khả năng khử H2O?
 Xem đáp án
Xem đáp án
Dựa vào dãy điện hóa
=>B
Câu 10:
Cho dãy điện hóa sau có E0 tăng dần từ trái sang phải: Zn2+/Zn; Fe2+/Fe; Cu2+/Cu; Fe3+/Fe2+; Ag+/Ag. Phản ứng giữa cặp chất nào dưới đây có thể xảy ra:
 Xem đáp án
Xem đáp án
Dựa theo qui tắc anpha
=>C
Câu 11:
Để thu được poli(vinyl ancol): (-CH2-CH(OH)-)n người ta tiến hành :
 Xem đáp án
Xem đáp án
Đây là phương pháp điều chế poli(vinyl ancol)
=>B
Câu 12:
Hòa tan Fe3O4 trong dung dịch H2SO4 loãng, dư thu được dung dịch X. Dung dịch X tác dụng được với bao nhiêu chất trong các chất sau: Br2, H2S, KMnO4, NaNO3, BaCl2, NaOH, KI?
 Xem đáp án
Xem đáp án
Trong X có các ion : Fe2+ ; Fe3+ ; H+ ; SO42-
=> X phản ứng với tất cả các chất trong dãy
=>D
Câu 14:
Cho 2,236 gam hỗn hợp A dạng bột gồm Fe và Fe3O4 hòa tan hoàn toàn trong 100ml dung dịch HNO3 có nồng độ C (mol/l), có 246,4 ml khí NO (dktc) thoát ra. Sau phản ứng còn lại 0,448 gam kim loại. Trị số của C là:
 Xem đáp án
Xem đáp án
Sau phản ứng còn kim loại => Sản phẩm là Fe2+
=>Giả sử có x mol Fe và y mol O phản ứng
=> 56x + 16y = 2,236 – 0,448 = 1,788g
Các quá trình: +/ Cho e: Fe → Fe+2 + 2e
+/ Nhận e : O + 2e → O-2
N+5 +3e → N+2
=> n e trao đổi = 2x = 2y + 0,011.3
=>x= 0,0285 mol ; y= 0,012 mol
=> số mol HNO3 = 2nFe2+ + n NO = 0,068 mol (Bảo toàn N)
=> C = 0,68M
=>B
Câu 15:
Khi điều chế C2H4 từ C2H5OH và H2SO4 đặc ở 1700C thì thu được khí C2H4 có lẫn CO2 và SO2 .Nếu cho hỗn hợp khí đi qua các dung dịch : KMnO4, Ca(OH)2, KHCO3, Br2, NaOH thì số dung dịch có thể dùng để loại bỏ CO2 và SO2 đi được là:
 Xem đáp án
Xem đáp án
Để loại bỏ CO2 và SO2 thì cần chất chỉ phản ứng với 2 khí này tạo ra chất không ở thể khí để lọc tách được C2H4
=> Đó là: Ca(OH)2 ; NaOH
=>B
Câu 16:
Hợp chất hữu cơ X được điều chế từ metylbenzen theo sơ đồ
XYZ . CTCT của Z là
 Xem đáp án
Xem đáp án
Từ sơ đồ ta có:
X là C6H5COOH ; Y là m-NO2-C6H4-COOH
=> Z là m-NO2-C6H4-COOC2H5
=>B
Câu 17:
Thủy phân một este E trong dung dịch NaOH thu được một ancol no hai chức và một muối của axit hữu cơ đơn chức, có chứa một nối đôi. CTTQ của E:
 Xem đáp án
Xem đáp án
Do E + NaOH tạo ancol 2 chức và muối đơn chức
=> E có 4 Oxi .
muối hữu cơ có 1 nối đôi => muối của axit no đơn chức
=> trong E chỉ có 2 liên kết đôi ở 2 nhóm COO
=> CTTQ của E là: CnH2n-2O4
=>A
Câu 18:
Cho dãy các chất: phenol, anilin, phenylamoni clorua, natri phenolat, etanol. Số chất trong dãy phản ứng được với NaOH (trong dung dịch) là:
 Xem đáp án
Xem đáp án
Các chất đó là : phenol và phenylamoni clorua (C6H5NH3Cl)
=>B
Câu 19:
Cho dãy các chất và ion: Cu, S, Fe2+, FeO, SO2, N2, Mg2+, F2, O2-. Số chất và ion có cả tính oxi hóa và tính khử là
 Xem đáp án
Xem đáp án
Các chất và ion nếu có số oxi hóa trung gian giữa trạng thái có OXH thấp nhất va cao nhất của nguyên tố thì sẽ vừa có tính khử , vừa có tính OXH
=>Đó là: S ; Fe2+ ; FeO ; SO2 ; N2 => có 5 chất và ion
=>B
Câu 20:
Cho 1,288 gam hỗn hợp X gồm Ca, Al và Mg phản ứng hết với O2 dư thu được 2,344 gam hỗn hợp Y gồm 3 oxit. Cho Y phản ứng vừa đủ với V lít dung dịch HCl 1M. Giá trị của V là
 Xem đáp án
Xem đáp án
X +O2 → Y => Bảo toàn khối lượng => nO2 = 0,033 mol
Khi Y phản ứng với HCl thực chất là thay thế 1 mol O bằng 2 mol Cl theo bảo toàn điện tích
=> n HCl = 2n O = 4nO2 = 0,132 mol=>V= 0,132 l
=>B
Câu 21:
Cho m gam glucozơ và fructozơ tác dụng với lượng dư dd AgNO3/NH3 tạo ra 43,2 gam Ag. Cũng m gam hỗn hợp này tác dụng vừa hết với 8 gam Br2 trong dung dịch. Số mol glucozơ và fructozơ trong hỗn hợp này lần lượt là
 Xem đáp án
Xem đáp án
Chỉ có Glucose phản ứng với brom => n Glucose = n Br2 = 0,05 mol
=> 2n Glucose + 2nFructose = n Ag => n Fructose = 0,15 mol
=>B
Câu 22:
Cho 11,8 gam amin đơn chức bậc I X tác dụng vừa đủ với dung dịch HCl, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Làm bay hơi dung dịch Y được 19,1 gam muối khan. Số công thức cấu tạo ứng với công thức phân tử của X là
 Xem đáp án
Xem đáp án
Do amin X đơn chức bậc 1 => phản ứng với HCl tỉ lệ mol là 1:1
=> m HCl = m muối – m amin = 7,3g
=>n amin = n HCl = 0,2 mol
=>M amin = 59g => X là : C3H7NH2 có các CTCT là: C-C-C-NH2 ; (CH3)2-C-NH2
Có 2 CT thỏa mãn
=>B
Câu 23:
Cho hỗn hợp chứa a mol Fe tác dụng với dung dịch chứa b mol Cu2+ và c mol Ag+, đến phản ứng hoàn toàn thu được dung dịch A chứa 3 cation kim loại và chất rắn B . Cho dung dịch A tác dụng với dung dịch NaOH dư thu được kết tủa E. Nung E trong không khí đến khối lượng không đổi, thu được hỗn hợp chất rắn chứa hai chất. Điều kiện của a so với b, c là:
 Xem đáp án
Xem đáp án
E nung tạo 2 oxit , Mà A chứa 3 cation => E có 3 hidroxit
A chứa 3 cation => đó là : Fe2+ ;Fe3+;Cu2+. Các phản ứng : Fe + 2Ag+ → Fe2+ + 2Ag
Fe + Cu2+ → Fe2+ + Cu
Fe2+ + Ag+ → Fe3+ + Ag
Để thỏa mãn đề thì Fe2+ phải dư hơn so với Ag+
=> c/3 < a < c/2
=>B
Câu 24:
Hoà tan m(g) hỗn hợp X gồm Fe, FeS, FeS2 và S vào dung dịch HNO3 đặc, nóng thu được dung dịch Y (không chứa muối amoni) và 49,28 lít hỗn hợp khí NO, NO2 nặng 85,2 (g). Cho Ba(OH)2 dư vào Y, lấy kết tủa nung trong không khí đến khối lượng không đổi thu được 148,5 gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Qui đổi X về x mol Fe và y mol S
Các quá trình : +/Cho e: Fe → Fe+3 + 3e
S → S+6 + 6e
+/ Nhận e: N+5 + 3e → N+2
N+5 + 1e → N+4
Đặt n NO = a mol ; n NO2 = b mol
=> a + b = 2,2 mol
30a + 46b = 85,2
=>a= 1 mol ; b= 1,2 mol
=> n e trao đổi = 3x + 6y = 1.3 + 1,2 = 4,2 mol
Cho Ba(OH)2 dư vào Y => Fe(OH)3 và BaSO4
Nung => Fe2O3 và BaSO4
=>Bảo toàn nguyên tố : 80x + 233y = 148,5
=>x= 0,4 mol ; y = 0,5 mol
=> m= 38,4g
=>A
Câu 25:
Cho H2 và 1 olefin có thể tích bằng nhau qua Ni đun nóng ta được hỗn hợp A . Biết tỉ khối hơi của A đối với H2 là 23,2. Hiệu suất phản ứng hiđro hoá là 75%. Công thức phân tử olefin là
 Xem đáp án
Xem đáp án
Gọi CT của olefin là CnH2n có số mol là x
+/ CnH2n + H2 → CnH2n+2
Ban đầu x x
Phản ứng 0,75x 0,75x
Cân bằng 0,25x 0,25x 0,75x
=> n A = 1,25x mol
=>m A = 2.23,2 . 1,25x = m hỗn hợp đầu = 14nx + 2x
=>n= 4 => Olefin là C4H8
=>C
Câu 27:
Một dung dịch có chứa HCO3-; 0,2 mol Ca2+; 0,8 mol Na+; 0,1 mol Mg2+; 0,8 mol Cl-. Cô cạn cẩn thận dung dịch thì lượng muối khan thu được là:
 Xem đáp án
Xem đáp án
Cô cạn : 2HCO3- → + CO2 + H2O
Bảo toàn điện tích: n HCO3- = 0,6 mol => n CO32- = 0,3 mol
=> tạo 0,1 mol MgCO3 và 0,2 mol CaCO3
=> dung dịch còn 0,8 mol NaCl
=> m muối khan = m NaCl + m MgCO3 + m CaCO3 = 75,2g
=>A
Câu 28:
Trộn 13,6 gam phenyl axetat với 250 ml dung dịch NaOH 1M. Sau khi phản ứng xảy ra hòan toàn cô cạn dung dịch được m gam chất rắn khan. Giá trị của m là:
 Xem đáp án
Xem đáp án
n este = 0,1 mol
CH3COOC6H5 + 2NaOH → CH3COONa + C6H5ONa + H2O
=>n NaOH dư = 0,25 – 0,2 = 0,05 mol
=>m rắn = m NaOH + m CH3COONa + m C6H5ONa = 21,8g
=>D
Câu 29:
Tìm phát biểu đúng:
 Xem đáp án
Xem đáp án
Mọi este đều được điều chế từ phản ứng este hoá giữa axit và ancol
=> Sai. Este của phenol chỉ có thể tạo ra từ phenol phản ứng với anhidrit axit hoặc clorua axit
B. Mọi este của axit cacboxylic đều thuỷ phân trong dung dịch NaOH tạo ancol và muối natri.
=> Sai. Nếu gốc rượu có liên kết đôi đính vào C gắn với COO thì sẽ tạo andehit hoặc xeton
C. Mọi este hữu cơ no khi cháy đều tạo ra CO2 và H2O bằng nhau.
=> Sai. Chỉ este hữu cơ no đơn chức.
D. Xà phòng hóa mọi chất béo đều thu được glixerol và muối của axit béo.
=> Đúng
=> D
Câu 30:
Chỉ dùng các chất nào dưới đây để có thể phân biệt 2 đồng phân cấu tạo đồng chức có cùng CTPT C3H8O ?
 Xem đáp án
Xem đáp án
2 đồng phân là : n-C3H7OH và i-C3H7OH.
Khi OXH chúng bằng CuO tạo andehit và ceton , mà chỉ có andehit phản ứng tráng bạc tạo kết tủa bạc nên dùng phương pháp này có thể nhận biết 2 chất trên.
=>B
Câu 31:
Hợp chất mạch hở X có CTPT C2H4O2. Cho tất cả các đồng phân mạch hở của X tác dụng với Na, NaOH, AgNO3/NH3. Số phản ứng hóa học xảy ra:
 Xem đáp án
Xem đáp án
X có các đông phân mạch hở là: CH3COOH ; HCOOCH3 ; HO-CH2-CHO
=> chúng có thể phản ứng với các chất: Na (2 chất phản ứng) ; NaOH(2) ; AgNO3/NH3 (2)
=> có 6 phản ứng tổng cộng
=>D
Câu 32:
Khi thủy phân không hoàn toàn một peptit X (MX = 293) thu được hai peptit Y và Z. Biết 0,472 gam Y phản ứng vừa đủ với 18 ml dung dịch HCl 0,222 M đun nóng và 0,666 gam Z phản ứng vừa đủ với 14,7 ml dung dịch NaOH 1,6% (d = 1,022 gam/ml) đun nóng. Biết rằng khi thủy phân hoàn toàn X thu được hỗn hợp 3 amino axit là glyxin, alanin và phenyl alanin. Công thức cấu tạo của X là
 Xem đáp án
Xem đáp án
Do thủy phân X tạo sản phẩm gồm glyxin, alanin và phenyl alanin. Mà M X = 293g
=> X chỉ gồm 1 gốc Gly ; 1 gốc Ala ; 1 gốc Phe => Y và Z đều là đi peptit
=> Có n HCl = 0,003996 mol => n Y = 0,5n HCl = 0,001998 mol
=>M Y = 236g => Y là Ala-Phe hoặc Phe-Ala
=> Vậy chỉ có đáp án Ala-Phe-Gly thỏa mãn
=>A
Câu 33:
Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch hỗn hợp gồm a mol HCl và b mol AlCl3, kết quả thí nghiệm được biểu diễn trên đồ thị sau
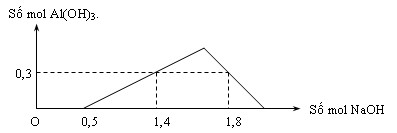
Tỉ lệ b : a là
 Xem đáp án
Xem đáp án
Tại n NaOH = 0,5 mol là lúc axit bị trung hóa hết => a = 0,5 mol
Tại n NaOH là 1,4 và 1,8 mol tạo cùng kết tủa => khi nhỏ 1,4 mol NaOH thì tạo kết tủa nhưng không bị hòa tan còn với 1,8 mol NaOH thì kết tủa bị tan 1 phần
=>n Al(OH)3 = 0,3 = 4b – (1,8-0,5) è b = 0,4 mol
=>a : b = 4 : 5
=>D
Câu 34:
Cho sơ đồ chuyển hóa:
Fe XYZFe(NO3)3
Các chất Y và T lần lượt là
 Xem đáp án
Xem đáp án
X là Fe3O4 => Y là Fe => Z là FeCl2 => Chỉ có AgNO3 hoặc HNO3 thỏa mãn trong 4 đáp án.
=> Cặp (Fe ; AgNO3)thỏa mãn
=>C
Câu 35:
Hai chất hữu cơ X, Y có cùng CTPT là C3H7NO2 , đều là chất rắn ở nhiệt độ thường . Chất X phản ứng với dd NaOH , giải phóng khí. Chất Y có phản ứng trùng ngưng. Các chất X và Y lần lượt là
 Xem đáp án
Xem đáp án
X + NaOH tạo khí => X là muối hữu cơ của amin khí hoặc amoni
=>X là CH2=CH-COONH4.
Y phản ứng trùng ngưng => Y phải có 2 nhóm chức phản ứng => Y là amino axit
=> Chỉ có cặp amoni acrylat và axit 2-aminopropionic thỏa mãn
=>B
Câu 36:
Cho m gam bột Mg vào 400ml dung dịch hỗn hợp gồm Fe(NO3)3 0,1M và H2SO4 0,75M. Đến phản ứng hoàn toàn thu được dung dịch A(không chứa muối amoni), 1,12 gam chất rắn B, khí C . Giá trị m là
 Xem đáp án
Xem đáp án
n H2SO4 = 0,3 mol ; n Fe(NO3)3 = 0,04 mol
Do sau phản ứng có chất rắn nên chắc chắn có các phản ứng sau:
3Mg + 8H+ + 2NO3- → 3Mg2+ + NO + H2O
Mg + 2H+ → Mg2+ + H2
Mg + 2Fe3+ → 2Fe2+ + Mg2+
Mg + Fe2+ → Mg2+ + Fe
Do m Fe3+ > m B => B chỉ gồm Fe
=> n Mg = 1,5n NO3- + 0,5n H+ dư + 0,5nFe3+ + n Fe2+ = 0,28 mol
=>m = 6,72g
=>A
Câu 37:
Xà phòng hoá 1kg lipit có chỉ số axit là 2,8 người ta cần dùng 350 ml KOH 1M. Khối lượng glixerol thu được là bao nhiêu?
 Xem đáp án
Xem đáp án
Chỉ số axit = 2,8 => n KOH phản ứng với gốc axit = 2,8/56 = 0,05 mol
=>n KOH phản ứng với gốc COO = 0,35 -0,05 = 0,3 mol
=> n Glixerol = 1/3 . n COO = 0,1 mol
=> m Glixerol = 9,2g
=>A
Câu 38:
Có các nhận định sau đây:
1)Nguyên tắc sản xuất gang là khử sắt bằng CO ở nhiệt độ cao.
2)Nguyên tắc sản xuất thép là khử các tạp chất trong gang.
3)Tính chất hóa học của Fe2+ là tính khử và tính oxi hóa.
4)Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+ Số nhận định đúng là
 Xem đáp án
Xem đáp án
1)Nguyên tắc sản xuất gang là khử sắt bằng CO ở nhiệt độ cao.
=> Sai. Phải là khử oxit sắt
2)Nguyên tắc sản xuất thép là khử các tạp chất trong gang.
=> Sai. Phải là oxi hóa các phi kim trong gang
3)Tính chất hóa học của Fe2+ là tính khử và tính oxi hóa.
=> Đúng
4)Nước cứng là nước có chứa nhiều ion Ca2+, Mg2+
=> Đúng
=>B
Câu 39:
Phần trăm khối lượng của nguyên tố nitơ trong lysin là
 Xem đáp án
Xem đáp án
CT của lysin là: H2N-(CH2)4-CH(NH2)-COOH
=>B
Câu 40:
Cho các phản ứng:
(1) Cu2O + Cu2S
(2) Cu(NO )2
(3) CuO + CO
(4) CuO + NH
(5) Cu(OH)
Số phản ứng tạo ra kim loại Cu là
 Xem đáp án
Xem đáp án
Các phản ứng tạo Cu là: (1); (3) ; (4)
Chú ý : (1) 2Cu2O + Cu2S → 6Cu + SO2
=>C
Câu 41:
Đốt cháy hoàn toàn 0,4 mol hỗn hợp X gồm ancol metylic, ancol etylic và ancol isopropylic rồi hấp thụ toàn bộ sản phẩm cháy vào nước vôi trong dư được 80 gam kết tủa. Thể tích oxi (đktc) tối thiểu cần dùng là:
 Xem đáp án
Xem đáp án
Do ta đốt cháy toàn ancol no nên n ancol = n H2O – nCO2
Mà nCO2 = n kết tủa = 0,8 mol => n H2O = 1,2 mol
=>Bảo toàn O => n O2 = 0,5.(2nCO2 + n H2O – n ancol) = 1,2 mol
=>V O2 = 26,88 l
=>A
Câu 42:
Cho 6,5 gam Zn vào dung dịch chứa hỗn hợp Cu(NO3)2 và H2SO4 (loãng). Sau một thời gian, Zn tan hoàn toàn, thu được khí X và dung dịch Y. Cô cạn Y được 20,1 gam hỗn hợp 2 muối khan. Xác định thể tích khí X (biết trong phản ứng N+5 chỉ bị khử về N+2, thể tích khí đo ở đktc).
 Xem đáp án
Xem đáp án
Do cô cạn Y chỉ có 2 muối khan nên giả thiết chúng là: CuSO4 và ZnSO4
=>n CuSO4 = 0,025 mol => n NO3- ban đầu = 0,05 mol
+/ 3Zn + 8H+ + 2NO3- → 3Zn2+ + 2NO + 4H2O
0,075 <= 0,05 => 0,05
=> Zn phản ứng tạo H2 => Y không còn ion NO3- => giả thiết đúng
=> n H2 = n Zn dư = 0,1 – 0,075 = 0,025 mol
=> V khí = V NO + V H2 = 1,68 l
=>B
Câu 43:
Nguyên nhân gây nên tính bazơ của amin là
 Xem đáp án
Xem đáp án
Do nguyên tử N còn cặp eletron tự do nên phân tử amin có thể nhận proton.
=>D
Câu 44:
Cho hôn hơp Na , Al vao nươc dư thu đươc 4,48 lit H2 (đktc) và dung dịch X chỉ chứa 1 chât tan. Sục CO2 dư vao dung dich X thi thu đươc bao nhiêu gam kêt tua ?
 Xem đáp án
Xem đáp án
X chỉ chứa 1 chất tan => đó là NaAlO2 => Al phản ứng vừa hết với NaOH
Na + H2O → NaOH + 0,5H2
NaOH + Al + H2O → NaAlO2 + 1,5H2
NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3
n H2 = 0,2 mol => n Na = 0,1 mol = n NaAlO2 = n Al(OH)3
=>m kết tủa = 7,8g
=>B
Câu 45:
Cho một dòng điện có cường độ không đổi đi qua 2 bình điện phân mắc nối tiếp. Bình 1 chứa 500 ml dung dịch CuSO4(điện cực trơ), bình 2 chứa 100 ml dung dịch hỗn hợp AgNO3 0,2M; Cu(NO3)2 0,3M, Fe(NO3)3 0,1M (điện cực trơ). Sau một thời gian ngắt dòng điện, thấy bình 1 có pH =1 và catot của bình 2 tăng thêm m gam. Biết thể tích dung dịch không thay đổi trong suốt quá trình điện phân. Giá trị của m là
 Xem đáp án
Xem đáp án
+/Bình 1: Tại Anot: 2H2O → 4H+ + O2 + 4e
Do pH = 1 => n H+ = 0,1.0,5 = 0,05 mol
Do 2 bình mắc nối tiếp nên I1 = I2 => số mol e trao đổi như nhau ở 2 bình
=> n e trao đổi = 0,05 mol
+/Bình 2: Tại Catot : Fe3+ + 1e → Fe2+ Ag+ + 1e → Ag Cu2+ + 2e → Cu
=> m = m Ag + m Cu = 108.0,02 + 64.0,01 =2,8g
=>D
Câu 46:
Cho sơ đồ phản ứng:
Xenlulozơ XYZT
Công thức của T là:
 Xem đáp án
Xem đáp án
X là C6H12O6 => Y là C2H5OH => Z là CH3COOH => Y là CH3COOC2H5
=>D
Câu 47:
Xét hai dãy chuyển hóa điều chế:
CH2=CH2 X1X2?
CH4Y1Y2?
Trong đó X2 và Y2 có thể trùng nhau. Hai dãy này dùng để sản xuất
 Xem đáp án
Xem đáp án
Cả 2 đều biểu thị quá trình sản xuất polime PVC
=>C
Câu 49:
Cho 3,6 gam bột Mg vào dung dịch chứa hỗn hợp gồm CuCl2 0,12 mol và FeCl3 0,02 mol. Sau khi phản ứng xảy ra hoàn toàn được chất rắn A . Khối lượng chất rắn A là:
 Xem đáp án
Xem đáp án
n Mg = 0,25 mol.
Phản ứng : Mg + 2FeCl3 → 2FeCl2 + MgCl2
Mg + CuCl2 → MgCl2 + Cu
Mg + FeCl2 → Fe + MgCl2
=> Sau phản ứng tạo 0,12 mol Cu và 0,02 mol Fe
=> m A = 8,8g
=>D
