Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết
Đề Ôn thi THPTQG 2019 Hóa Học cơ bản, nâng cao có lời giải chi tiết (P13)
-
3059 lượt thi
-
50 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Khi phân tích 1 mẫu nước tự nhiên thấy chứa các ion K+;Na+;HCO3-;SO42-. Mẫu nước ở trên thuộc loại:
 Xem đáp án
Xem đáp án
+ Nước cứng tạm thời (là loại nước cứng khi đun sôi thì mất tính cứng do muối hiđrocacbonat bị nhiệt
phân thành muối không tan). Tính cứng tạm thời do các muối Ca(HCO3)2 và Mg(HCO3)2 gây ra.
+ Nước cứng vĩnh cửu. Tính cứng vĩnh cửu của nước do các loại muối MgCl2, CaCl2, MgSO4, CaSO4 gây ra.
+ Nước cứng toàn phần là nước cứng có cả tính cứng tạm thời và tính cứng vĩnh cửu.
=> Chọn B
Câu 2:
Hòa tan hoàn toàn hỗn hợp Na,x mol Al, y mol Al2O3 vào nước thu được z mol khí và dung dịch chỉ chứa muối của natri. Biểu thức liên hệ giữa x,y,z là
 Xem đáp án
Xem đáp án
Do dung dịch chỉ chứa muối của natri => đó là NaAlO2 => nNa= nAl(muối)= x + 2y
=> phương trình xảy ra có tạo khí :
+ Na + H2O NaOH + ½ H2
+ NaOH + Al + H2ONaAlO2 + 3/2 H2
=> nH2 = z =0,5.(x + 2y) + 1,5x = 2x + y
=> Chọn C
Câu 3:
Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch a mol HCl và b mol AlCl3, kết quả có trên đồ thị:
Mối liên hệ giữa a và b là
 Xem đáp án
Xem đáp án
+ tại nOH- = 0,2 mol => Trung ḥa hết H+ => a= nOH- = = 0,2 mol
+ tại nOH- (1) = 0,5 mol => Al3+ dư
(cùng thu được lượng kết tủa )
nOH- (2) = 0,7 mol => OH- hòa tan 1 phần kết tủa.
=> n kết tủa = nOH- (1) = ( 4nAl3+ - nOH- (2) ) => b= 0,15 mol
=> 4b=3a
=> Chọn D
Câu 4:
Cây cao su là loại cây công nghiệp có giá trị kinh tế cao được đưa vào trồng. Chất lỏng thu được từ cây cao su gọi là mủ cao su là nguyên liệu để sản xuất cao su tự nhiên có tên gọi là
 Xem đáp án
Xem đáp án
=> Chọn C
Câu 5:
Alanin là 1 - amino axit có phân tử khối bằng 89, công thức của alanin là
 Xem đáp án
Xem đáp án
=> Chọn B
Câu 6:
Ion Pb2+ khi nhiễm độc vào cơ thể sẽ gây nguy hiểm tới sức khỏe và trí tuệ, nếu hàm lượng chì lớn hơn 100ppm thu đất bị ô nhiễm. Mẫu đất nào chưa bị ô nhiễm:
 Xem đáp án
Xem đáp án
=>Chọn B
Câu 7:
dung dịch nào sau đây làm quỳ tím chuyển xanh?
 Xem đáp án
Xem đáp án
Do amin béo có tính bazo mạnh
=> Chọn A
Câu 8:
Cho sơ đồ : Alanin XY (X,Y là chất hữu cơ, HCl dư). Công Thức Của Y là:
 Xem đáp án
Xem đáp án
Do X bị axit hóa tạo nên Y nên Y là axit, không phải muối và nhóm NH2 bị axit hóa thành NH3Cl => Chọn C
Câu 9:
Dung dịch Y gồm FeSO4 và CuSO4. Cho NH3 dư vào Y, lọc kết tủa đem nung trong khí đến khối lượng không đổi thu được chất rắn là
 Xem đáp án
Xem đáp án
Do Cu2+ tạo phức tan với NH3 nên kết tủa chỉ có Fe(OH)2. Sau khi nung trong không khí th́ bị oxi hóa thành Fe2O3
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O (nung trong không khí) => Chọn A
Câu 10:
Hòa tan hết 2,24 g Fe trong 120ml dung dịch HCl 1M bị loăng được dung dịch X. Cho AgNO3 dư vào X tạo m g kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
nFe= 0,04 mol ; nHCl = 0,12 mol
Fe + 2HCl → FeCl2 + H2
=> nFe2+ = 0,04 mol ; nHCl dư = 0,04 mol
Khi cho AgNO3 dư vào thu xảy ra phản ứng
Ag+ + Cl- → AgCl
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
Ag+ + Fe2+ → Fe3+ + Ag
m kết tủa = mAgCl + mAg = 0,12.143,5 + 108.0,01=18,30 g => Chọn D
Câu 11:
Hợp chất nào sau đây không tác dụng với NaOH:
 Xem đáp án
Xem đáp án
Do CrO3 là oxit axit, CrCl3 phản ứng tạo kết tủa
Cr(OH)3 Cr(OH)3 + NaOH → NaCrO2 + 2H2O
=> Chọn C
Câu 12:
Cho 100 ml dd amino axit 0,4M loăng tác dụng với 100g dd NaOH 2% (dư 25% so với lượng
phản ứng), thu được dd Y. Cô cạn Y thu được 5,4 g Chất rắn khan.Công thức của X:
 Xem đáp án
Xem đáp án
n amino axit = 0,04 mol ; nNaOH = 0,05 mol
=> nNaOH phản ứng = 0,05 : 1,25= 0,04 mol = n amino axit => amino axit có 1 nhóm COOH
m rắn = m muối + m NaOH dư => m muối = 5 g => m muối = 125g
Gọi CT amino axit là (H2N)x-R-COONa
=> 16x + R +67 = 125 => ta thấy chỉ có x= 2 ; R=42 (C3H6)
=> Chọn D
Câu 13:
Cho sơ đồ chuyển hóa trong dd Cr(OH)3 (X ,Y là hợp chất của Crom). X,Y lần lượt là
 Xem đáp án
Xem đáp án
Do Cr(OH)3 + NaOH → NaCrO2 + 2H2O
2CrO2- + 8OH- + 3Br2 → 2CrO42- + 6Br -+ 4H2O
=> Chọn D
Câu 14:
Hóa học là môn khoa học thực nghiệm ,thông qua thực hành chúng ta hiểu sâu kiến thức và gắn với thực tiễn . trong giờ thực hành, để tiết kiệm hóa chất vầ bảo vệ môi trường, chúng ta không nên:
 Xem đáp án
Xem đáp án
Lý thuyết thực hành SGK => Chọn C
Câu 15:
Thủy tinh hữu cơ plexiglas là loại chất dẻo rất bền ,trong suốt, cho ánh sáng truyến qua nên được dùng làm kính oto, máy bay . Nguyên liệu để chế tạo thủy tinh hữu cơ là:
 Xem đáp án
Xem đáp án
=> Chọn C
Câu 16:
Hai dung dịch nào sau đây khi tác dụng với NaOH loãng dư thu được kết tủa
 Xem đáp án
Xem đáp án
+ Ca(HCO3)2 + NaOH CaCO3 + Na2CO3 + H2O
+ FeCl2 + NaOH Fe(OH)2 + 2NaCl
=> Chọn B
Câu 17:
Đun nóng 5,6g hỗn hợp X gồm Al, Fe2O3 và FeO không có không khí thu được chất rắn Y , cho Y vào dung dịch HNO3 loăng thu được 2a mol NO là sản phẩm khử duy nhất. Nếu cho Y vào dung dịch NaOH dư thu được a mol H2 và 2,8g chất rắn. Biết các phản ứng xảy ra hoàn toàn, khối lượng Al trong X là :
 Xem đáp án
Xem đáp án
Do phản ứng nhiệt nhôm xảy ra hoàn toàn , mà Y + NaOH còn dư chất rắn và tạo khí nên Al dư, Y gồm Al;Al2O3 ; Fe
n Fe= 0,05 mol.
Khi cho Y vào HNO3 thì xảy ra quá tŕnh cho nhận e + Cho e: Al Al3+ + 3e
Fe Fe3+ + 3e
+ nhận e : N+5 N+2 +2e
Theo DLBT e có 3nAl + 3 nFe = 3nNO => nAl = 2a - 0,05
Khi cho Y vào NaOH thì nAl= 2/3 nH2 = 2/3 a
=> a=0,0375 mol => nAl= 0,025 mol
TheoDLBTKL mX =mY = 5,6g => mAl2O3 + mAl= mY - mFe => mAl2O3 = 2,125g
=> nAl ban đầu = nAl + 2nA2O3
=>mAl=1,8g => Chọn A
Câu 18:
hai chất nào sau đây không tác dụng với NaOH loãng nóng:
 Xem đáp án
Xem đáp án
Các amin không tác dụng với NaOH => Chọn B
Câu 19:
Tiến hành khử oxit kim loại bằng H2 dư theo sơ đồ sau:
Hình vẽ minh họa cho thí nghiệm với X là :
 Xem đáp án
Xem đáp án
Các oxit kim loại đứng sau Mg mới bị H2 khử => Chọn A
Câu 20:
hỗn hợp X gồm 2 peptit mạch hở có tỉ lệ mol tương ứng là 1:3. Thủy phân hoàn toàn m g X thu được sản phẩm gồm 10,5g glyxin và 8,9g alanin. Biết tổng số liên kết peptit trong phân tử 2 chất trong X là 4. Giá trị của m là:
 Xem đáp án
Xem đáp án
n Glyxin = 0,14 mol
n Alanin = 0,1 mol => n Glyxin : n Alanin = 7 : 5
Biết tổng số liên kết peptit trong phân tử 2 chất trong X là 4. => có 2 trường hợp là + 2 tripeptit
+ đipeptit và tetrapeptit
+ Ta xét trường hợp 2 tripeptit X và Y : chất X có 1 Gly và 2Ala ; chất Y có 2 Gly và 1 Ala Giả sử nX= x mol => nY = 3x mol
=> n Gly=7x mol ; nAla = 5x mol (TM) => x= 0,02 mol
=> m = mX + mY = 16,52g => Chọn C
Câu 21:
Kim loại Cu tác dụng với dung dịch HNO3 loăng theo phản ứng
Cu + HNO3 → Cu(NO3)2 + NO2 + 2H2O
Số mol HNO3 phản ứng gấy k lần số mol NO. Giá trị của k là
 Xem đáp án
Xem đáp án
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
=> Chọn D
Câu 22:
trong phản ứng tetrapeptit Ala-Gly-Val-Glu, axit đầu N là:
 Xem đáp án
Xem đáp án
amino axit đầu N nằm đầu tiên của chuỗi tính từ trái sang => Chọn B
Câu 23:
Dãy nào sau đây gồm các chất được sắp xếp theo chiều tăng dần tính bazo:
 Xem đáp án
Xem đáp án
Do Etylamin có -C2H5 đẩy e tăng lực bazo
Anilin có -C6H5 hút e giảm lực bazo amoniac không có nhóm thế
=> Chọn D
Câu 24:
khi không có không khí , 2 kim loại nào đều tác dụng với HCl trong dung dịch tỉ lệ mol bằng nhau:
 Xem đáp án
Xem đáp án
Do chỉ có cặp Fe, Mg cùng tạo muối hóa trị 2 => Chọn A
Câu 27:
Cho 4,2g bột Fe tác dụng với 250 ml dung dịch gồm AgNO3 0,2M và Cu(NO3)2 0,5M. Sau khi phản ứng hoàn toàn thu được m g chất rắn. Giá trị của m là:
 Xem đáp án
Xem đáp án
n Fe=0,075 mol ; nAgNO3 = 0,05 mol ; nCu(NO3)2= 0,125 mol
Do nAgNO3 < n Fe < 2 nAgNO3 nên chỉ xảy ra phản ứng
+ Fe + 2AgNO3 →Fe(NO3)2 + 2Ag
+ Fe + Cu(NO3)2 → Fe(NO3)2 + Cu (Fe hết)
m = mAg + mCu= 108.0,05 + 64. 0,05=8,6g => Chọn D
Câu 28:
Chất hữu cơ X chứa ṿng benzen có công thức CH3COOC6H4OH. Đun nóng a mol X tác dụng với tối đa bao nhiêu mol NaOH :
 Xem đáp án
Xem đáp án
CH3COOC6H4OH + NaOH CH3COONa + C6H4(OH)2
C6H4(OH)2 + 2NaOH C6H4(ONa)2 + 2H2O
nNaOH = 3a mol
=> Chọn B
Câu 29:
Thủy phân hoàn toàn 0,1 mol este đơn chức Y trong 145ml dung dịch NaOH 1M. Cô cạn dung dịch sau phản ứng được ancol etylic và 10 g chất rắn khan. Công thức cấu tạo của Y là:
 Xem đáp án
Xem đáp án
n NaOH= 0,145 mol. Do este đơn chức nên phản ứng theo tỉ lệ 1:1 => nNaOH dư = 0,045 mol .
Cô cạn dung dịch sau phản ứng được ancol etylic
=> Gọi CT este là RCOOC2H5 => tạo muối RCOONa
=> m rắn khan = 0,045.40 + 0,1. (R + 67)= 10 => R=15 (CH3) => Chọn D
Câu 30:
Đốt cháy hoàn toàn a mol triglixerit X thu được số mol CO2 nhiều hơn số mol H2O là 4a mol. Khi đun nóng có xúc tác Ni thu 0,025 mol X tác dụng với tối đa V lit khí H2 (dktc), giá trị của V là:
 Xem đáp án
Xem đáp án
Với 0,025 mol X thì nCO2 - nH2O= 0,1 mol = (Số liên kết pi-1). nX
Số liên kết pi = 5 => số liên kết pi trong gốc hidro cacbon= 5-3=2
=> nH2 = (số liên kết pi trong gốc hidro cacbon). nX=0,05 mol
=> VH2= 1,12 l
=> Chọn A
Câu 31:
Hai kim loại tác dụng mãnh liệt với nước ở điều kiện thường là:
 Xem đáp án
Xem đáp án
kim loại kiềm và kiềm thổ thích hợp mới có phản ứng này => Chọn C
Câu 32:
Chất X thường gọi là xoda rất quan trọng trong sản xuất thủy tinh, bột giặt... Ngoài ra dung dịch X dùng để tẩy sạch vết dầu mỡ bám trên chi tiết máy. X là:
 Xem đáp án
Xem đáp án
=> Chọn C
Câu 33:
trong dãy chất : tinh bột, xenlulozo, glucozo,fructozo, saccarozo. Số chất thuộc loại polisaccarit là
 Xem đáp án
Xem đáp án
Đó là tinh bột.xenlulozo. glucozo,fructozo là monosaccarit ; c̣n saccarozo là disaccarit => Chọn D
Câu 34:
Y là polisaccarit có trong thành phần tinh bột và cấu trúc mạch cabon không phân nhánh .Y là:
 Xem đáp án
Xem đáp án
Tinh bột gồm amilozo mạch thẳng và amilopectin mạch phân nhánh => Chọn C
Câu 35:
Cho dãy các ion kim loại sau đây: Na+; Al3+; Fe2+;Cu2+. ở cùng điều kiện, ion có tính oxi hoá mạnh nhất là
 Xem đáp án
Xem đáp án
Dựa theo dãy điện hóa => Chọn D
Câu 36:
Cho các chất sau : metyl acrylat, tristearin, saccarozo, Gly-Ala. Số chất bị thủy phân trong môi trường axit là:
 Xem đáp án
Xem đáp án
=> Chọn C
Câu 37:
Cho 5g hỗn hợp X gồm Al và Cu vào dung dịch H2SO4 loãng dư . Sau khi phản ứng hoàn toàn thu được 2,24l H2 (dktc). Phần trăm khối lượng Cu trong X là:
 Xem đáp án
Xem đáp án
Chỉ có Al tham gia phản ứng:
2Al + 3H2SO4 loãng → Al2(SO4)3 + 3H2
mAl=1,8 g => mCu = 3,2
=> %mCu= 64% => Chọn C
Câu 38:
Cho hỗn Hợp Fe(NO3)2 và ZnO vào dung dịch H2SO4 loãng dư. Thu được dung dịch Y. Cho NaOH dư vào y thu được kết tủa gồm
 Xem đáp án
Xem đáp án
Do khi cho vào axit thì có phản ứng
Fe2+ + H+ + NO3- Fe3+ + sản phẩm khử + H2O
=> tạo Fe(OH)3 và OH- hòa tan luôn cả Zn(OH)2 được tạo ra trước đó => Chọn A
Câu 39:
Phát biểu nào đúng? Saccarozo và glucozo đều:
 Xem đáp án
Xem đáp án
+Đều có tính chất của ancol đa chức
=> nAl =2/3 nH2= 1/15 mol =>
+Bị thủy phkn trong môi trường axit nóng
Sai, chỉ có Saccarozo Bị thủy phân
+Có khả năng tham gia phản ứng tráng bạc
Sai , chỉ có glucozo tham gia phản ứng tráng bạc +Có chứa liên kết glicozit trong phân tử
Sai, chỉ có glucozo chứa liên kết glicozit trong phân tử => Chọn A
Câu 40:
Hợp chất Y của Canxi là thành phần chính của vỏ các loại ốc,sò... Ngoài ra Y được sử dụng rộng rãi trong sản xuất vôi , xi măng , thủy tinh , chất phụ gia trong công nghiêp thực phẩm, Hợp chất Y là
 Xem đáp án
Xem đáp án
=> Chọn B
Câu 41:
Este Y có công thức phân tử C4H8O2 . Thủy phân hoàn toàn 6,6g Y trong 100g dung dịch NaOH 4,6%, cô cạn dung dịch sau phản ứng thu được chất rắn Z, nung nóng Z với CaO dư thu được 1,2g 1chất khí. Tên của Y là:
 Xem đáp án
Xem đáp án
Ta có sơ đồ quá trình như sau
Y muối hidrocacbon
=> chuyển hóa cuối c ng chính là phương pháp vôi tôi xút
n Y= 0,075 mol => n khí = 0,075 mol
=> M khí = 16g ( CH4). Y là CH3COOC2H5 : etylaxetat
=> Chọn C
Câu 42:
Hấp thụ hoàn toàn V lit khí CO2 dktc vào 1 l dung dịch Ba(OH)2 0,1M thu được 15,76g kết tủa, giá trị lớn nhất của V là:
 Xem đáp án
Xem đáp án
nOH- = 0,2 mol
để lượng CO2 hấp thụ vào lớn nhất thì xảy ra hiện tượng ḥa tan 1 phần kết tủa
Ba(OH)2 + CO2 BaCO3 + H2O
BaCO3 + CO2 + H2O Ba(HCO3)2
nCO2 = nOH- - nBaCO3 = 0,2 - 0,08= 0,12 mol
VCO2= 2,688 l
=> Chọn B
Câu 43:
Điện phân nóng chảy Al2O3 anot than chu %H=100% , cường độ dòng điện 150000A, thời gian 1 giờ thu được hỗn hợp khí X ở anot có tỉ khối so với H2 bằng 16. Lấy 2,24l X sục vào nước vôi trong dư được 2g kết tủa . khối lượng than chì bị đốt cháy ở anot gần nhất với giá trị nào nhất:
 Xem đáp án
Xem đáp án
2Al2O3 4Al+3O2
C+O2 CO2
2C+O2 2CO
X Giả Sử gồm CO,CO2,O2 dư
n e trao đổi = 5600 mol![]() => nO2 phản ứng = 0,25 n e =1400 mol ( Do 2O2- O2 + 4e)
=> nO2 phản ứng = 0,25 n e =1400 mol ( Do 2O2- O2 + 4e)
Trong 2,24l X Đặt nCO = x mol ; nO2 = y mol
Lấy 2,24l X sục vào nước vôi trong dư được 2g kết tủa .
=> nCO2= 0,02 mol => x + y = 0,08 mol
m X = . 0,1 = 3,2g => 28x + 32y = 2,32g
=> x= 0,02 mol ; y= 0,06 mol
=>nCO =nCO2
=> sau quá trunh điện phân ban đầu có
0,5 nCO + nCO2 = nO2 phản ứng =1400 mol
=> nCO =nCO2= 933,3 mol
=> mC= 12.( nCO +nCO2) = 22400g=22,4 kg
=> Chọn D
Câu 44:
Chất nào sau đây thuộc loại este no đơn chức mạch hở
 Xem đáp án
Xem đáp án
este no đơn chức mạch hở có dạng tổng quát là CnH2nO2 (n >1,nguyên)
=> Chọn C
Câu 45:
Để điều chế 29,7 kg xenlulozo trinitrat hiệu suất 80% cần dùng ít nhất V l dung dịch HNO3 63% (D- 1,5g/ml) phản ứng với xenlulozo dư, giá trị của V là
 Xem đáp án
Xem đáp án
C6H7O2(OH)3 + 3HONO2 → C6H7O2(NO3)3 + 3H2O
n HNO3 = 3n xenlulozo = 3. 29,7/ 297= 0,3 (kmol)
V lư thuyết= = 20 l
=> V thực tế = V lýthuyết . 100/80 =25 l
=> Chọn D
Câu 46:
Trong quá trình luyện gang, nhiên liệu X (không có sẵn trong tự nhiên, phải điều chế từ than đá) mới có vai trò cung cấp nhiệt khi cháy tạo ra chất khử CO để khử sắt thành gang, nhiên liệu X là:
 Xem đáp án
Xem đáp án
than cốc là 1 trong những nhiên liệu cho quá tŕnh luyện gang
=> Chọn B
Câu 47:
Dẫn hơi nước đi qua bột sắt nung nóng theo sơ đồ hình vẽ
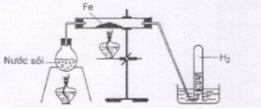
Ở nhiệt độ thấp hơn 570oC thì Fe bị nước oxi hóa thành:
 Xem đáp án
Xem đáp án
3Fe + 4H2O → Fe3O4 + 4H2 (< 5700C)
=> Chọn B
Câu 48:
Xà phòng hóa hoàn toàn a mol triolein trong dung dịch NaOH vừa đủ thu được a mol glycerol và
 Xem đáp án
Xem đáp án
=> Chọn A
Câu 49:
lên men m kg glucozo với hiệu suất cả quá trình 80% thu được 23 l etanol D= 0,8g/ml. Giá trị của m là
 Xem đáp án
Xem đáp án
C6H12O6 → 2C2H5OH + 2CO2
n etanol = = 400 mol
=> nGlucozo thực tế = 0,5n etanol : %H = 250 mol
=> mGlucozo = 45000g=45 kg
=> Chọn A
