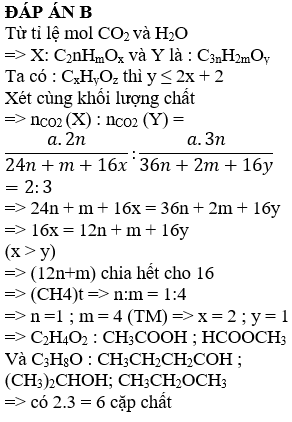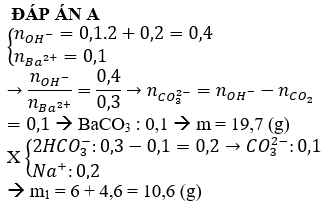15 đề Ôn luyện Hóa học cực hay có lời giải (Đề số 7)
-
3050 lượt thi
-
50 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Thuốc thử dùng để phân biệt các dung dịch riêng biệt, mất nhãn: NaCl, HCl, NaHSO4, Na2CO3 là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Khi dùng BaCl2 :
NaHSO4 : có kết tủa trắng không tan trong axit
Na2CO3 : Có kết tủa trắng tan trong axit
NaCl và HCl không có hiện tượng gì
Trộn từng đôi một các chất trong 2 nhóm có kết tủa và không có kết tủa
=> có sủi bọt khí => HCl và Na2CO3
Câu 2:
Chất nào trong các chất sau đây có lực bazơ lớn nhất
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Càng nhiều nhóm đẩy e đính vào N thì tính bazo càng mạnh
Câu 3:
Oxit nào sau đây tác dụng với H2O tạo hỗn hợp axit
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
CrO3 + H2O -> H2CrO4 và H2Cr2O7
Câu 5:
Cho từ từ dung dịch NH3 đến dư vào dung dịch chứa chất nào sau đây thì thu được kết tủa
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Câu 6:
Cho các phương trình phản ứng sau (X, Y, Z, T là ký hiệu của các chất):
X + NaOH Y+ Z
Y(R) + 2 NaOH(R) T + 2Na2CO3
C2H4 + T C2H6
Chất X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Từ phản ứng thứ 3 => T là H2
=> Phản ứng 2 sẽ có Y là (COONa)2 ( vì tỉ lệ mol Y : NaOH = 1 : 2)
=> X là HOOC-COONa vì tỉ lệ mol X : NaOH = 1 : 1
Câu 7:
Trong các gluxit: glucozơ, fructozơ, mantozơ, saccarozơ có bao nhiêu chất vừa có phản ứng tráng bạc vừa có khả năng làm mất màu nước brom
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Glucozo ; mantozo
Câu 8:
Cho các phát biểu:
(1) Protein bị thủy phân khi đun nóng với dung dịch axit, dung dịch bazơ hoặc nhờ xúc tác của enzim.
(2) Nhỏ vài giọt dung dịch axit nitric đặc vào ống nghiệp đựng dung dịch lòng trắng trứng (anbumin) thì có kết tủa vàng.
(3) Hemoglobin của máu là protein dạng hình cầu.
(4) Dung dịch protein có phản ứng màu biure.
(5) Protein đông tụ khi cho axit, bazơ hoặc khi đun nóng.
Số phát biểu đúng là :
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Câu 10:
Cho 8,8 gam CH3COOC2H5 tác dụng hết với 200 ml dung dịch NaOH 1,5M đun nóng. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
nCH3COOC2H5 = 0,1 mol ; nNaOH = 0,3 mol
=> sau phản ứng chất rắn gồm : 0,1 mol CH3COONa và 0,2 mol NaOH
=> m = 16,2g
Câu 12:
Trong nhóm halogen theo chiều tăng đần của điện tich hạt nhân từ flo đến iot thì
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Câu 13:
Cho cân bẳng hóa học ( trong bình kín) sau: N2(khí) + 3H2(khí) <-> 2NH3 ΔH= -92kJ/mol
Trong các yếu tố:
(1) Thêm một lượng N2 hoặc H2.
(2) Thêm một lượng NH3.
(3) Tăng nhiệt độ của phản ứng.
(4) Tăng áp suất của phản ứng.
(5) Dùng thêm chất xuc tác.
Có bao nhiêu yếu tố làm cho tỉ khối của hỗn hợp khí trong bình so với H2 tăng lên
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Tỉ khối hỗn hợp khí với H2 tăng => chứng tỏ số mol khí giảm (vì khối lượng không đổi)
=> phản ứng dịch theo chiều thuận
Các yếu tố thỏa mãn : (1) ; (4)
Câu 14:
Để sản xuất 10 lít C2H5OH 46° (d= 0,8 gam/ml) cần dùng bao nhiêu kg tinh bột biết hiệu suất của cả quá trình sản xuất là 80%?
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
VC2H5OH = 10.46/100 = 4,6 lit => mC2H5OH = 3680g = 3,68 kg
(C6H10O5)n -> 2nC2H5OH
162n 2n.46 (g)
6,48 <- 3,68 (kg)
Thực tế cần dùng : m = 6,48.100/80 = 8,1 kg
Câu 16:
Khử hoàn toàn một lượng Fe2O3 bằng CO ở nhiệt độ cao thu được m gam Fe và 6,72 lít CO2 ( ở đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Fe2O3 + 3CO -> 2Fe + 3CO2
=> nFe = 2/3nCO2 = 0,2 mol
=> m = 11,2g
Câu 17:
Hiđro hóa hoàn toàn 47,6gam anđehit acrylic bằng H2 dư (có Ni xúc tác, đun nóng) thu được m gam ancol. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
CH2=CH-CHO + 2H2 -> C2H7OH
=> nandehit = nancol = 0,85 mol
=> m = 51g
Câu 18:
Từ 3 α- amino axit: glyxin, alanin, valin có thể tạo ra mấy tripeptit mạch hở trong đó có đủ cả 3 α- amino axit
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Có các hoán vị : A – B – C
=> tại A có 3 cách chọn , tại B có 2 cách chọn , tại C có 1 cách chọn
(vì mỗi chất chỉ xuất hiện 1 lần trong peptit)
=> Số hoán vị = 3.2.1 = 6
Câu 19:
Hòa tan hoàn toàn 5,4 gam Al bằng dung dịch H2SO4 loãng, thu được V lít H2 (ở đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Bảo toàn e : 3nAl = 2nH2 => nH2 = 0,3 mol
=> V = 6,72 lit
Câu 21:
Điện phân dung dịch chứa 23,4 gam muối ăn ( với điện cực trơ, màng ngăn xốp), thu được 2,5 lít dung dịch có pH=13. Phần trăm muối ăn bị điện phân là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
pH = 13 > 7 => có OH-
, COH = 0,1M => nOH = 0,25 mol
Catot : 2H2O -> 2OH- + H2 – 2e
Anot : 2Cl- -> Cl2 + 2e
Bảo toàn e : nCl = nOH = 0,25 mol = nNaCl
=> %mNaCl đp = 62,5%
Câu 23:
Hợp chất X có các tính chất sau:
(1) Là chất có tính lưỡng tính.
(2) Bị phân hủy khi đun nóng.
(3) Tác dụng với dung dịch NaHSO4 cho sản phẩm có chất kết tủa và chất khí.
Vậy chất X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Chỉ Ba(HCO3)2 mới phản ứng với NaHSO4 cho kết tủa BaSO4 và khí CO2
Câu 25:
Trong các hợp kim sau đây, hợp kim nào khi tiếp xúc với dung dịch chất điện li thì sắt không bị ăn mòn điện hóa học
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Khi sắt là Catot thì sẽ không bị oxi hóa
Câu 26:
Cho 13,3 gam hỗn hợp gồm 3 amin no, đơn chức, mạch hở tác dụng vừa đủ với 300 ml dung dịch HCl xM, thu được dung dịch chứa 24,25 gam hỗn hợp muối. Giá trị của x là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
RNH2 + HCl -> RNH3Cl
Bảo toàn khối lượng : mHCl = mmuối - mamin
=> nHCl = 0,3x = 0,3 mol => x = 0,1 mol
Câu 27:
Hòa tan hoàn toàn 8,5 gam hỗn hợp gồm 2 kim loại kiềm X, Y (ở hai chu kì liên tiếp, MX < My) vào nước thu được 3,36 lít H2 (ở đktc). Phần trăm khối lượng của X trong hỗn hợp ban đầu là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
X + H2O -> XOH + ½ H2
=> nKL = 2nH2 = 0,3 mol
=> Mtb = 28,33 => X là Na : x mol và Y là K : y mol
=> 23x + 39y = 8,5 và x + y = 0,3
=> x = 0,2 ; y = 0,1 mol
=> %mNa(hh) = 54,12%
Câu 28:
Tiến hành các thí nghiệm:
(1) Cho khí NH3 tác dụng với CuO đun nóng.
(2) Sục khí O3 vào dung dịch KI.
(3) Cho Na vào dung dịch CuSO4.
(4) Đun nóng dung dịch bão hòa của NaNO2 và NH4Cl.
(5) Sục khí Cl2 vào H2S.
Số thí nghiệm tạo ra đơn chất là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
(1) N2 ; (2) O2 ; (3) H2 ; (4) N2
Câu 29:
Cho các chất: C2H5OH, CH3COOH; C2H2; C2H4. Có bao nhiêu chất sinh ra từ CH3CHO bằng một phản ứng
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
C2H5OH và CH3COOH
Câu 30:
Cho các chất Al, AlC3 , Zn(OH)2 , NH4HCO3, KHSO4 , NaHS, Fe(NO3)2. Số chất vừa phản ứng với dung dịch NaOH vừa phản ứng với dung dịch HCl là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Các chất : Al ; Zn(OH)2 ; NH4HCO3 ; NaHS ; Fe(NO3)2
Câu 31:
Nhiệt phân hoàn toàn hỗn hợp X gồm a mol KNO3và b mol Fe(NO3)2 trong bình chân không thu được chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào nước thì thu được dung dịch HNO3và không có khí thoát ra. Biểu thức liên hệ giữa a và b là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
KNO3 -> KNO2 + ½ O2
.a -> 0,5a
2Fe(NO3)2 -> Fe2O3 + 4NO2 + ½ O2
.b -> 2b -> 0,25b
4NO2 + O2 + 2H2O -> 4HNO3
Vì không có khí thoát ra => nNO2 = 4nO2
=> 2b = 4(0,5a + 0,25b)
=> b = 2a
Câu 32:
Hỗn hợp X gồm hai anđêhit Y và Z kế tiếp nhau trong dãy đồng đẳng, MY < MZ. Oxi hóa hoàn toàn 10,2 gam X thu được hỗn hợp hai axit cacboxylic no, đơn chức tương ứng. Để trung hòa hỗn hợp axit này cần vừa đủ 200 ml dung dịch NaOH 1M. Phần trăm khối lượng của Z trong X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Công thức trung bình : RCHO -> RCOOH
=> nRCHO = nRCOOH = nNaOH = 0,2 mol
=> MRCHO = R + 29 = 10,2/0,2 = 51
=> R = 22g
=> X có : CH3CHO : x mol và C2H5CHO : y mol
=> x + y = 0,2 và 44x + 58y = 10,2
=> x = y = 0,1 mol
=> %mZ(X) = 56,86%
Câu 33:
Cho 18 gam hỗn hợp X gồm R2CO3 và NaHCO3 (số mol bằng nhau) vào dung dịch chứa HCl dư, sau khi các phản ứng kết thúc thu được 4,48 lít CO2 (ở đktc). Mặt khác nung 9 gam X đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
nCO2 = nX = 0,2 mol => nR2CO3 = nNaHCO3 = 0,1 mol
=> mX = 0,1.(2R + 60) + 0,1.84 = 18g => R = 18g (NH4)
9g X có 0,05 mol (NH4)2CO3 và 0,05 mol NaHCO3
=> Nung thì chất rắn gồm 0,025 mol Na2CO3
=> mrắn = 2,65g
Câu 35:
Có các phát biểu sau:
1) Hợp chất hữu cơ nhất thiết phải có cacbon và hidro.
2) Các hidrocacbon thơm đều có công thức chung là CnH2n+6 với n ≥ 6.
3) Penta-1,3-đien có đồng phân hình học cis-trans.
4) Isobutan tác dụng với Cl2 chiếu sáng theo tỉ lệ mol 1 : 1 chỉ thu được 1 sản phẩm hữu cơ.
5) Hidrocacbon có công thức phân tử C4H8 có 5 đồng phân cấu tạo.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
(1) Sai vì chỉ nhất thiết có Cacbon (VD: CCl4)
(2) Sai vì CT chung là CnH2n-6
(4) Sai vì phản ứng tạo 2 sản phẩm
Câu 36:
Nung 20,8 gam hỗn hợp X gồm bột sắt và lưu huỳnh trong bình chân không thu được hỗn hợp Y. Cho toàn bộ Y tác dụng với dung dịch HCl dư, thu được m gam chất rắn không tan và 4,48 lít (ở đktc) hỗn hợp khí Z có tỉ khối so với H2 bằng 9. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Hỗn hợp khí gồm H2 và H2S với số mol lần lượt là x và y
Chất rắn là S
=> x + y = 0,2 mol và 2x + 34y = 3,6g
=> x = y = 0,1 mol
Fe + S -> FeS
Bảo toàn e : nFe bđ = nFe dư + nFeS = 0,2 mol
=> nS (bđ) = 0,3 mol
=> nS dư = 0,3 – 0,1 = 0,2 mol
=> m = 6,4g
Câu 38:
Có 5 hỗn hợp, mỗi hỗn hợp gồm 2 chất rắn có số mol bằng nhau: Na2O và Al2O3 ; Cu và Fe2(SO4)3 ; KHSO4 và KHCO3 ; BaCl2 và CuSO4 ; Fe(NO3)2 và AgNO3 . Số hỗn hợp có thể tan hoàn toàn trong nước (dư) chỉ tạo ra các chất tan trong nước là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
(Na2O và Al2O3) ; (Cu và Fe2(SO4)3)
Câu 40:
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố R có tổng số electron trong các phân lớp p là 10. Nhận xét nào sau đây không đúng
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
R có cấu hình lớp ngoài : 3s23p4 => R là lưu huỳnh (S)
Câu 43:
Đốt cháy hoàn toàn 4,03 gam triglixerit X bằng một lượng oxi vừa đủ, cho toàn bộ sản phẩm cháy hấp thụ hết vào bình đựng nước vôi trong dư thu được 25,5 gam kết tủa và khối lượng dung dịch thu được giảm 9,87 gam só với khối lượng nước vôi trong ban đầu. Mặt khác, khi thủy phân hoàn toàn 8,06 gam X trong dụng dịch NaOH (dư) đun nóng, thu được dung dịch chưa a gam muối. Giá trị của a là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Câu 45:
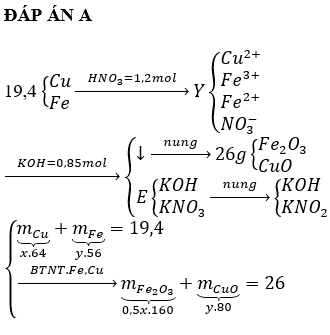
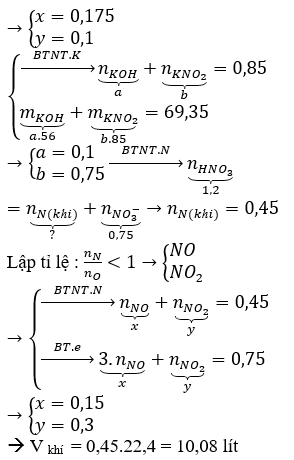
Hòa tan hoàn toàn 7,5 gam hỗn hợp gồm Mg và Al bằng lượng vừa đủ V lít dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 0,672 lít N2 (ở đktc) duy nhất và dung dịch chứa 54,9 gam muối. Giá trị của V là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Ta có : mmuối = mKL + mNO3 muối KL + mNH4NO3
54,9 = 7,5 + 62.(0,03.10 + 8nNH4+) + 80nNH4+
=> nNH4+ = 0,05 mol
=> nHNO3 = 12nN2 + 10nNH4+ = 0,86 mol
=> V = 0,86 lit