15 đề Ôn luyện Hóa học cực hay có lời giải (Đề số 10)
-
3051 lượt thi
-
50 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Đốt cháy hoàn toàn17,4 gam hỗn hợp Mg và Al trong khí oxi (dư) thu được 30,2 gam hỗn hợp oxit. Thể tích khí oxi (đo ở đktc) đã tham gia phản ứng là
 Xem đáp án
Xem đáp án
D. 8,96 lít
Câu 2:
Công thức đơn giản nhất của một hiđrocacbon là CnH2n+1. Hiđrocacbon đó thuộc dãy đồng đẳng của
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
CxHy có điều kiện tồn tại là y ≤ 2x + 2
Áp dụng với (CnH2n + 1)m => 2n.m + 1.m ≤ 2n.m + 2
=> m ≤ 2
+) Nếu m = 1 => CnH2n + 1 (L)
+)Nếu m = 2 => C2nH4n + 2 ( ankan)
Câu 5:
Este X không no, mạch hở, có tỉ khối hơi so với metan bằng 6,25 và khi tham gia phản ứng xà phòng hoá tạo ra một anđehit và một muối của axit hữu cơ. Có bao nhiêu công thức cấu tạo phù hợp với X
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
M=100; công thức dạng RCOOCH=CHR’ => R+R’=30;
Các chất: HCOOCH=CHC2H5; HCOOCH=C(CH3)2; CH3COOCH=CHCH3; C2H5COOCH=CH2
Câu 6:
Dung dịch X gồm HCl và H2SO4 có pH = 2. Để trung hòa hoàn toàn 0,59 gam hỗn hợp hai amin no, mạch hở, đơn chức bậc một (có số nguyên tử cacbon nhỏ hơn hoặc bằng 4) phải dùng 1 lít dung dịch X. Hai amin có thể là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
[H+]= 0,01= namin
M trung bình của 2 amin = 59 => Rtb = 43 => Rtb là C3H7;
=> loại đáp án B
Câu 7:
Cho 0,15 mol ancol X phản ứng với kim loại natri (dư) thì thu được 3,36 lít khí hiđro (đo ở đktc). Số nhóm chức ancol trong X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
, nH2 = 0,15 mol = nancol
Mà nH2 = ½ nOH(ancol) => ancol có 2 nhóm OH
Câu 8:
Cho các chất sau:
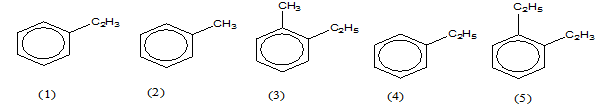
Có bao nhiêu chất là đồng đẳng của Benzen
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Các chất đồng đẳng của benzen có dạng CnH2n-6 gồm : (2) ; (3) ; (4)
Câu 9:
Khi cho 5,6 gam Fe tác dụng với 250 ml dung dịch AgNO3 1M thì sau khi phản ứng kết thúc thu được bao nhiêu gam chất rắn?
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
, nAgNO3 = 0,25 mol ; nFe = 0,1 mol
=> nAgNO3 / nFe = 2,5 => Phản ứng tạo Fe2+ và Fe3+
Fe + 2AgNO3 -> Fe(NO3)2 + 2Ag
Fe + 3AgNO3 -> Fe(NO3)3 + 3Ag
=> AgNO3 phản ứng hết => nAg = nAgNO3 = 0,25 mol
=> mrắn = mAg = 27g
Câu 10:
Một mẫu nước cứng có chứa các ion: Ca2+, Mg2+, HCO3-, Cl-, SO42-. Chất có khả năng làm mềm mẫu nước cứng trên là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Vì có cả HCO3- và Cl-, SO42- => đây là nước cứng toàn phần
Câu 11:
Cho các gluxit: mantozơ, glucozơ, fructozơ, saccarozơ, tinh bột và xenlulozơ. Có bao nhiêu chất vừa làm nhạt màu nước brom vừa có phản ứng tráng bạc
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Mantozo và Glucozo
Câu 12:
Cho dãy các chất sau: Al, NaHCO3, (NH4)2CO3, NH4Cl, Al2O3, Zn, K2CO3, K2SO4. Có bao nhiêu chất trong dãy vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch NaOH
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Al, NaHCO3, (NH4)2CO3, Al2O3, Zn
Câu 15:
Cho các cặp oxi hóa khử sau: Sn4+/Sn2+; Cu2+/Cu; Fe3+/Fe2+. Cho biết tính oxi hóa tăng dần theo thứ tự: Sn4+, Cu2+, Fe3+; tính khử giảm dần theo thứ tự: Sn2+, Cu, Fe2+. Dự đoán các phản ứng sau đây có xảy ra không
1. Cu + FeCl3
2. SnCl2 + FeCl3
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Áp dụng qui tắc anpha
Câu 16:
Anken thích hợp để điều chế 3-etylpentan-3-ol bằng phản ứng hiđrat hóa là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Ancol : 3 – etylpentan- 3 – ol : CH3 – CH2 – C(OH) – CH2 – CH3
|
CH2 – CH3
=> anken điều chế được ancol trên là : CH3 – CH = C – CH2 – CH3
|
CH2 – CH3
( 3 – etylpent- 2- en)
Câu 17:
Dẫn khí than ướt qua m gam hỗn hợp X gồm các chất Fe2O3, CuO, Fe3O4 (có số mol bằng nhau) đun nóng thu được 36 gam hỗn hợp chất rắn Y. Cho Y phản ứng hết với dung dịch HNO3 loãng dư thu được 11,2 lít khí NO (sản phẩm khử duy nhất đo ở đktc). Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Coi số mol mỗi oxit là a mol;
=> nFe = 5a, nCu= a, nO dư = b ;
=> mX = 344a + 16b = 36;
Bảo toàn e cho hỗn hợp 36 gam : 3nFe + 2nCu = 3nNO + 2nO dư
=> 15a + 2a = 2b + 3.0,3
=> a = 0,1; b = 0,1
=> m = 472.0,1 = 47,2 gam
Câu 18:
Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 cần dùng vừa đủ 2,24 lít H2 (đo ở đktc). Khối lượng Fe thu được là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Qui hỗn hợp về Fe và O
Chỉ có O phản ứng với H2 : O + H2 -> H2O
=> nO = nH2 = 0,1 mol
=> mFe = moxit – mO = 17,6 – 0,1.16 = 16g
Câu 19:
Có bao nhiêu hợp chất hữu cơ mạch hở có công thức phân tử C3HxO vừa phản ứng với H2 (xúc tác Ni, to), vừa phản ứng với dung dịch AgNO3 trong NH3 đun nóng
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Chất phải có liên kết 3 ở đầu mạch hoặc có nhóm CHO;
TH1: x= 2; C3H2O; CH º C-CHO
TH2: x=4; C3H4O; (k=2) CH2=CH-CHO; CHºC-OCH3; CHºC-CH2OH
TH3: x=6; C3H6O; C2H5CHO;
Câu 20:
Thực hiện các thí nghiệm sau:
(1) Sục khí SO2 vào dung dịch KMnO4.
(2) Sục khí Cl2 vào dung dịch H2S.
(3) Sục hỗn hợp khí thu được khi nhiệt phân Cu(NO3)2 vào nước.
(4) Cho Na2CO3 vào dung dịch AlCl3.
(5) Cho HCl vào dung dịch Fe(NO3)2.
(6) Cho Fe2O3 vào dung dịch HI.
Số thí nghiệm có phản ứng oxi hóa khử xảy ra là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Chỉ có phản ứng (4) không phải là phản ứng oxi hóa khử
Câu 21:
Sục khí clo dư vào dung dịch chứa muối NaBr và KBr thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Thể tích khí clo đã tham gia phản ứng với 2 muối trên (đo ở đktc) là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Tổng quát : MBr -> MCl
Mol x -> x
=> mtrước – msau = (80 – 35,5)x = 4,45g => x = 0,1 mol
=> nCl2 = ½ nMCl = 0,05 mol
=> VCl2 = 1,12 lit
Câu 23:
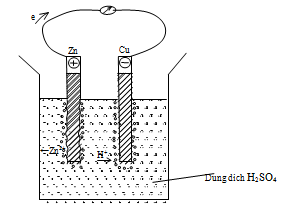
Hình vẽ sau do một học sinh vẽ để mô tả lại thí nghiệm ăn mòn điện hóa học khi cắm hai lá Cu và Zn (được nối với nhau bằng một dây dẫn) vào dung dịch H2SO4 loãng:
Trong hình vẽ bên chi tiết nào chưa đúng
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Kim loại có tính khử mạnh hơn luôn là cực âm và nó bị ăn mòn
=> Zn là cực âm và Cu là cực dương
Câu 24:
Hệ số trùng hợp của tơ nilon-6,6 (M = 2500 đvC) và tơ capron (M = 15000 đvC) lần lượt là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Nilon-6,6 là (-HN-[CH2]6-NH-OC-[CH2]4-CO-)n có Mmắt xích = 226
Capron là (-HN-[CH2]5-CO)n có Mmắt xích = 113
Câu 25:
Chất rắn X màu đỏ thẫm tan trong nước thành dung dịch màu vàng. Một số chất như S, P, C, C2H5OH… bốc cháy khi tiếp xúc với X. Chất X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Câu 26:
Cho các bước để tiến hành thí nghiệm tráng bạc bằng andehit fomic:
(1). Nhỏ tiếp 3-5 giọt dung dịch HCHO vào ống nghiệm.
(2). Nhỏ từ từ từng giọt dung dịch NH3 2M cho đến khi kết tủa sinh ra bị hòa tan hết.
(3). Đun nóng nhẹ hỗn hợp ở 60 -70 oC trong vài phút.
(4). Cho 1 ml AgNO3 1% vào ống nghiệm sạch.
Thứ tự tiến hành đúng là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Câu 27:
Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn, đem làm khô. Muối nào được tạo thành và khối lượng muối khan thu được là bao nhiêu
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
nNaOH = 1,1 mol ; nH3PO4 = 0,4 mol
=> nNaOH : nH3PO4 = 2,75
Xảy ra 2 phản ứng :
3NaOH + H3PO4 -> Na3PO4 + 3H2O
. 3x <- x -> x
2NaOH + H3PO4 -> Na2HPO4 + 2H2O
. 2y <- y -> y
=> 3x + 2y = 1,1 và x + y = 0,4
=> x = 0,3 ; y = 0,1 mol
=> Muối gồm : 14,2g Na2HPO4 và 49,2g Na3PO4
Câu 28:
Cho 44 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Sau khi phản ứng xảy ra hoàn toàn, đem làm khô. Muối nào được tạo thành và khối lượng muối khan thu được là bao nhiêu
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
nNaOH = 1,1 mol ; nH3PO4 = 0,4 mol
=> nNaOH : nH3PO4 = 2,75
Xảy ra 2 phản ứng :
3NaOH + H3PO4 -> Na3PO4 + 3H2O
. 3x <- x -> x
2NaOH + H3PO4 -> Na2HPO4 + 2H2O
. 2y <- y -> y
=> 3x + 2y = 1,1 và x + y = 0,4
=> x = 0,3 ; y = 0,1 mol
=> Muối gồm : 14,2g Na2HPO4 và 49,2g Na3PO4
Câu 29:
Thủy phân 5,13 gam mantozơ trong môi trường axit với hiệu suất 35%, sau đó tiến hành phản ứng tráng bạc (hiệu suất 100%) đối với dung dịch sau phản ứng thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
nmantozo = 0,015 mol
Mantozo -> 2Glucozo
=> nGlucozo = 2nmantozo pứ = 2.0,015.35% = 0,105 mol và nmantozo dư = 0,00975 mol
=> nAg = 2nmantozo dư + 2nGlucozo = 0,0405 mol
=> mAg = 4,374g
Câu 30:
Ion M3+ có cấu hình electron phân lớp ngoài cùng là 3d3. Phát biểu nào sau đây không đúng
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Cấu hình e của nguyên tử M là : [Ar] 3d54s1
Câu 31:
Cho các polime: polietilen (1); poli (metyl metacrylat) (2); polibutađien (3); polistiren (4); poli (vinyl axetat) (5); tơ nilon – 6,6 (6). Trong các polime trên, những polime có thể bị thủy phân cả trong dung dịch axit và dung dịch kiềm là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Câu 32:
Đốt cháy este 2 chức mạch hở (X được tạo từ axit cacboxylic no, đa chức) thu được tổng thể tích CO2 và H2O gấp 5/3 lần thể tích O2 cần dùng. Lấy 21,6 gam X tác dụng hoàn toàn với 400ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị lớn nhất của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Giải Gọi CTTQ este hai chức CxHyO4 CxHyO4 + (x+y/4-2)O2 x CO2 + y/2 H2O x + y/2 = 5/3.(x+y/4-2) => nghiệm đúng ( x = 6 ; y = 8) CTPT của este là C6H8O4
nX = 0,15 mol ; nNaOH = 0,4 mol số mol NaOH dư 0,1 mol CTCT : CH3OOC-CH2-COOCH=CH2 ; CH3OOC-COO-CH2CH=CH2 TH1 CH3OOC-CH2-COOCH=CH2 + 2NaOH
( NaOOC-CH2-COONa + CH3OH + CH3CHO 0,15 0,3 0,15 mrắn = 0,15.148 + 0,1.40 = 26,2 TH2 CH3OOC-COO-CH2CH=CH2 + 2NaOH
( NaOOC-COONa + CH3OH + CH2=CH-CH2OH 0,15 0,3 0,15 mrắn = 0,15.134 + 0,1.40 = 24,1
Câu 33:
Cho 3,48 gam bột Mg tan hết trong dung dịch hỗn hợp gồm HCl và KNO3, thu được dung dịch X chứa m gam muối và 0,56 lít (đo ở đktc) hỗn hợp khí Y gồm N2 và H2. Khí Y có tỉ khối so với H2 bằng 11,4. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Vì có khí H2 => ion NO3- hết
=> phương trình II
Giải bằng bảo toàn mol e phương trình ion nhanh hơn
Tính được mol N2 = 0,02, mol H2 = 0,005 mol Mg = 0,145
=> mol e nhường = 0,29
=> mol NH4+ = 0,01
2 NO3- + 10e + 12 H+ ----> N2 + 6 H2O
0,04-------0,2------0,24-------0,02
NO3- + 8e + 10 H+ ----> NH4+ + 3 H2O
0,01----0,08------0,1-------0,01
2 H+ + 2e ----> H2
0,01----0,01------0,005 mol
HCl = mol Cl- = mol H+ = 0,35 mol
KNO3 = mol K+ = mol NO3- = 0,05
muối gồm :
Mg2+ = 0,145 mol, NH4+ = 0,01 mol, K+ = 0,05 và mol Cl- = 0,35
khối lượng muối = 24.0,145 + 39.0,05 + 35,5.0,35 = 18,035
Câu 34:
Hỗn hợp X gồm nhiều ancol, andehit và axit cacboxylic đều mạch hở. Cho NaOH dư vào m gam X thấy có 0,2 mol NaOH phản ứng. Nếu cho Na dư vào m gam X thì thấy có 12,32 lít khí H2 (đo ở đktc) bay ra. Cho m gam X vào dung dịch AgNO3 trong NH3 dư thấy có 43,2 gam kết tủa xuất hiện. Mặt khác, đốt cháy hoàn toàn m gam X thu được 57,2 gam CO2. Biết các phản ứng xảy ra hoàn toàn, tổng số mol các ancol trong X là 0,4 mol, trong X không chứa HCHO và HCOOH. Giá trị đúng của m gần nhất với giá trị nào sau đây
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
- Coi hỗn hợp gồm COOH ; CHO và R(OH)n ; (phần C và H của axit và anđehit được dồn vào gốc R của ancol)
- nCOOH = 0,2 mol ; nCOOH + nOH = 2nH2 ;
=> nOH = 0,9 mol ; nCHO = 0,2 mol ; nC = 1,3 mol ; n ancol = 0,4 ; nC trong gốc R = 0,9 ;
- Ta nhận thấy nC trong gốc R =nOH
=> số nhóm –OH bằng số C ; coi ancol là hỗn hợp 2 chất C2H4(OH)2 x mol ; C3H5(OH)3 y mol
=> x + y = 0,4 ; 2x + 3y = ,9
=> x = 0,3 ; y = 0,1 mol
Vậy m = 0,2.45 + 0,2.29 + 0,3.62 + 0,1.92 = 42,6 gam
Câu 35:
Hỗn hợp M gồm một peptit mạch hở X và một peptit mạch hở Y (mỗi peptit được cấu tạo từ một loại α-aminoaxit, tổng số nhóm –CO–NH– trong 2 phân tử X, Y là 5) với tỉ lệ số mol nX : nY = 1 : 3. Khi thủy phân hoàn toàn m gam M thu được 81 gam glyxin và 42,72 gam alanin. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Câu 36:
Cho một hợp chất hữu cơ X có công thức C2H10N2O3. Cho 11 gam chất X tác dụng với một dung dịch có chứa 12 gam NaOH, đun nóng để các phản ứng xảy ra hoàn toàn thì thu được hỗn hợp Y gồm hai khí đều có khả năng làm đổi màu quỳ tím ẩm và dung dịch Z. Cô cạn Z thu được m gam chất rắn khan. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Câu 37:
Chất X là một aminoaxit thiên nhiên, mạch không nhánh, trong phân tử chỉ chứa một nhóm –NH2 và một nhóm –COOH. Cho 13,1 gam X tác dụng với dung dịch HCl dư, thu được 16,75 gam muối khan. Tên gọi của X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
X có dạng :
H2NRCOOH + HCl -> ClH3NRCOOH
(R + 61) (R + 97,5) (g)
13,1 16,75 (g)
=> R = 70g (C5H10)
Vì amino axit không phân nhánh => H2N-[CH2]5-COOH
Câu 38:
Hỗn hợp X chứa 4 hiđrocacbon đều ở thể khí có số nguyên tử cacbon lập thành cấp số cộng và có cùng số nguyên tử hiđro. Nung nóng 6,72 lít hỗn hợp E chứa X và H2 có mặt Ni làm xúc tác thu được hỗn hợp F có tỉ khối so với He bằng 9,5. Dẫn toàn bộ F qua bình đựng dung dịch Br2 dư thấy số mol Br2 phản ứng là a mol; đồng thời khối lượng bình tăng 3,68 gam. Khí thoát ra khỏi bình (hỗn hợp khí T) có thể tích là 1,792 lít chỉ chứa các hiđrocacbon. Đốt cháy toàn bộ T thu được 4,32 gam nước. Thể tích các khí đều đo ở đktc. Giá trị của a là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
4 chất là CH4, C2H4, C3H4, C4H4. a, b, c, d mol tương ứng
nT = 0,3 mol; MS = 38; mphần không no = 3,68 g; n phần no = 0,08 mol; nH2O = 0,24 mol;
nCO2 = 0,24 - 0,08 = 0,16 mol; m phần no = 0,16.12 + 2.0,24 = 2,4 g; mS = 3,68 + 2,4 =6,08;
=> nS = 6,08/38 = 0,16; nH2 ban đầu= nT - nS = 0,3 - 0,16 = 0,14 mol; nX = 0,16 mol;
mX = 6,08 - 0,14.2 = 5,8;
=> nC(trong X) = (5,8 - 0,16.4)/12 = 0,43 mol;
Bảo toàn C và tổng số mol:
a + 2b + 3c + 4d = 0,43;
a + b + c+ d = 0,16;
=>b + 2c + 3d = 0,27 = nH2 + nBr2
=> nBr2 = 0,13 mol
Câu 39:
Trong tự nhiên Agon có 3 loại đồng vị bền với tỉ lệ % nguyên tử là:
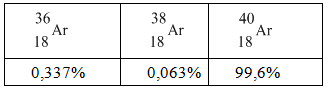
Cho rằng nguyên tử khối của các đồng vị trùng với số khối của chúng. Thể tích của 20gam Agon (đo ở đktc) bằng
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
nAr = x mol gồm có : 0,996x mol 40Ar ; 0,00337x mol 36Ar và 0,00063x mol 38Ar
=> mAr = 20g = 0,996x.40 + 0,00337x.36 + 0,00063x.38 = 20g
=> x = 0,5002 mol
=> VAr = 11,204 lit = 11,204 dm3
Câu 40:
Hòa tan hoàn toàn 9,95 gam hỗn hợp X gồm Na, K và Ba vào 100 ml dung dịch HCl 1M thu được dung dịch Y và 2,24 lít khí H2 (đo ở đktc). Cô cạn dung dịch Y thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
ĐÁP ÁN A
Tổng quát : M + xHCl -> MClx + 0,5xH2
=> nCl muối = nHCl = 2nH2 => nH2(HCl) = 0,05 mol < nH2 = 0,1 mol
=> Có phản ứng : M + xH2O -> M(OH)x + 0,5xH2
=> nOH = 2(nH2 – nH2(HCl)) = 0,1 mol
=> mrắn = mKL + mCl + mOH = 15,2g
Câu 41:
Hỗn hợp X gồm Al, Fe3O4 và CuO, trong đó oxi chiếm 25% khối lượng hỗn hợp. Cho 1,344 lít khí CO (đo ở đktc) đi qua m gam X nung nóng, sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng (dư), thu được dung dịch chứa 3,08m gam muối và 0,896 lít khí NO (là sản phẩm khử duy nhất đo ở đktc). Giá trị m gần nhất với giá trị nào sau đây
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
Ban đầu, mkl = 0,75m , mO = 0,25m .nCO bđ = 0,06 mol. MZ = 36g => có CO và CO2
Áp dụng qui tắc đường chéo ta có : nCO2 = nCO = 0,03
=> nO trong oxit đã bị lấy = 0,03
=> nO còn = 0,25m/16 – 0,03 nHNO3 pư = 2nO + 4nNO = 0,25m/8 + 0,1 Bảo toàn N: nNO3 tạo muối = nHNO3 – nNO = 0,25m/8 + 0,06 m muối = mkl + mNO3-
=>3,08m = 62.(0,25m/8 + 0,06) + 0,75m m = 9,48g
Câu 42:
Hợp chất hữu cơ X thuần chức (chỉ chứa C,H,O). Cho 5,8 gam X tác dụng với lượng dư dung dịch AgNO3 trong NH3 được 43,2 gam Ag. Hidro hóa hoàn toàn 0,1 mol X được chất Y. Toàn bộ Y phản ứng vừa hết 4,6 gam Natri. Đốt cháy hoàn toàn X thu được
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Xét chất Y : , nNa = 0,2 mol = 2nancol => Y có 2 nhóm OH => Y có tối đa 2 nhóm CHO
Xét chất X :
, nAg = 0,4 mol.
+) TH1 : Nếu là HCHO -> nHCHO = 0,193 mol => ¼ nAg (Loại)
+) TH2 : Nếu là RCHO -> nRCHO = ½ nAg = 0,2 mol => MRCHO = 29(Loại)
+) TH3 : Nếu là R(CHO)2 -> nR(CHO)2 = ¼ nAg = 0,1 mol => M = 58 => (CHO)2
Câu 43:
Điện phân (với điện cực trơ) 300 ml dung dịch Cu(NO3)2 nồng độ a mol/l, sau một thời gian thu được dung dịch Y vẫn còn màu xanh, có khối lượng giảm 72 gam so với dung dịch ban đầu. Cho 67,2 gam bột sắt vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 31,2 gam hỗn hợp kim loại. Biết NO là sản phẩm khử duy nhất của NO3-. Giá trị của a là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
nCu tạo ra = 2x; nO2 = x (bảo toàn e); 64.2x + 32x = 72;
=> x = 0,45 mol; nH+ = 4.nO2 = 1,8 mol; nCu2+ dư = y mol;
bảo toàn e: 2.nFe = 2y + 3.nNO ; nNO = 1/4.nH+ = 0,45 mol;
(1,2 - nFe).56 + 64y = 31,2; giải hệ
=> nFe phản ứng = 0,9; nCu2+ dư = y = 0,225 mol;
=> nCu2+ ban đầu = 0,9 + 0,225 = 1,125 mol;
=> a = 1,125/0,3 = 3,75 mol
Câu 44:
Ba dung dịch X, Y, Z thỏa mãn các điều kiện sau:
- X tác dụng với Y thì có kết tủa xuất hiện.
- Ytác dụng với Z thì có kết tủa xuất hiện.
- X tác dụng với Z thì có khí thoát ra .
X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
X + Z có khí thoát ra => chỉ có đáp án D thỏa mãn
Câu 45:
Thực hiện các thí nghiệm sau:
(1) Thả một viên Fe vào dung dịch HCl.
(2) Thả một viên Fe vào dung dịch Cu(NO3)2.
(3) Thả một viên Fe vào dung dịch FeCl3.
(4) Nối một dây Cu với một dây Fe rồi để trong không khí ẩm.
(5) Đốt một dây Fe trong bình kín chứa đầy khí O2.
(6) Thả một viên Fe vào dung dịch chứa đồng thời CuSO4 và H2SO4 loãng.
Trong các thí nghiệm trên, thí nghiệm mà Fe không bị ăn mòn điện hóa học là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Điều kiện ăn mòn điện hóa :
+) có 2 điện cực khác nhau về bản chất ( KL-KL ; KL-PK ...)
+) Cùng tiếp xúc với dung dịch chất điện ly
+) Tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn
Câu 46:
Khi thủy phân hết pentapeptit X (Gly-Ala-Val-Ala-Gly) thì thu được tối đa bao nhiêu sản phẩm chứa gốc glyxyl mà dung dịch của nó có phản ứng màu biure
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Chỉ có tripeptit trở lên mới có thể có phản ứng màu biure gồm :
Gly-Ala-Val ; Val-Ala-Gly
Gly-Ala-Val-Ala ; Ala-Val-Ala-Gly
Câu 47:
Dẫn hỗn hợp khí X gồm etilen và axetilen qua bình đựng dung dịch AgNO3 trong NH3 (dư) đến khi phản ứng xảy ra hoàn toàn thì thu được 28,8 gam kết tủa và thấy có 2,912 lít khí (đo ở đktc) thoát ra. Phần trăm khối lượng của axetilen trong X là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
Chỉ có C2H2 phản ứng tạo Ag2C2 => nkhí = nC2H4 = 0,13 mol
,nAg2C2 = nC2H2 = 0,12 mol
=> %mC2H2 = 46,15%
Câu 48:
Cho hơi nước qua than nung đỏ, sau khi làm khô hết hơi nước thu được hỗn hợp khí X (gồm CO, H2 và CO2) có tỉ khối của X so với H2 bằng 7,875. Cần bao nhiêu kg than có chứa 4% tạp chất trơ để thu được 960 m3 hỗn hợp khí X trên đo ở 1,64 atm và 127oC, biết rằng có 96% cacbon bị đốt cháy
 Xem đáp án
Xem đáp án
ĐÁP ÁN D
M = 15,75; nX = 48 kmol;
C + H2O -> CO + H2 C + 2H2O -> CO2 + 2H2
x--------------x------x y----------------y------2y kmol
Hỗn hợp X gồm x mol CO ; (x + 2y) mol H2 ; y mol CO2
Ta có : nX = 2x + 3y = 48; mX = 30x + 48y =756;
=> x = 6 ; y = 12;
=> m =18.12/(0,96.0,96) = 234,375 kg
Câu 49:
Đốt cháy hoàn toàn m gam hỗn hợp X gồm 2 ancol đa chức, mạch hở, thuộc cùng dãy đồng đẳng thu được 11,2 lít khí CO2 (đo ở đktc) và 12,6 gam H2O. Mặt khác, nếu cho m gam hỗn hợp X tác dụng với 10 gam Na thì sau phản ứng thu được a gam chất rắn. Giá trị của a và m lần lượt là
 Xem đáp án
Xem đáp án
ĐÁP ÁN B
nCO2 = 0,5 ; nH2O = 0,7; n ancol = 0,2 mol; số C = 2,5 => ancol là C2H4(OH)2;
m = mC + mH + mO = 0,5.12+1,4+0,4.16 = 13,8 ; nNa = 0,25 ; nH2 = ½ nOH = 0,2
Bảo toàn khối lượng : 13,8+ 10 = m chất rắn + 0,2.2 ;
=> m chất rắn = 23,4 gam
Câu 50:
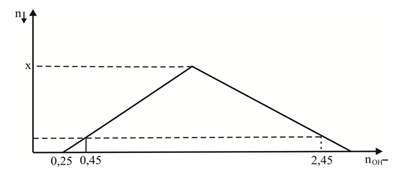
Nhỏ từ từ đến dư KOH vào dung dịch hỗn hợp gồm a mol HCl và x mol ZnSO4ta quan sát hiện tượng theo đồ thị hình bên (số liệu tính theo đơn vị mol). Giá trị của x (mol) là
 Xem đáp án
Xem đáp án
ĐÁP ÁN C
Tại nOH = 0,25 mol thì bắt đầu có kết tủa => Khi đó H+ trung hòa hết
=> a = 0,25 mol
Tại nOH = 0,45 mol thì có lượng kết tủa = với thời điểm nOH = 2,45 mol
+) nOH = 0,45 thì Zn2+ dư => nZn(OH)2 = ½ nOH = ½ (0,45 – 0,25) = 0,1 mol
+) nOH = 2,45 thì hòa tan kết tủa 1 phần : nZn(OH)2 = ½ [4nZn2+ - (nOH – nHCl) ]
=> nZn2+ = x = 0,6 mol
