25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề 4)
-
5244 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Thủy ngân (Hg) là chất lỏng ở điều kiện thường, được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác.
Câu 3:
 Xem đáp án
Xem đáp án
Câu 4:
 Xem đáp án
Xem đáp án
Đáp án B.
Một số chất béo thường gặp:
- Tripanmitin:
- Tristearin:
- Triolein:
- Triliolein:
Câu 5:
 Xem đáp án
Xem đáp án
Đáp án D.
có tính lưỡng tính nên vừa phản ứng với dung dịch vừa phản ứng với dung dịch HCl.
PTHH:
. .
Các chất vô cơ vừa tác dụng với dung dịch bazơ vừa tác dụng với axit:
- Một số kim loại: Al, Zn, Cr (lưu ý những kim loại này mặc dù vừa tác dụng với axit vừa tác dụng với dung dịch ba zơ nhưng không phải là chất lưỡng tính).
- Oxit lưỡng tính:
- Các hiđroxit lưỡng tính: .
- Một số muối chứa các ion lưỡng tính: .
- Một số muối: .
Câu 10:
 Xem đáp án
Xem đáp án
Phân loại polime:
- Polime thiên nhiên: xenlulozơ, tinh bột, tơ tằm, len...
- Polime tổng hợp: polietilen, poli(vinyl clorua), tơ nitron, nilon-6,6, nilon-6, nilon-7, tơ lapsan,…
- Polime bán tổng hợp (nhân tạo): tơ visco, tơ axetat, xenlulozơ trinitrat,...
Câu 11:
 Xem đáp án
Xem đáp án
Đáp án B.
Có 2 đồng phân bậc 1 :
(1)
(2)
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án B.
Kim loại đứng trước H trong dãy hoạt động hóa học phản ứng được với dung dịch HCl và loãng.
Câu 13:
 Xem đáp án
Xem đáp án
Đáp án C.
Những chất trong đó số oxi hóa của Fe là 0 và +2 thì có tính khử sẽ tham gia phản ứng oxi hóa khử với đưa Fe lên số oxi hóa cao nhất là +3.
Gồm các chất: .
Câu 14:
Hòa tan 4,68 gam kali vào 50 gam nước. Nồng độ phần trăm của dung dịch thu được là
 Xem đáp án
Xem đáp án
Đáp án B.
gam
.
Câu 15:
 Xem đáp án
Xem đáp án
Đáp án B.
Những chất tham gia phản ứng tráng bạc: glucozơ, anđehit fomic, anđehit axetic, axit fomic.
Những chất tác dụng với
- Ank-1-in (ankin có nối ba đầu mạch): phản ứng thế ion kim loại.
PTHH:
Riêng:
Hiện tượng: kết tủa vàng.
Những chất thường gặp: axetilen, propin, vinyl axetilen...
- Những chất có nhóm - CHO: anđehit, axit fomic, muối fomat, este của axit fomic, glucozơ ...
Hiện tượng: kết tủa bạc
Câu 16:
 Xem đáp án
Xem đáp án
Đáp án A
Glucozơ 2Ag nglucozơ (phản ứng) =75%.nglucozơ (đã dùng) =75%.0,06=0,045 mol
Câu 17:
 Xem đáp án
Xem đáp án
Đáp án A.
mmuối
Câu 20:
Cho các phát biểu sau:
(a) Tất cả cacbohiđrat đều có thể bị thủy phân.
(b) Glucozơ, fructozơ, saccarozơ đều tham gia phản ứng với .
(c) Glucozơ và fructozơ là đồng phân của nhau.
(d) Thủy phân tinh bột thu được glucozơ
Trong các phát biểu trên, số phát biểu đúng là.
 Xem đáp án
Xem đáp án
Đáp án C.
Những phát biểu đúng:
(a) sai vì glucozơ, fructozơ không bị thủy phân.
Câu 21:
 Xem đáp án
Xem đáp án
Đáp án A.
X là kim loại phản ứng được với dung dịch loãng nên có thể: Fe; Mg.
Y là kim loại tác dụng được với dung dịch nên Y có thể:
Vậy X, Y lần lượt là Fe, Cu.
Câu 22:
Số trieste khác nhau thu được tối đa từ hỗn hợp glixerol và axit stearic, axit oleic (có xúc tác ) là
 Xem đáp án
Xem đáp án
Đáp án C.
Số trieste khác nhau thu được tối đa từ hỗn hợp glixerol và 2 axit béo khác nhau:
Công thức tính nhanh số trieste tạo thành từ glixerol và axit béo khác nhau: .
Ví dụ: thì số trieste là:Câu 23:
 Xem đáp án
Xem đáp án
Đáp án B.
A sai vì tính axit của ancol yếu hơn phenol.
C sai vì toluen không thể tham gia phản ứng trùng hợp.
D sai vì trùng hợp isopren sẽ tạo ra cao su tổng hợp có gần giống với cao su thiên nhiên.
Câu 24:
Trường hợp nào dưới đây không có sự phù hợp giữa tên quặng sắt và công thức hợp chất chính có trong quặng?
 Xem đáp án
Xem đáp án
Đáp án A.
Manhetit chứa .
Câu 25:
Trộn 100 ml dung dịch với 200 ml dung dịch . Sau khi phản ứng kết thúc, khối lượng kết tủa thu được là
 Xem đáp án
Xem đáp án
Câu 26:
 Xem đáp án
Xem đáp án
Đáp án C
Vì nên
Este
gam.
Câu 27:
 Xem đáp án
Xem đáp án
Xà phòng hóa chất béo thu được muối của axit béo và glixerol.
Câu 28:
Chất dùng để làm khô khí ẩm là
 Xem đáp án
Xem đáp án
Đáp án B.
vừa có tính hút nước, vừa không tác dụng với nên được dùng để làm khô khí ẩm.
Nguyên tắc chọn chất làm khô khí:
- Chất có tính hút ẩm mạnh.
- Chất không hòa tan trong khí, không tác dụng với khí.
- Trong quá trình làm khô không sinh ra chất khí nào khác sẽ làm cho khí cần làm khô lẫn tạp chất.
Một số chất làm khô thường gặp:
- đặc: dùng làm khô khí: ;
không dùng làm khô khí: .
- : dùng làm khô khí: ;
không dùng làm khô khí: .
- CaO: dùng làm khô khí: ;
không dùng làm khô khí: .
- NaOH rắn khan: dùng làm khô khí: ;
không dùng làm khô khí: .
- khan: dùng làm khô khí: .
Câu 29:
Dẫn khí CO qua gam hỗn hợp X gồm . Sau phản ứng thu được m gam hỗn hợp rắn và 2,24 lít hỗn hợp khí Y có tỉ khối so với He là 9. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B.
Xem phản ứng giữa hỗn hợp X và CO là phản ứng CO lấy O của oxit.
BTKL:
Câu 30:
10 gam hỗn hợp X gồm metan, propen và axetilen làm mất màu 48 gam trong dung dịch. Mặt khác, 13,44 lít khí X (đktc) tác dụng vừa đủ với được 36 gam kết tủa. Thành phần phần trăm về khối lượng của metan có trong là
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 31:
 Xem đáp án
Xem đáp án
Đáp án C.
Dung dịch sau phản ứng chứa: Nước mềm.
Câu 32:
(a) Không nên dùng dầu, mỡ động thực vật để lâu trong không khí.
(b) Tơ là những vật liệu polime hình sợi dài, mảnh với độ bền nhất định.
(c) Chỉ có các monome chứa các liên kết bội mới có thể tham gia phản ứng trùng hợp tạo polime.
(d) Hầu hết các polime là những chất rắn, không bay hơi, có nhiệt độ nóng chảy xác định.
(e) Sự đông tụ và kết tủa protein xảy ra khi đun nóng hoặc cho axit, bazơ hay một số muối vào dung dịch protein.
(f) Cao su lưu hóa có tính đàn hồi, chịu nhiệt, lâu mòn, khó tan trong các dung môi hơn cao su thường.
Số phát biểu đúng là:
 Xem đáp án
Xem đáp án
Những phát biểu đúng: (a), (b), (e), (f).
(a) đúng vì dầu, mỡ động thực vật để lâu trong không khí dễ bị oxi hóa, vi khuẩn xâm nhập, có hại cho người sử dụng.
(c) sai vì các monome có vòng kém bền cũng có thể trùng hợp tạo polime như caprolactam trùng hợp tạo nilon - 6 .
(d) sai vì polime có nhiệt độ nóng chảy không xác định.
Câu 33:
Tỷ lệ có giá trị là
 Xem đáp án
Xem đáp án
Đáp án B.
Khi
Khi : Khối lượng catot vẫn tăng chứng tỏ vẫn chưa điện phân hết.
lúc này Fe( điện phân hết)
Khi thời gian : Có thể đã điện phân hết và ở catot đã điện phân.
Câu 34:
Hỗn hợp X gồm ba este đều no, mạch hở, trong phân tử chỉ chứa một loại nhóm chức. Đốt cháy hoàn toàn 35,34 gam cần dùng thu được 22,14 gam nước. Mặt khác đun nóng 35,34 gam X với dung dịch NaOH vừa đủ, thu được hỗn hợp Y chứa hai muối của hai axit có mạch không phân nhánh và 17,88 gam hỗn hợp Z gồm một ancol đơn chức và một ancol hai chức có cùng số nguyên tử cacbon. Phần trăm khối lượng của este đơn chức trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án C.
BTNT O:
BTKL:
Trong bài toán trên có áp dụng cách biện luận tìm ra 2 công thức 2 ancol là dựa vào số nhóm hiđroxyl biện luận khối lượng mol trung bình của 2 ancol, từ đó tìm được công thức của 2 ancol.
Có thể thấy, có nhiều cách biện luận tìm công thức, tùy theo dữ kiện từng bài mà áp dụng sao cho phù hợp.
Câu 35:
Hòa tan hoàn toàn m gam hỗn hợp X gồm Ba, BaO, Al và vào nước dư, thu được dung dịch Y và 5,6 lít (đktc). Nhỏ từ từ đến dư dung dịch HCl 1M vào dung dịch Y. Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo thể tích dung dịch HCl 1M như sau:
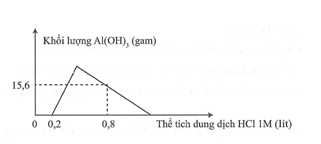
Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D.
Dựa vào đồ thị thấy một đoạn không có kết tủa chứng minh trong dung dịch Y còn
Câu 36:
Thí nghiệm 1 : Cho 5 giọt dung dịch và khoảng 1 ml dung dịch vào ống nghiệm. Lắc nhẹ, gạn bỏ lớp dung dịch giữ lại kết tủa Rót thêm 2 ml dung dịch glucozơ vào ống nghiệm chứa lắc nhẹ.
Thí nghiệm 2: Cho vào ống nghiệm 1 ml lòng trắng trứng 10% (protein), 1 ml dung dịch và 1 giọt dung dịch , Lắc nhẹ ống nghiệm.
Cho các phát biểu sau liên quan đến thí nghiệm trên:
(a) Ở thí nghiệm 1, có thể thay thế glucozơ bằng saccarozơ thì hiện tượng vẫn không đổi.
(b) Thí nghiệm 1 chứng tỏ glucozơ có chứa nhóm chức CHO.
(c) Kết thúc thí nghiệm 2, thu được sản phẩm có màu tím.
(d) Cả hai thí nghiệm đều xảy ra phản ứng oxi hoá - khử.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C.
Những phát biểu đúng: (a), (c).
(b) sai vì thí nghiệm 1 chứng tỏ glucozơ có nhiều nhóm chức OH liền kề.
(c) đúng. Đây là phản ứng màu biurê.
(d) sai.
Câu 37:
 Xem đáp án
Xem đáp án
Đáp án C.
BT H:
BT O:
Câu 38:
Cho X, Y là hai chất thuộc dãy đồng đẳng của axit acrylic ; cho Z là ancol có cùng số nguyên tử cacbon với X; T là este hai chức tạo bởi X, Y và Z. Đốt cháy hoàn toàn 11,16 gam hỗn hợp E gồm X; Y; Z; T cần vừa đủ 13,216 lít khí O2 (đktc), thu được khí CO2 và 9,36 . Mặt khác 11,16 gam E tác dụng tối đa với dung dịch chứa
 Xem đáp án
Xem đáp án
Đáp án C.
Xem hỗn hợp E gồm:
Đối với dạng bài toán hỗn hợp nhiều loại chất hữu cơ, thường áp dụng phương pháp quy đổi.
Nguyên tắc quy đổi có thể hiểu là quy về hỗn hợp chứa các chất đơn giản nhất tương ứng với loại chất hữu cơ, thêm - thể hiện đồng đẳng của chất hữu cơ đó, thêm H2 nếu chất hữu cơ đó không chắc là no hay không no.
Việc quy đổi như vậy làm việc tính toán trở nên đơn giản hơn nhiều.
Câu 39:
(a) Các nguyên tố ở nhóm IA đều là kim loại.
(b) Tính dẫn điện của kim loại giảm dần theo thứ tự: , Fe.
(c) Kim loại Na khử được ion trong dd thành Cu.
(d) Nhôm bị ăn mòn điện hóa khi cho vào dung dịch chứa và .
(e) Cho Fe vào dd AgNO3 dư, sau phản ứng thu được dung dịch chứa hai muối.
(g) Cho Mg vào dung dịch dư, sau phản ứng thu được Fe.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
(a) sai. Hiđro thuộc nhóm IA nhưng là phi kim.
(b) đúng.
(c) sai. Na khử trước.
(d) sai. Nhôm bị ăn mòn hóa học.
(e) đúng.
Sau phản ứng thu được dung dịch chứa và dư.
(g) sai.
