25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án
25 đề thi minh họa THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề 11)
-
5404 lượt thi
-
40 câu hỏi
-
90 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án A.
- Khối lượng riêng nhỏ nhất: Li, khối lượng riêng lớn nhất Os.
- Kim loại có khối lượng riêng nhỏ là kim loại nhẹ như:
- Kim loại có khối lượng riêng lớn là kim loại nặng như:
Câu 2:
 Xem đáp án
Xem đáp án
Đáp án C.
Quặng boxit có thành phần chính là Al2O3 . Điện phân nóng chảy thu được kim loại Al.
Câu 3:
 Xem đáp án
Xem đáp án
Đáp án B.
Lớp cặn đục đó là kết tủa CaCO3,MgCO3 . Để hòa tan kết tủa này, cần đun nóng với dung dịch giấm có thành phần chính là CH3COOH .
Câu 4:
Công thức phân tử của triolein là
 Xem đáp án
Xem đáp án
Đáp án A.
Công thức cấu tạo thu gọn của triolein là (C17H33COO)3C3H5 .
Câu 5:
Chọn phát biểu đúng trong các phát biểu sau?
 Xem đáp án
Xem đáp án
Đáp án C.
Thạch cao nung có công thức CaSO4.H2O , được dùng để đúc tượng, bó bột.
Thạch cao sống có công thức CaSO4.2H2O .
Thạch cao khan có công thức CaSO4 .
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án A.
Muối mononatri của axit glutamic: HOOC−CH2−CH2−CH(NH2)−COONa .
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án A.
2KNO3→2KNO2+O2.
Muối nitrat rất kém bền nhiệt nên dễ bị nhiệt phân tạo thành những sản phẩm khác nhau tùy thuộc vào kim loại trong muối.
- Kim loại đứng trước Mg trong dãy hoạt động hóa học (K, Na, Ba, Ca, Li) sản phẩm là muối nitrit và khí oxi.
Ví dụ: 2KNO3→2KNO2+O2
- Kim loại từ Mg đến Cu trong dãy hoạt động hóa học (Mg,Al,Zn,Fe,Pb,Cu): sản phẩm là oxit tương ứng, khí nitơ đioxit và khí oxi.
Ví dụ: 2Cu(NO3)2→2CuO+4NO2+O2.
Ngoại lệ: 4Fe(NO3)2→2Fe2O3+8NO2+O2.
- Kim loại đứng sau Cu trong dãy hoạt động hóa học (Ag,Au): sản phẩm là kim loại, khí nitơ đioxit và khí oxi.
Ví dụ: 2AgNO3→2Ag+2NO2+O2.
Câu 9:
Trùng hợp hiđrocacbon nào sau đây tạo ra polime dùng để sản xuất cao su buna?
 Xem đáp án
Xem đáp án
Đáp án D.
Trùng hợp buta-1,3-đien tạo thành polibutadien
nCH2=CH−CH=CH2t0,p,xt→( CH2−CH=CH−CH2)n
Câu 10:
Khí H2 không thể dùng làm chất khử để điều chế kim loại nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D.
Những kim loại đứng sau Al trong dãy hoạt động hóa học được điều chế bằng phương pháp nhiệt luyện. Chất khử thường được sử dụng là H2,CO,Al .
Câu 11:
Phát biều nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án A.
Tinh bột và xenlulozơ đều có công thức là (C6H10O5)n nhưng hệ số n là khác nhau, tức là số gốc glucozơ khi thủy phân tinh bột và xenlulozơ là khác nhau nên chúng không phải đồng phân của nhau.
Câu 12:
 Xem đáp án
Xem đáp án
Đáp án D.
C6H5OH+3Br2→C6H2Br3OH+3HBr
Câu 13:
Khử hoàn toàn 16 gam bột oxit sắt bằng CO ở nhiệt độ cao. Sau phản ứng khối lượng khí tăng thêm 4,8 gam. Công thức của oxit sắt và thề tích khí CO (đktc)?
 Xem đáp án
Xem đáp án
Đáp án C.
Xem phản ứng khử oxit kim loại là quá trình chất khử lấy O trong oxit.
Nên sau phản ứng khối lượng khí tăng thêm 4,8 gam chính là khối lượng O trong oxit mất đi. nO=0,3
Ta có:
nên oxit sắt là .
Câu 14:
Hòa tan hoàn toàn m gam bột Al trong dung dịch NaOH dư, sau phản ứng thu được 3,36 lít khí H2 (đktc). Giá trị của là
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 15:
 Xem đáp án
Xem đáp án
Các chất thủy phân trong dung dịch (dư), đun nóng sinh ra ancol: metyl axetat, etyl fomat, tripanmitin.
PTHH:
Câu 16:
Cho 11,25 gam glucozơ lên men rượu thoát ra 2,24 lít CO2 (đktc). Hiệu suất của quá trình lên men là
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 17:
Cho 9,97 gam hỗn hợp X gồm alanin và lysin tác dụng với dung dịch NaOH dư, thu được dung dịch chứa 11,73 gam muối. Mặc khác, 9,97 gam X trên phản ứng hoàn toàn với dung dịch HCl, thu được dung dịch Y chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A.
Ta có hệ phương trình:
gam
Câu 18:
Cho các chất: (T). Các chất đồng đẳng của nhau là
 Xem đáp án
Xem đáp án
Đáp án A.
Y và Z đều là đồng đẳng của ancol thơm, còn và là phenol.
Câu 19:
Cho các chất: (T). Các chất đồng đẳng của nhau là
 Xem đáp án
Xem đáp án
Đáp án C.
A sai vì
B sai vì
D sai vì
Câu 20:
 Xem đáp án
Xem đáp án
Đáp án A.
Điều kiện thường tinh bột làm dung dịch iot chuyển màu xanh tím, khi đun nóng màu xanh biến mất, để nguội màu xanh lại xuất hiện.
Câu 21:
Cho bột Cu dư vào dung dịch chứa hỗn hợp gồm và sau khi phản ứng kết thúc thu được chất rắn X. Thành phần của X là
 Xem đáp án
Xem đáp án
Đáp án B.
Thứ tự trong dãy điện hóa:
Vì Cu dư nên chất rắn X gồm Cu và Ag.
Thứ tự phản ứng:
Câu 22:
Số chất no, đơn chức, mạch hở có công thức phân tử tác dụng được với dung dịch NaOH là
 Xem đáp án
Xem đáp án
Đáp án C.
Các chất no, đơn chức, mạch hở có công thức phân tử , tác duïng được với dung dịch NaOH gồm axit và este:
Câu 23:
Trong công nghiệp chế tạo ruột phích, người ta thường sử dụng phản ứng hoá học nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D.
Glucozơ có thề tham gia tráng gương, vì nguyên liệu glucozơ rẻ, có nhiều trong tự nhiên, được sản xuất dễ dàng.
Câu 24:
Phát biểu nào dưới đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án A.
Crom là nguyên tố thuộc ô thứ 24, chu kỳ 4, nhóm , có cấu hình electron là .
Câu 25:
Khi nung 30 gam hỗn hợp CaCO3 và MgCO3 thì khối lượng chất rắn thu được sau phản ứng chỉ bằng một nửa khối lượng ban đầu và khí thu được có thể tích gần với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C.
Khối lượng chất rắn bằng một nửa khối lượng ban đầu nên khối lượng khí thoát ra cũng bằng một nửa khối lượng rắn ban đầu.
Câu 26:
Cho 0,08 mol este đơn chức, mạch hở phản ứng hoàn toàn với dung dịch chứa 0,12 mol MOH (M là kim loại kiềm). Cô cạn dung dịch sau phản ứng, thu được rắn Y và 3,68 gam ancol Z. Đốt cháy hoàn toàn Y, thu được và Tên gọi của là
 Xem đáp án
Xem đáp án
Đáp án D.
Số
Muối là
Vậy este là etyl axetat.
Câu 28:
X, Z, Y, T là một trong các dung dịch sau: .
Thực hiện thí nghiệm và thu được kết quả như sau:

Các dung dịch X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Đáp án D.
|
Chất |
KOH | |||
|
Dung dịch |
Không hiện tượng |
Câu 29:
Cho 20 gam hỗn hợp X gồm tan vừa hết trong 700 ml dung dịch HCl 1M thu được 3,36 lít H2 (đktc) và dung dịch D. Cho dung dịch D tác dụng với NaOH dư, lọc kết tủa và nung trong không khí đến khối lượng không đổi thu được chất rắn Y. Khối lượng Y là
 Xem đáp án
Xem đáp án
Đáp án D.
Những lưu ý của bài này để tránh nhầm lẫn:
- H+ đóng 2 vai trò: oxi hóa tạo H2 và kết hợp với ion O2- tạo H2O (tác dụng với oxit)
- Nung sắt (II) hiđroxit trong không khí thu được sắt (III) oxit.
Câu 30:
 Xem đáp án
Xem đáp án
Đáp án B.
.
Câu 31:
 Xem đáp án
Xem đáp án
Đáp án D.
Muốn thu được kết tủa trên để giá trị V là lớn nhất thì xảy ra cả phương trình (2) và (3), tức là kết tủa tạo thành tan tiếp 1 phần.
Câu 32:
Cho các phát biểu sau
(a) Các chất đều có khả năng phản ứng với axit HBr.
(b) Phản ứng thế brom vào vòng benzen của phenol dễ hơn của benzen.
(c) Thành phần của hợp chất hữu cơ nhất thiết phải có nguyên tố C và H.
(d) Các chất hữu cơ có khối lượng phân tử bằng nhau là các chất đồng phân với nhau.
(e) Các peptit đều tác dụng với trong môi trường kiềm tạo ra hợp chất có màu tím.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C.
Những phát biểu đúng: (a), (b).
(b) đúng. Do ảnh hưởng của nhóm OH nên phenol dễ tham gia phản ứng thế brom hơn benzen.
(c) sai. Thành phần của hợp chất hữu cơ nhất thiết phải có nguyên tố C. Ví dụ: .
(d) sai.
(e) sai. Peptit có từ 2 liên kết (tripeptit) trở lên mới tham gia phản ứng màu biurê.
Câu 33:
Điện phân 800 ml dung dịch gồm NaCl, HCl và 0,02M (điện cực trơ, màng ngăn xốp) với cường độ dòng điện 9,65 A. Mối liên hệ giữa thời gian điện phân và pH của dung dịch điện phân được biểu diễn bằng đồ thị dưới đây (giả sử muối đồng không bị thủy phân).
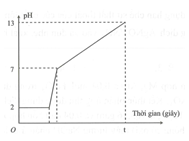
Giá trị của t trên đồ thị là
 Xem đáp án
Xem đáp án
Đáp án C.
Giai đoạn 1: pH = 2 và không đổi nên H+ chura điện phân và H2O ở cả 2 cực cũng chưa điện phân.
Giai đoạn 2: pH tăng đến 7 nên H+ dần điện phân hết, H2O ở cả 2 cực cũng chưa điện phân.
Giai đoạn 3: pH tăng đến 13 chứng tỏ H2O ở catot đã bắt đầu điện phân.
Lúc pH tăng đến 13 thì đồ thị dừng, chứng tỏ dung dịch sau chỉ chứa NaOH:
Lưu ý nhầm lẫn sau: Tính được thì nói chỉ điện phân ở catot là sai. Vì ở anot có thể bị điện phân thành và lượng đã bị trung hòa bởi .
Với cách nghĩ này dễ dẫn đến sai lầm tính
Câu 34:
X, Y, Z là 3 este đều đơn chức, mạch hở (trong đó Y và Z không no chứa một liên kết C = C và có tồn tại đồng phân hình học). Đốt cháy 21,62 gam hỗn hợp X, Y, Z chứa sản phẩm cháy dẫn qua dung dịch dư thấy khối lượng dung dịch giảm 34,5 gam. Mặt khác, đun nóng 21,62 gam E với 300 ml dung dịch NaOH 1M (vừa đủ), thu được hỗn hợp T chỉ chứa 2 muối và hỗn hợp gồm 2 ancol kế tiếp thuộc cùng dãy đồng đẳng. Khối lượng của muối có khối lượng phân tử lớn trong hỗn hợp T là
 Xem đáp án
Xem đáp án
Đáp án A.
BTKL:
Vậy có este có và chứa đồng phân hình học nên công thức cấu tạo là:
Vì hỗn hợp T gồm 2 muối nên este còn lại là:
Vậy hỗn hợp muốiCâu 35:
Nung nóng 40,8 gam hỗn hợp gồm Al và trong điều kiện không có không khí, sau 1 thời gian thu được hỗn hợp rắn X. Chia X làm 2 phần bằng nhau. Phần 1 cho vào dung dịch NaOH loãng dư, thấy thoát ra 4,032 lít H2. Phần 2 tác dụng với HNO3 loãng dư, thu được 0,16 mol khí NO duy nhất và dung dịch Y có chứa 97,68 gam muối. Giả sử trong phản ứng nhiệt nhôm, chỉ bị khử thành Fe. Khối lượng Fe tham gia phản ứng là
 Xem đáp án
Xem đáp án
BTKL:
(4)
Từ
Lưu ý đối với bài này:
- Phản ứng nhiệt nhôm xảy ra không hoàn toàn (sau một thời gian) nên sau khì dừng phản ứng các chất tham gia đều còn dư.
- Bài toán cho Al tác dụng với HNO3 lưu ý sự xuất hiện của .
Câu 36:
Tiến hành các thí nghiệm theo các bước sau:
Bước 1: Cho vào hai ống nghiệm mỗi ống 2ml vinyl axetat.
Bước 2: Thêm 2 ml dung dịch vào ống thứ nhất; 4 ml dung dịch vào ống thứ hai.
Bước 3: Lắc đều cả hai ống nghiệm, lắp ống sinh hàn, đun sôi nhẹ trong khoảng 5 phút, đề nguội.
Cho các phát biểu sau:
(a) Sau bước 2, chất lỏng trong ống thứ nhất phân lớp, chất lỏng trong ống thứ hai đồng nhất.
(b) Sau bước 3, chất lỏng trong cả hai ống nghiệm đều đồng nhất.
(c) Sau bước 3, sản phẩm phản ứng thủy phân trong cả hai ống nghiệm đều tan tốt trong nước.
(d) Ở bước 3, có thể thay việc đun sôi nhẹ bằng đun cách thủy (ngâm trong nước nóng).
(e) Ống sinh hàn có tác dụng hạn chế sự thất thoát của các chất lỏng trong ống nghiệm.
(f) Sau bước 3, nhỏ dung dịch vào và đun nhẹ, xuất hiện kết tủa Ag.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C.
Những phát biểu đúng:
(a) sai vì lúc này chưa xảy ra phản ứng ở cả hai ống nên vẫn phân lớp.
(b) sai. Ống 1 là este thủy phân trong môi trường axit là phản ứng thuận nghịch nên sau phản ứng còn este, vì vậy mà chất lỏng phân lớp. Trong ống 2, este thủy phân trong môi trường kiềm nên phản ứng một chiều, sau phản ứng chất lỏng đồng nhất.
(c) đúng vì sản phẩm gồm: tan tốt trong nước.
(f) tác dụng với thu được kết tủa Ag.
Câu 37:
Hòa tan hết hỗn hợp Mg, Al và trong dung dịch chứa 0,68 mol và a mol Kết thúc phản ứng thu được dung dịch X chứa các muối trung hòa của kim loại có khối lượng là 105,16 gam và 0,04 mol hỗn hợp khí . Cho dung dịch NaOH dư vào X (không có oxi) thấy lượng 105,16 phản ứng là 27,2 gam và lượng kết tủa tạo ra là 12,76 gam. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án C.
BTĐT:
Câu 38:
Hỗn hợp X gồm phenyl axetat, metyl benzoat, etyl axetat, điphenyl oxalat và glixerol triaxetat. Thủy phân hoàn toàn 44,28 gam X trong dung dịch NaOH (dư, đun nóng), có 0,5 mol NaOH phản ứng, thu được m gam hỗn hợp muối và 13,08 gam hỗn hợp Y gồm các ancol. Cho toàn bộ Y tác dụng với Na dư, thu được 2,688 lít H2. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B.
Nhận thấy bài toán trên hỗn hợp tham gia phản ứng gồm este của ancol và phenol nên việc quy hỗn hợp bài toán về hỗn hợp và áp dụng phương pháp bảo toàn khối lượng để giải quyết bài toán.
Câu 39:
Thực hiện các thí nghiệm sau:
(a) Sục khí Cl2 vào dung dịch NaOH ở nhiệt độ thường.
(b) Cho vào dung dịch HCl loãng (dư).
(c) Cho vào dung dịch đặc, nóng (dư).
(d) Hòa tan hết hỗn hợp Cu và (có số mol bằng nhau) vào dung dịch loãng, dư.
Trong các thí nghiệm trên, sau phản ứng, số thí nghiệm tạo ra hai muối là
 Xem đáp án
Xem đáp án
Đáp án D.
(a)
(b)
(c) đặc nóng
(d)
Có thể thấy phương trình (d) lạ, nhưng thực ra phương trình này thể hiện 2 quá trình:
Câu 40:
Hỗn hợp E gồm ba muối có cùng công thức phân tử là gam E phản ứng vừa đủ với 400 ml dung dịch NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được 5,6 lít (đktc) hỗn hợp khí F gồm hai amin đơn chức, kế tiếp nhau trong dãy đồng đẳng (có tỉ khối hơi so với hiđro là 18,3 ) và dung dịch G. Cô cạn dung dịch G thu được a gam hỗn hợp T gồm bốn muối (trong đó có ba muối có cùng số nguyên tử cacbon). Phần trăm khối lượng của muối có khối lượng mol lớn nhất trong T gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C.
Hai amin:
