Đề thi THPT Quốc gia môn Hóa học năm 2022 chọn lọc, có lời giải (20 đề)
Đề thi THPT Quốc gia môn Hóa học năm 2022 chọn lọc, có lời giải (Đề số 1)
-
25927 lượt thi
-
40 câu hỏi
-
50 phút
Danh sách câu hỏi
Câu 1:
Kim loại nào sau đây có thể dát thành lá mỏng đến mức ánh sáng có thể xuyên qua?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Vàng (Au) là kim loại dẻo nhất, có thể dát mỏng đến 1/20 micromet nên ánh sáng có thể đi qua được.
Câu 2:
Trong hợp chất, kim loại kiềm có số oxi hóa là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Kim loại kiềm thuộc nhóm IA, có 1 electron ở lớp ngoài cùng nên trong các hợp chất có số oxi hóa là +1.
Câu 3:
Ở điều kiện thích hợp, phản ứng của Na với chất nào sau đây tạo thành muối clorua?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Câu 4:
Trong bảng tuần hoàn, nguyên tố nào sau đây thuộc nhóm IIA?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Các nguyên tố thuộc nhóm IIA gồm: Be, Mg, Ca, Sr và Ba.
Câu 5:
Xác định kim loại M thỏa mãn sơ đồ sau:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
M được điều chế bằng phương pháp nhiệt luyện nên M là kim loại đứng sau Al trong dãy điện hóa.
Câu 6:
Kim loại sắt tác dụng với chất nào tạo thành hợp chất sắt(III)?
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Fe+ 2HCl FeCl2 + H2
Fe+ 3AgNO3 dư Fe(NO3)3 + 3Ag
Fe+ S FeS
Fe+ CuSO4 FeSO4 + Cu
Câu 7:
Kim loại crom không phản ứng với dung dịch nào?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Do có lớp màng oxit bảo vệ nên Crom không tác dụng với axit HCl loãng, nguội. Crom có thể tác dụng được với HCl, H2SO4 loãng, nóng, H2SO4 đặc nóng,,,
Câu 9:
Khi trời sấm chớp mưa rào, trong không trung xảy ra các phản ứng hóa học ở điều kiện nhiệt độ cao có tia lửa điện, tạo thành hợp chất có tác dụng như một loại phân bón, theo nước mưa rơi xuống, cung cấp chất dinh dưỡng cho cây trồng. Đó là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Khi có sấm chớp thì xảy ra phản ứng:
HNO3 rơi xuống đất tác dụng với các chất kiềm trong đất tạo muối nitrat (phân đạm), cung cấp một lượng nitơ cho cây.
Câu 10:
Dung dịch chất nào sau đây không phản ứng với Fe2O3?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Fe2O3 là một oxit bazơ nên không phản ứng với dung dịch kiềm.
Câu 11:
Một số loại khẩu trang y tế chứa chất bột màu đen có khả năng lọc không khí. Chất đó là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 12:
Quặng manhetit có công thức là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Trong tự nhiên sắt tồn tại trong các quặng:
Quặng hematit đỏ (Fe2O3), quặng hematit nâu (Fe2O3.nH2O), quặng manhetit (Fe3O4, là quặng giàu sắt nhất nhưng hiếm gặp), quặng xiđerit (FeCO3), quặng pirit (FeS2).
Câu 13:
Este được điều chế từ axit axetic CH3COOH và ancol etylic C2H5OH có công thức là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Câu 14:
Chất nào sau đây không tạo kết tủa khi tác dụng với dung dịch AgNO3/NH3 (to)?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Các chất có liên kết ba ở đầu mạch thì có khả năng tham gia phản ứng thế với AgNO3/NH3.
Câu 15:
Chất nào sau đây không tan trong nước?
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Glucozơ, fructozơ và saccarozơ đều tan tốt trong nước.
Tinh bột không tan trong nước nguội, tan nhiều trong nước nóng.
Xenlulozơ không tan trong nước ngay cả khi đun nóng.
Câu 19:
Thủy phân este X trong dung dịch NaOH dư, thu được hỗn hợp chứa 2 muối. Tên của X là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Thủy phân este trong môi trường NaOH dư thu được 2 muối chứng tỏ X là este của phenol. CTCT của X có dạng R-COO-C6H4-R’.
benzyl axetat : CH3COOCH2C6H5. phenyl axetat : CH3COOC6H5.
vinyl fomat : HCOOCH=CH2. metyl acrylat : CH2=CH-COOCH3.
Câu 20:
Cho các chuyển hoá sau:
(1) X + H2O Y
(2) Y + H2 Sobitol
X, Y lần lượt là:
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
X có thể tham gia phản ứng thủy phân, dựa theo các đáp án thì X là xenlulozơ hoặc tinh bột. Mà khi thủy phân đến cùng xenlulozơ hoặc tinh bột đều thu được glucozơ chọn C.
Câu 21:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
D sai vì toluen không có khả năng tham gia phản ứng trùng hợp.
Câu 22:
Cho các polime: poli(vinyl clorua), poli(butađien-stien), policaproamit, polistiren, polietilen, poliisopren. Số polime dùng làm chất dẻo là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Các polime dùng làm chất dẻo là: poli(vinyl clorua), polistiren, polietilen.
Câu 23:
Một chất có chứa nguyên tố oxi, dùng để làm sạch nước và có tác dụng bảo vệ các sinh vật trên Trái Đất không bị bức xạ cực tím. Chất này là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Câu 24:
Kim loại M có thể được điều chế bằng cách khử ion của nó trong oxit bởi khí hiđro ở nhiệt độ cao. Mặt khác, kim loại M có thể tác dụng với dung dịch H2SO4 loãng giải phóng H2. Kim loại M là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Kim loại M có thể được điều chế bằng cách khử ion của nó trong oxit bởi khí hiđro ở nhiệt độ cao M đứng sau Al trong dãy điện hóa loại Cu và Ag.
M có thể tác dụng với dung dịch H2SO4 loãng giải phóng H2 M đứng trước H2 trong dãy điện hóa chọn B.
Câu 25:
Phát biểu nào sau đây không đúng khi nói về phản ứng:
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Khi cho Al vào dung dịch NaOH thì phản ứng xảy ra như sau:
Như vậy chất oxi hóa trong phản ứng (3) là H2O, không phải NaOH.
Câu 26:
Đốt cháy hoàn toàn m gam saccarozơ, tinh bột, xenlulozơ cần vừa đủ V lít O2 (đktc), thu được 26,4 gam CO2. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Tất cả cacbohiđrat khi đốt cháy đều có
Câu 27:
Cho 20,55 gam Ba vào luợng dư dung dịch MgSO4. Sau khi các phản ứng xảy ra hoàn toàn, thu đuợc m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 28:
Hòa tan một lượng kim loại R (hóa trị n) trong dung dịch axit nitric (dư), thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất ở đktc) và dung dịch chứa 4,26 gam muối nitrat. R là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Câu 29:
X là amin no, đơn chức, mạch hở, bậc 1. Cho 1,085 gam X phản ứng vừa đủ với 35 ml dung dịch HCl 1M. Amin X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 30:
Cho các phát biểu sau:
(1) Khi ăn cơm nhai kỹ sẽ thấy vị ngọt, đó là do sự thủy phân của tinh bột nhờ enzim trong tuyến nước bọt tạo thành glucozơ.
(2) Quần áo dệt bằng tơ tằm không nên giặt bằng xà phòng có tính kiềm.
(3) Dầu mỡ sau khi sử dụng, có thể được dùng để tái chế thành nhiên liệu.
(4) Metylamin, đimetylamin, trimetylamin và etylamin là những chất khí mùi khai khó chịu, độc.
(5) Liên kết của nhóm CO với nhóm NH giữa hai đơn vị amino axit được gọi là liên kết peptit.
(6) Keo hồ tinh bột được tạo ra bằng cách hòa tan tinh bột trong nước lạnh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
(1)Đúng
(2)Đúng vì tơ tằm dễ bị thủy phân trong môi trường kiềm.
(3)Đúng.
(4)Đúng.
(5)Sai vì liên kết peptit phải được tạo thành từ hai α-aminoaxit.
(6)Sai, tinh bột không tan trong nước lạnh, chỉ tan trong nước nóng.
Câu 31:
Cho hình vẽ biểu diễn thí nghiệm phân tích định tính glucozơ như sau:
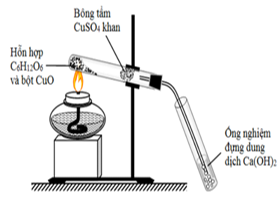
Cho các phát biểu sau:
(a) Tiến hành thí nghiệm để xác định sự có mặt của các nguyên tố C, H và O trong glucozơ.
(b) Ở thí nghiệm trên, có thể thay dung dịch Ca(OH)2 bằng dung dịch CaCl2.
(c) Bột CuO có tác dụng oxi hóa glucozơ thành các hợp chất vô cơ đơn giản.
(d) Ở thí nghiệm trên, bông tẩm CuSO4 khan chuyển sang màu xanh, dung dịch Ca(OH)2 xuất hiện kết tủa màu vàng.
(e) Ở thí nghiệm trên, có thể thay bột CuO bằng bột Al2O3.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Phát biểu đúng là C.
Câu 32:
Chất hữu cơ X mạch hở có công thức phân tử là C6H8O4. Từ X thực hiện sơ đồ sau:
X + NaOH Y + Z + T Y + H2SO4 Na2SO4 + E
Z G + H2O Z + CuO T + Cu + H2O
Cho các phát biểu sau:
(a) T dùng làm nguyên liệu sản xuất nhựa poli(phenol fomanđehit).
(b) Trong y tế, Z được dùng để sát trùng vết thương.
(c) T vừa có tính oxi hóa vừa có tính khử.
(d) E có công thức CH2(COOH)2.
(e) X có đồng phân hình học.
(g) Oxi hoá không hoàn toàn etilen là phương pháp hiện đại sản xuất T.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích
Câu 33:
Thực hiện các thí nghiệm sau:
(a) Cho Ag vào dung dịch hỗn hợp HCl, KNO3 (tỉ lệ mol tương ứng 3:1).
(b) Cho Ba vào dung dịch chứa FeCl3.
(c) Cho dung dịch HCl vào dung dịch Fe(NO3)3.
(d) Cho từ từ dung dịch chứa 1,1a mol KHSO4 vào dung dịch chứa a mol NaHCO3.
(e) Cho dung dịch NaOH vào dung dịch NH4Cl rồi đun nóng.
Sau khi các phản ứng kết thúc, số thí nghiệm tạo thành chất khí là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
(a)
(b)
(c) Không phản ứng.
(d)
(e) NaOH+ NH4Cl NaCl+ NH3+ H2
Các thí nghiệm tạo khí là a, b, d, e.
Câu 34:
Đốt cháy hoàn toàn 14,28 gam hỗn hợp X gồm 2 este đơn chức, thu được 12,992 lít CO2 (đktc) và 8,28 gam H2O. Mặt khác, xà phòng hóa hoàn toàn 14,28 gam X cần vừa đủ 230 ml dung dịch KOH 1M, thu được các sản phẩm hữu cơ gồm một ancol và hai muối. Phần trăm khối lượng của muối có khối lượng phân tử nhỏ hơn là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 35:
Đốt cháy hoàn toàn 17,16 gam triglixerit X, thu được H2O và 1,1 mol CO2. Cho 17,16 gam X tác dụng với dung dịch NaOH vừa đủ, thu được glixerol và m gam muối. Mặt khác, 17,16 gam X tác dụng được tối đa với 0,04 mol Br2 trong dung dịch. Giá trị của m là
 Xem đáp án
Xem đáp án
Chọn đáp án B
Giải thích:
Câu 36:
Dẫn a mol hỗn hợp X (gồm hơi nước, khí CO, CO2) qua cacbon nung đỏ, thu được 1,8a mol hỗn hợp khí Y gồm H2, CO và CO2, trong đó CO2 chiếm 26,67% về thể tích. Dẫn toàn bộ Y vào 500 gam dung dịch hỗn hợp KOH và Ba(OH)2. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
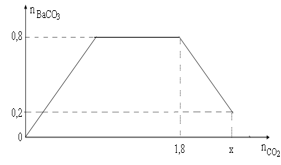
Khối lượng (gam) cacbon đã tham gia phản ứng là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Câu 37:
Đốt cháy hoàn toàn 6,46 gam hỗn hợp E gồm ba este no, mạch hở X, Y, Z (đều tạo bởi axit cacboxylic và ancol; MX < MY < MZ < 248) cần vừa đủ 0,235 mol O2, thu được 5,376 lít khí CO2. Cho 6,46 gam E tác dụng hết với dung dịch NaOH (lấy dư 20% so với lượng phản ứng) rồi chưng cất dung dịch, thu được hỗn hợp hai ancol đồng đẳng kế tiếp và hỗn hợp chất rắn khan T. Đốt cháy hoàn toàn T, thu được Na2CO3, CO2 và 0,18 gam H2O. Phân tử khối của Z là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
Câu 38:
Hỗn hợp X gồm glyxin, alanin và axit glutamic. Hỗn hợp Y gồm ba chất béo. Đốt cháy hoàn toàn 0,28 mol hỗn hợp Z gồm X và Y (biết axit glutamic chiếm 15,957% về khối lượng) cần dùng 7,11 mol O2, sản phẩm cháy gồm N2, CO2 và 88,92 gam H2O. Mặt khác, cho toàn bộ Z trên vào dung dịch nước Br2 dư thấy có 0,08 mol Br2 tham gia phản ứng. Khối lượng ứng với 0,14 mol Z là
 Xem đáp án
Xem đáp án
Chọn đáp án D
Giải thích:
Câu 39:
Hỗn hợp X gồm Cu2O, FeO và kim loại M (M có hóa trị không đổi, số mol của ion O2- gấp 2 lần số mol của M). Hòa tan 48 gam X trong dung dịch HNO3 loãng (dư), thấy có 2,1 mol HNO3 phản ứng. Sau phản ứng thu được 157,2 gam hỗn hợp muối Y và 4,48 lít khí NO (đktc). Phần trăm khối lượng của M trong X là
 Xem đáp án
Xem đáp án
Chọn đáp án A
Giải thích:
Câu 40:
Điện phân dung dịch X chứa x mol Cu(NO3)2 và 0,2 mol NaCl với điện cực trơ, sau một thời gian thu được dung dịch Y có khối lượng giảm 21,5 gam so với dung dịch X. Cho thanh sắt vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, thấy khối lượng thanh sắt giảm 1,8 gam và thấy thoát ra khí NO (sản phẩm khử duy nhất của N+5). Điện phân dung dịch X với trong thời gian 11580 giây với cường độ dòng điện 10A, thu được V lít khí (đktc) ở hai điện cực. Giá trị của V là
 Xem đáp án
Xem đáp án
Chọn đáp án C
Giải thích:
