Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (30 đề)
Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 9)
-
14718 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Khi thuỷ phân đến cùng protein thu được
 Xem đáp án
Xem đáp án
Đáp án D
Khi thuỷ phân đến cùng protein thu được - amino axit.
Câu 2:
Polime được điều chế bằng phản ứng trùng hợp là
 Xem đáp án
Xem đáp án
Đáp án B
Polime được điều chế bằng phản ứng trùng hợp là teflon.
Câu 3:
Khi thuỷ phân bất kỳ chất béo nào cũng thu được
 Xem đáp án
Xem đáp án
Đáp án C
Khi thuỷ phân bất kỳ chất béo nào cũng thu được sản phẩm có chứa glixerol.
Thuỷ phân trong môi trường axit axit béo + glixerol:
Thuỷ phân trong môi trường kiềm muối của axit béo + glixerol:
Câu 4:
Nếu bỏ qua sự phân li của nước, số loại ion trong dung dịch axit photphoric là bao nhiêu?
 Xem đáp án
Xem đáp án
Đáp án C
Axit H3PO4 là một axit 3 nấc, quá trình phân li trong nước xảy ra theo 3 giai đoạn sau:
Vậy trong dung dịch H3PO4 tồn tại 4 loại ion
Câu 5:
Nếu thuỷ phân không hoàn toàn pentapeptit Gly-Ala-Gly-Val-Ala thì thu được tối đa bao nhiêu đipeptit mạch hở chứa Gly?
 Xem đáp án
Xem đáp án
Đáp án C
Có 4 đipeptit khác nhau được tạo thành là: Gly-Ala (1); Gly-Val(2); Ala-Gly(3); Val-Ala(4)
Trong 4 đipeptit tạo thành có 3 đipeptit chứa Gly là: Gly-Ala (1); Gly-Val(2); Ala-Gly(3)
Câu 6:
Tơ lapsan thuộc loại
 Xem đáp án
Xem đáp án
Đáp án C
Tơ lapsan thuộc loại tơ polieste, được tổng hợp từ axit terephtalic và etylen glicol.
Câu 7:
Để đo nồng độ cồn (C2H5OH) trong máu, cảnh sát giao thông sử dụng các dụng cụ phân tích có chứa
 Xem đáp án
Xem đáp án
Đáp án A
Cảnh sát giao thông sử dụng các dụng cụ phân tích rượu etylic (dễ bị oxi hoá) có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 màu đỏ thẫm và biến thành Cr2O3 có màu lục thẫm. Dựa vào sự biến đổi màu sắc mà dụng cụ phân tích sẽ thông báo cho cảnh sát biết được mức độ uống rượu của tài xế. Đây là biện pháp nhằm phát hiện các tài xế đã uống rượu khi tham gia giao thông để ngăn chặn những tai nạn đáng tiếc xảy ra.
Câu 8:
Phương trình hoá học nào sau đây thể hiện cách điều chế Cu theo phương pháp thuỷ luyện? (Biết phản ứng đã xảy ra trong điều kiện thích hợp)
 Xem đáp án
Xem đáp án
Đáp án A
A. Phương pháp thuỷ luyện
B. Phương pháp nhiệt luyện
C, D. Phương pháp điện phân dung dịch.
Câu 9:
Trong dung dịch, ion CO32- có thể cùng tồn tại với dãy các ion nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Điều kiện để các ion có thể cùng tồn tại trong một dung dịch là: Các ion phải không kết hợp được với nhau để tạo thành ít nhất 1 trong các chất bay hơi, chất kết tủa, hoặc chất điện li yếu.
Câu 10:
Khi nói về CO2, khẳng định nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án D
CO2 là chất khí không màu, khồng mùi, nặng hơn không khí, gây hiệu ứng nhà kính, không độc, không duy trì sự sống, dùng để chữa cháy, trừ các đám cháy kim loại. Các kim loại như Mg, Al có thể cháy trong CO2 (thể hiện tính oxi hoá yếu), phản ứng toả nhiệt mạnh, tạo sản phẩm chứa cacbon. Sau đó, cacbon có thể tiếp tục cháy trong CO2. Phản ứng xảy ra như sau:
Câu 11:
Thuỷ phân este X có công thức phân tử là C4H6O2 trong môi trường axit, thu được một hỗn hợp các chất đều tham gia phản ứng tráng gương. Vậy công thức cấu tạo của X là?
 Xem đáp án
Xem đáp án
Đáp án C
Công thức cấu tạo của este X đó là: HCOOCH=CHCH3 vì khi thuỷ phân X trong môi trường axit, tạo axit HCOOH và CH3CH2CHO đều có khả năng tham gia phản ứng tráng gương.
Câu 12:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án A
A. Đúng, dung dịch saccarozơ phản ứng với Cu(OH)2 tạo dung dịch màu xanh lam.
B. Sai, Tinh bột không có phản ứng tráng bạc.
C. Sai, xenlulozơ chỉ bị thuỷ phân trong môi trường axit đun nóng.
D. Sai, glucozơ là monosaccarit nên không bị thuỷ phân trong môi trường axit.
Câu 13:
Trộn dung dịch chứa x mol AlCl3 với dung dịch chứa y mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
 Xem đáp án
Xem đáp án
Đáp án D
Khi Al3+ phản ứng với OH- có thể xảy ra các phản ứng sau:
Nếu lượng OH- dư kết tủa sẽ bị hoà tan theo phản ứng sau:
Để thu được kết tủa sau phản ứng có 2 trường hợp:
TH1: Chỉ xảy ra phản ứng (1) hay x : y 1 : 3 (*)
TH2: Xảy ra phản ứng (1), (2) và lượng OH- dư < lượng kết tủa Al(OH)3 tạo thành
hay x : y > 1 : 4 (**).
Kết hợp (*) và (**) x : y > 1 : 4
Câu 14:
Tiến hành sục khí Cl2 vào dung dịch CrCl3 trong môi trường NaOH. Sản phẩm thu được là
 Xem đáp án
Xem đáp án
Đáp án D
Khí Cl2 oxi hoá trong môi trường OH- theo phản ứng sau:
Câu 15:
Cho 9,125 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư), thu được 13,6875 gam muối. Số đồng phân cấu tạo của X là
 Xem đáp án
Xem đáp án
Đáp án B
Áp dụng định luật bảo toàn khối lượng ta có:
Vì X là amin đơn chức nên suy ra:
X là C4H11N.
Các đồng phân của X là:
Câu 16:
Hỗn hợp X gồm ancol metylic, etylen glicol. Cho m gam X phản ứng hoàn toàn với Na dư, thu được 2,24 lít khí H2 (đktc). Đốt cháy hoàn toàn m gam X, thu được a gam CO2. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án A
Theo phương trình phản ứng trên ta có:
Mặt khác:
Câu 17:
Dung dịch X chứa hỗn hợp các chất KOH 0,05M, NaOH 0,05M và Ca(OH)2 0,15M. Sục 7,84 lít khí CO2 (đktc) vào 1 lít dung dịch X thì lượng kết tủa thu được là?
 Xem đáp án
Xem đáp án
Đáp án A
Theo đầu bài ta có:
Câu 18:
Hiđrocacbon thơm E có công thức cấu tạo như sau
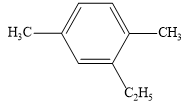
Tên gọi của E theo danh pháp thay thế là
 Xem đáp án
Xem đáp án
Đáp án C
Đánh số nguyên tử C ở vòng benzen để tổng chỉ số vị trí các nhóm thế nhỏ nhất.
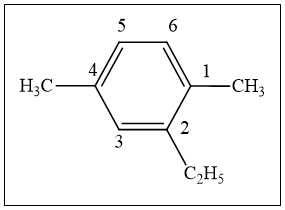
(2 – etyl – 1,4 – đimetylbenzen)
Câu 19:
X là một este hữu cơ đơn chức, mạch hở. Cho một lượng X tác dụng hoàn toàn với dung dịch NaOH vừa đủ, thu được muối có khối lượng bằng khối lượng este ban đầu. X là?
 Xem đáp án
Xem đáp án
Đáp án D
Cách 1:
Este có công thức dạng RCOOR’, muối tạo thành là RCOONa.
Vì số mol este bằng số mol muối, nên tỉ lệ về khối lượng của chúng cũng là tỉ lệ về khối lượng phân tử, theo giả thiết ta có:
Giá trị trung bình của 2 gốc (R và R’) được tính theo biểu thức
Nếu có một gốc có khối lượng nhỏ hơn 15 thì đó phải là gốc axit (R).
Chọn R = 1 loại. Vậy cả hai gốc R và R’ đều có khối lượng là 15 và đều là CH3–
CTCT của este là CH3COOCH3.
Cách 2:
Vì R’ là CH3– (15) Loại A và C.
Ta có
Câu 20:
Cho 11,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X và 5,6 lít khí H2 (ở đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 21:
Cho các sơ đồ phản ứng sau:
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án C
Các phản ứng xảy ra:
A. Sai, làm quỳ tím hoá xanh.
B. Sai, nhiệt độ sôi của thấp hơn so với CH3COOH.
C. Đúng, NaOOC[CH2]4COONa (X1) là muối chứa liên kết ion nên có nhiệt độ nóng chảy cao hơn HOOC[CH2]4COOH (X3) chỉ chứa liên kết cộng hoá trị.
D. Sai.
Câu 22:
Hoà tan hoàn toàn 15,6 gam hỗn hợp Al và Al2O3 vào dung dịch Ba(OH)2 dư, thu được dung dịch X và thoát ra V lít H2 (đktc). Cho từ từ đến dư dung dịch H2SO4 loãng vào X thì thấy lượng H2SO4 phản ứng tối đa là 0,9 mol, đồng thời thu được 69,9 gam kết tủa. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án B
Ta có hệ phương trình:
Câu 23:
Điện phân dung dịch AgNO3 (điện cực trơ) trong thời gian 20 phút, thu được 0,54 gam Ag ở catot. Sau đó để làm kết tủa hết ion Ag+ còn lại trong dung dịch sau điện phân cần dùng 30 ml dung dịch NaCl 0,5M. Cường độ dòng điện và khối lượng AgNO3 ban đầu tương ứng là?
 Xem đáp án
Xem đáp án
Đáp án A
Số electron trong quá trình điện phân là:
Cường độ dòng điện đã dùng là:
Mặt khác:
Câu 24:
Cho m gam tinh bột lên men thành C2H5OH với hiệu suất 81%, hấp thụ hết lượng CO2 sinh ra vào dung dịch Ca(OH)2 được 55 gam kết tủa và dung dịch X. Đun nóng dung dịch X lại có 10 gam kết tủa nữa. Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình phản ứng:
Theo giả thiết ta thấy khi CO2 phản ứng với dung dịch Ca(OH)2 thì tạo ra cả hai loại muối là CaCO3 và Ca(HCO3)2. Từ các phản ứng (1), (2), (3), (4), (5) suy ra:
Vậy khối lượng tinh bột tham gia phản ứng với hiệu suất 81% là:
Câu 25:
Valin là một loại amino axit thiết yếu, cần được cung cấp từ nguồn thực phẩm bên ngoài, cơ thể không tự tổng hợp được. Khi cho 1,755 gam valin hoà tan trong nước thu được dung dịch X. Dung dịch X phản ứng vừa đủ với 15 ml dung dịch NaOH có nồng độ C (mol/l). Giá trị của C là
 Xem đáp án
Xem đáp án
Đáp án A
Valin là amino axit trong phân tử có 1 nhóm –COOH.
Phương trình phản ứng:
Vậy nồng độ mol của dung dịch NaOH là
Câu 26:
Đun nóng m gam một hợp chất hữu cơ X (chứa C, H, O), mạch không phân nhánh với dung dịch chứa 11,2 gam KOH đến khi phản ứng xảy ra hoàn toàn, thu được dung dịch A, để trung hoà dung dịch KOH dư trong A cần dùng 80 ml dung dịch HCl 0,5M. Làm bay hơi hỗn hợp sau khi trung hoà một cách cẩn thận, người ta thu được 7,36 gam hỗn hợp hai ancol đơn chức Y và 18,34 gam hỗn hợp hai muối Z. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Trong phản ứng trung hoà:
Sơ đồ phản ứng:
Áp dụng định luật bảo toàn khối lượng ta có:
Câu 27:
Dẫn V lít (đktc) hỗn hợp X gồm axetilen và hiđro có khối lượng là m gam đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3 thu được 12 gam kết tủa. Khi đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z thu được 2,24 lít khí CO2 (đktc) và 4,5 gam H2O. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án A
Ta có:
Câu 28:
Hỗn hợp X gồm Ala-Ala, Gly-Ala, Ala-Gly, Ala-Ala-Val-Ala và Ala-Val-Val-Ala. Cho m gam hỗn hợp X tác dụng với lượng vừa đủ NaOH, đun nóng thu được m+29,7 gam hỗn hợp muối của các amino axit. Mặt khác nếu đốt cháy hoàn toàn m gam hỗn hợp X thu được 63,616 lít CO2 (đktc) và 49,32 gam H2O. Giá trị gần đúng của m là
 Xem đáp án
Xem đáp án
Đáp án B
Sơ đồ phản ứng đốt cháy:
Phản ứng thuỷ phân:
Từ (1)(2)
Câu 29:
Hoà tan hoàn toàn hai chất rắn X, Y vào nước thu được dung dịch Z. Tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho dung dịch KOH dư vào V lít dung dịch Z, đun nóng thu được n1 mol khí.
Thí nghiệm 2: Cho dung dịch H2SO4 dư vào V lít dung dịch Z, thu được n2 mol khí không màu hoá nâu ngoài không khí, là sản phẩm khử duy nhất.
Thí nghiệm 3: Cho dung dịch Ba(OH)2 dư vào V lít dung dịch Z, thu được n1 mol kết tủa.
Biết các phản ứng xảy ra hoàn toàn và n1 = 6n2. Hai chất rắn X, Y lần lượt là?
 Xem đáp án
Xem đáp án
Đáp án A
Thí nghiệm 1 và 3 thu được cùng 1 số mol nên loại NH4Cl và AlCl3.
Thí nghiệm 2 có sinh ra khí NO nên loại NH4NO3 và FeCl3.
Vì n1 = 6n2 Chọn (NH4)2SO4 và Fe(NO3)2.
Câu 30:
Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn este no, đơn chức, mạch hở luôn thu được số mol CO2 bằng số mol H2O.
(b) Các loại bật lửa ga thông dụng trên thị trường chứa nguyên liệu chủ yếu là khí metan hoá lỏng
(c) Bậc của amin là bậc của nguyên tử cacbon liên kết với nhóm amin.
(d) Để hạn chế vị tanh của cá, khi nấu canh cá người ta nấu với các loại có vị chua như me, sấu, khế…
(e) Có thể phân biệt len (lông cừu) và “len” (tơ nitron) bằng cách đốt.
Số phát biểu đúng là?
 Xem đáp án
Xem đáp án
Đáp án C
(a). Đúng.
(b). Sai, các loại bật lửa ga thông dụng trên thị trường chứa nguyên liệu chủ yếu là khí butan hoá lỏng.
(c). Sai, bậc của amin được tính bằng số nguyên tử hiđro trong phân tử NH3 bị thế bởi gốc hiđrocacbon.
(d). Đúng, mùi tanh của cá (đặc biệt là cá mè) là do hỗn hợp một số amin (nhiều nhất là trimetylamin) và một số chất khác gây nên. Khi nấu canh cá người ta thường cho chất chua. Các amin tanh trong cá là nhóm những chất có chứa bazơ, khi kết hợp với axit hữu cơ có trong các chất chua thường là axit axetic, axit lactic (giấm, mẻ, khế, cà chua, dọc, tai chua, sấu…) sẽ tạo thành các muối tương ứng và nước, do vậy cá sẽ bớt tanh hoặc hết mùi tanh.
(e). Đúng, len lông cừu có bản chất protein, khi đốt cháy bị phân huỷ tạo ra mùi khét. Len (tơ nitron) khi cháy không tạo ra mùi khét. Vì vậy đốt cháy hai loại sợi len đó, có thể phân biệt được chúng.
Câu 31:
Các hiđroxit: NaOH, Al(OH)3, Fe(OH)3, Ba(OH)2 được kí hiệu ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của X, Y, Z, T được ghi ở bảng sau:
| X | Y | Z | T | |
| Tính tan | Tan | Không tan | Không tan | Tan |
| Phản ứng với NaOH | Không xảy ra phản ứng | Không xảy ra phản ứng | Có xảy ra phản ứng | Không xảy ra phản ứng |
| Phản ứng với Na2SO4 | Không xảy ra phản ứng | Không xảy ra phản ứng | Không xảy ra phản ứng | Phản ứng tạo kết tủa trắng |
Các chất X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
T tạo kết tủa với Na2SO4 T là Ba(OH)2.
Theo đầu bài trong dãy có 2 hiđroxit tan trong nước là: NaOH và Ba(OH)2 X: NaOH
Y là Fe(OH)3 không phản ứng với NaOH, còn Z là Al(OH)3 có phản ứng với NaOH.
Câu 32:
Một học sinh lắp đặt dụng cụ thí nghiệm như hình dưới đây từ các chất X, Y để điều chế khí Z.
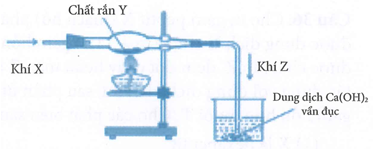
Phản ứng hoá học thoả mãn thí nghiệm trên là?
 Xem đáp án
Xem đáp án
Đáp án B
Với điều kiện thí nghiệm X ở dạng khí, Y dạng rắn, Z dạng khí làm vẩn đục nước vôi trong chỉ có phản ứng B là phù hợp.
Câu 33:
Tiến hành các thí nghiệm sau
(a) Cho dung dịch NH3 dư vào dung dịch BaCl2.
(b) Cho dung dịch FeCl3 vào dung dịch H2S.
(c) Cho dung dịch AgNO3 vào dung dịch H3PO4.
(d) Cho dung dịch AgNO3 dư vào dung dịch Fe(NO3)2.
(e) Cho dung dịch AlCl3 vào dung dịch H2S.
Sau khi thí nghiệm kết thúc, số trường hợp thu được kết tủa là
 Xem đáp án
Xem đáp án
Đáp án A
(a) NH3 không tác dụng với BaCl2.
(b)
(c) AgNO3 không tác dụng với H3PO4, do giả sử phản ứng xảy ra thì Ag3PO4 tan ngay trong HNO3 tạo thành nên phản ứng giữa AgNO3 và H3PO4 coi như không xảy ra.
(d)
(e) AlCl3 không tác dụng với H2S.
Câu 34:
Dung dịch X chứa hỗn hợp muối KCl a mol và CuSO4 b mol (trong đó a < 2b). Tiến hành điện phân dung dịch với điện cực trơ với thời gian t giây. Giả thiết thể tích dung dịch không đổi trong quá trình điện phân. Giá trị pH của dung dịch biến đổi theo đồ thị nào sau đây?
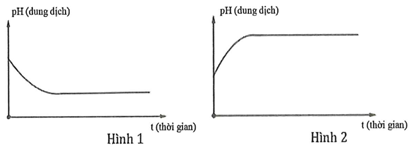
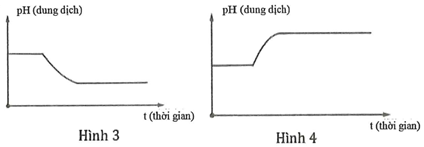
 Xem đáp án
Xem đáp án
Đáp án D
Theo đề ta có: a < 2b nên KCl điện phân hết còn CuSO4 dư.
+ Quá trình 1: pH của dung dịch không đổi
+ Quá trình 2: [H+] tăng pH giảm.
Câu 35:
Tiến hành các thí nghiệm sau:
(1) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(2) Cho bột Zn vào lượng dư dung dịch HCl.
(3) Dẫn khí H2 dư qua ống sứ chứa bột CuO nung nóng.
(4) Cho Ba vào lượng dư dung dịch CuSO4.
(5) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
Đáp án B
Câu 36:
Cho m gam peptit X (mạch hở) phản ứng vừa đủ dung dịch NaOH đun nóng, thu được dung dịch Y chứa (m + 11,1) gam hỗn hợp muối natri của Gly, Ala và Val. Cô cạn Y được chất rắn Z, đem đốt cháy hoàn toàn Z thu được 15,9 gam Na2CO3. Nếu cho m gam X tác dụng với dung dịch HCl dư, sau phản ứng dung dịch thu được đem cô cạn được 36,25 gam hỗn hợp muối T. Cho các phát biểu sau:
(1) X là hexapeptit
(2) Giá trị của m = 20,8 gam
(3) Phân tử khối của X là 416
(4) Trong X chỉ có 1 gốc Ala
(5) % khối lượng muối clorua của Gly trong T là 46,4%
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Định hướng tư duy giải toán
Câu 37:
Cho m1 gam hỗn hợp X chứa Al, Fe(NO3)2 và 0,1 mol Fe3O4 tan hết trong dung dịch chứa 1,025 mol H2SO4. Sau phản ứng thu được 5,04 lít (đktc) hỗn hợp khí Y gồm hai khí trong đó có một khí hoá nâu ngoài không khí và dung dịch Z chỉ chứa các muối sunfat trung hoà. Biết tỷ khối của Y so với H2 là 31/3. Cho một lượng vừa đủ BaCl2 vào Z sau khi các phản ứng xảy ra xong cho tiếp AgNO3 dư vào thì thu được m2 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của tổng m1 + m2 là:
 Xem đáp án
Xem đáp án
Đáp án C
Định hướng tư duy giải toán
Câu 38:
X, Y là hai axit cacboxylic đều đơn chức, mạch hở (trong mỗi phân tử X, Y chứa không quá 2 liên kết và 50 < MX < MY); Z là este được tạo bởi X, Y và etylen glicol. Đốt cháy 13,12 gam hỗn hợp E chứa X, Y, Z cần dùng 0,5 mol O2. Mặt khác, cho 0,36 mol E làm mất màu vừa đủ dung dịch chứa 0,1 mol Br2. Nếu đun nóng 13,12 gam E với 200 ml dung dịch KOH 1M (vừa đủ), cô cạn dung dịch sau phản ứng thu được hỗn hợp F gồm a gam muối P và b gam muối Q (MP < MQ). Tỉ lệ a: b gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Dựa vào tỉ lệ mol của Br2 và hỗn hợp E E chứa 1 axit cacboxylic no và 1 axit cacboxylic không no (có 1 liên kết C=C).
Ta có:
Giả sử X là axit cacboxylic no
Đặt
X là CH3COOH
Y là CH2=CHCOOH
Muối thu được gồm CH3COOK (0,15 mol) và CH2=CHCOOK (0,05 mol) a: b = 2,67.
Câu 39:
Hoà tan hoàn toàn 11,2648 gam hỗn hợp X gồm Fe, Fe(NO3)2 và Al vào dung dịch HCl vừa đủ. Sau phản ứng hoàn toàn, thu được dung dịch Y có chứa 24,2348 gam muối và thoát ra 0,672 lít hỗn hợp khí Z gồm 2 khí không màu, đều nhẹ hơn không khí. Cho dung dịch Y tác dụng với dung dịch AgNO3 dư thì thu được 72,2092 gam kết tủa. % khối lượng muối FeCl3 trong hỗn hợp muối là.
 Xem đáp án
Xem đáp án
Đáp án C
Ta có các phản ứng sau:
Bảo toàn khối lượng:
Bảo toàn điện tích dung dịch Y:
Giải (1), (2)
Câu 40:
Hoà tan hoàn toàn m gam hỗn hợp X gồm Mg, Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa H2SO4 và 0,045 mol NaNO3, thu được dung dịch Y chỉ chứa 62,605 gam muối trung hoà và 3,808 lít (đktc) hỗn hợp Z (trong đó có 0,02 mol H2, NO, CO2). Tỉ khối của Z so với O2 bằng 19/17. Thêm dung dịch NaOH 1M vào Y đến khi thu được lượng kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, cho Y tác dụng vừa đủ với BaCl2, sau đó cho tiếp tục lượng dư AgNO3 vào thu được 256,04 gam kết tủa. Thành phần phần trăm về khối lượng của kim loại Fe trong hỗn hợp X gần nhất với?
 Xem đáp án
Xem đáp án
Đáp án B
- Cho
- Ta có:
- Khi cho Y tác dụng lần lượt với các dung dịch BaCl2 và AgNO3 thì thu được kết tủa gồm:
- Khí Z chứa các khí H2 (0,02 mol), CO2 (0,11 mol), NO (0,04 mol).
Từ (1)
Và Từ (2), (3) ta suy ra:
Vậy
