Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (30 đề)
Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 10)
-
14712 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 2:
Tinh bột trong gạo nếp có thành phần chính là?
 Xem đáp án
Xem đáp án
Đáp án B
Tinh bột trong gạo nếp, ngô nếp chứa lượng amilopectin rất cao, khoảng 90% làm cho cơm nếp, xôi nếp,... rất dẻo, dẻo đến mức dính.
Câu 3:
Trong công nghiệp, kim loại nào sau đây có thể được sản xuất từ quặng hematit?
 Xem đáp án
Xem đáp án
Đáp án B
Trong công nghiệp, sắt được sản xuất từ quặng hematit (một dạng khoáng vật của oxit sắt Fe2O3).
Câu 4:
Thuốc thử được dùng để phân biệt Gly - Ala - Gly và Gly - Ala là
 Xem đáp án
Xem đáp án
Đáp án A
Tripeptit Gly- Ala - Gly có 2 liên kết peptit nên có phản ứng màu với Cu(OH)2 tạo thành phức chất có màu tím đặc trưng (phản ứng màu biure).
Đipeptit Gly - Ala chỉ có 1 liên kết peptit nên không tham gia phản ứng này.
Câu 5:
Hợp chất nào sau đây trong công thức cấu tạo có 9 liên kết xích ma () và 2 liên kết pi ()?
 Xem đáp án
Xem đáp án
Đáp án C
Trong công thức cấu tạo của buta-1,3-đien: CH2=CH-CH=CH2 có 9 liên kết xích ma () và 2 liên kết pi ().
Câu 6:
Etyl propionat là este có mùi thơm của dứa. Công thức của etyl propionat là
 Xem đáp án
Xem đáp án
Đáp án B
Etyl propionat là este có mùi thơm của dứa, có công thức là: C2H5COOC2H5.
Câu 7:
Thực hiện phản ứng nào sau đây để thu được bơ nhân tạo từ dầu thực vật?
 Xem đáp án
Xem đáp án
Đáp án C
Dầu thực vật chứa các gốc axit béo không no dạng lỏng, khi hiđro hóa dầu thực vật sẽ thu được bơ nhân tạo (chứa các gốc axit béo no, dạng rắn).
Câu 8:
Axit -aminocaproic được dùng để điều chế nilon-6. Công thức của axit -amino- caproic là
 Xem đáp án
Xem đáp án
Đáp án D
Công thức của axit -aminocaproic được dùng để điều chế nilon-6 là: H2N-(CH2)5-COOH.
Câu 9:
Thủy phân este mạch hở X có công thức phân tử C4H6O2, thu được sản phẩm đều có khả năng tham gia phản ứng tráng bạc. Số công thức cấu tạo phù hợp của X là
 Xem đáp án
Xem đáp án
Đáp án D
Công thức cấu tạo của X thoả mãn là HCOOCH=CH-CH3.
Câu 10:
Đun nóng hỗn hợp gồm glyxin, phenylalanin, tyrosin, valin, alanin tạo ra pentapeptit có chứa các gốc amino axit khác nhau. Số lượng pentapeptit có thể tạo ra là
 Xem đáp án
Xem đáp án
Đáp án B
Số pentapeptit tạo ra bởi 5 amino axit khác nhau là 5! = 120.
Câu 11:
Giữ cho bề mặt kim loại luôn sạch, không để bùn đất bám vào, bôi dầu mỡ, quét sơn, là một trong các biện pháp để bảo vệ kim loại không bị ăn mòn. Như vậy là đã áp dụng phương pháp chống ăn mòn nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Giữ cho bề mặt kim loại luôn sạch, không để bùn đất bám vào, bôi dầu mỡ, quét sơn, chính là biện pháp cách li kim loại với môi trường, để bảo vệ kim loại không bị ăn mòn.
Câu 12:
Cho phản ứng:
Sau khi cân bằng phản ứng trên, tổng hệ số tối giản của phản ứng là?
 Xem đáp án
Xem đáp án
Đáp án B
Ta có phương trình phản ứng sau khi cân bằng:
Câu 13:
Phương trình hóa học nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng không đúng là:
Do đúng phải là:
Câu 14:
Cho dãy các chất: axit acrylic, phenyl axetat, anlyl axetat, metylamoni axetat, etyl fomat, tripanmitin. Số chất trong dãy khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra ancol là
 Xem đáp án
Xem đáp án
Đáp án D
Các chất thoả mãn khi thủy phân trong dung dịch NaOH (dư), đun nóng sinh ra ancol là: anlyl axetat, etyl fomat, tripanmitin.
Câu 15:
Môi trường không khí, đất, nước xung quanh một số nhà máy hoá chất thường bị ô nhiễm nặng bởi khí độc, ion kim loại nặng và các hoá chất. Biện pháp nào sau đây cần phải được thực hiện nhằm chống gây ô nhiễm môi trường?
 Xem đáp án
Xem đáp án
Đáp án D
Để tránh gây ô nhiễm môi trường sống, các nhà máy hóa chất cần phải lắp đặt các hệ thống xử lí chất thải trước khi xả ra ngoài hệ thống không khí, sông, hồ, biển. Quá trình sản xuất cần được thực hiện theo quy trình khép kín để tận dụng lượng chất thải một cách hiệu quả. Ngoài ra, cần thường xuyên thay đổi công nghệ sản xuất, sử dụng nhiên liệu sạch.
Câu 16:
Nhiệt phân hoàn toàn 9,4 gam muối nitrat của kim loại M hóa trị II. Thu được 4,0 gam oxit kim loại tương ứng. M là kim loại:
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình phản ứng nhiệt phân:
mol: a 2a 0,5a
mKhí = mrắn giảm
Theo đầu bài:
Câu 17:
Cho các polime sau đây: (1) tơ tằm ; (2) sợi bông; (3) sợi đay; (4) tơ enang; (5) tơ visco; (6) nilon-6,6 ; (7) tơ axetat. Loại tơ có nguồn gốc xenlulozơ là:
 Xem đáp án
Xem đáp án
Đáp án B
Các loại tơ có nguồn gốc xenlulozơ là: sợi bông, sợi đay, tơ visco, tơ axetat.
Câu 18:
Cho 2,13 gam P2O5 tác dụng với 80 ml dung dịch NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X chứa m gam muối B. Qua sự thủy phân của các ion, giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Theo đầu bài ta có:
Câu 19:
Cho dung dịch Ba(OH)2 dư vào 50 ml dung dịch X chứa các ion: đun nóng, thu được 11,65 gam kết tủa và 4,48 lít khí Y thoát ra (đktc). Nồng độ mol mỗi muối trong dung dịch X là:
 Xem đáp án
Xem đáp án
Đáp án A
Câu 20:
Hỗn hợp X gồm alanin và axit glutamic. Cho a gam X tác dụng hoàn toàn với dung dịch NaOH (dư), thu được dung dịch Y chứa (a + 30,8) gam muối. Mặt khác, nếu cho a gam X tác dụng hoàn toàn với dung dịch HCl, thu được dung dịch Z chứa (a +36,5) gam muối. Giá trị của a là:
 Xem đáp án
Xem đáp án
Đáp án A
Đặt số mol của H2N - CH(CH3) - COOH là x và của HOOC - (CH2)2 - CH(NH2) –COOH là y.
Phương trình phản ứng:
- COOH + NaOH - COONa + H2O (1)
mol: (x + 2y) (x + 2y)
-NH2 + HCl -NH3Cl (2)
mol: (x + y) (x + y) (x + y)
Theo (1), (2) và giả thiết ta có:
Câu 21:
Nhiệt phân hoàn toàn 17,4 gam hỗn hợp X chứa M2CO3 và CaCO3 (trong điều kiện thích hợp). Đến khi phản ứng kết thúc thu được 8,6 gam chất rắn Y và V lít khí CO2 (đktc). Giá trị của V và kim loại M tương ứng là?
 Xem đáp án
Xem đáp án
Đáp án C
mrắn giảm
loại A, B.
Ta có hệ phương trình:
loại D.
Câu 22:
Thủy phân hỗn hợp gồm 0,02 mol saccarozơ và 0,01 mol mantozơ (gồm 2 gốc glucozơ liên kết với nhau) một thời gian thu được dung dịch X (hiệu suất phản ứng thủy phân mỗi chất đều là 75%). Khi cho toàn bộ X tác dụng với một lượng dư dung dịch AgNO3 trong NH3 thì lượng Ag thu được là:
 Xem đáp án
Xem đáp án
Đáp án B
Vì hiệu suất phản ứng thủy phân là 75% nên tổng số mol mantozơ và saccarozơ tham gia phản ứng thủy phân là:
Số mol của mantozơ dư sau phản ứng thủy phân là
Sơ đồ phản ứng:
C12H22O11 (gồm mantozơ và saccarozơ phản ứng) 2C6H12O6 4Ag (1)
mol: 0,0225 0,045 0,09
C12H22O11 (mantozơ dư) 2Ag (2)
mol: 0,0025 0,005
Saccarozơ dư không tham gia phản ứng tráng gương.
Theo sơ đồ (1) và (2) suy ra tổng số mol Ag tạo ra là 0,095 mol.
Câu 23:
Dung dịch X chứa x mol K2CO3 và y mol NaHCO3. Thực hiện các thí nghiệm sau: Thí nghiệm 1 (TN1): Cho (x + y) mol CaCl2 vào dung dịch X, thu được m1 gam kết tủa.
Thí nghiệm 2 (TN2): Cho (x + y) mol Ca(OH)2 vào dung dịch X, thu được m2 gam kết tủa. Khối lượng kết tủa thu được trong 2 TN là:
 Xem đáp án
Xem đáp án
Đáp án B
Ở thí nghiệm 1:
CaCl2 + K2CO3 CaCO3 +2KCl
mol: x x x
Ở thí nghiệm 2:
Ca(OH)2 + K2CO3 CaCO3 +2KOH
mol: x x x
Ca(OH)2 + NaHCO3 CaCO3+ NaOH + H2O
mol: y y y
Từ (1) và (2)
Câu 24:
Trộn 100 ml dung dịch A gồm KHCO3 1M và K2CO3 1M vào 100 ml dung dịch B gồm NaHCO3 1M và Na2CO3 1M thu được dung dịch C. Nhỏ từ từ 100 ml dung dịch D gồm H2SO4 1M và HC1 1M vào dung dịch C thu được V lít CO2 (đktc) và dung dịch E. Cho dung dịch Ba(OH)2 tới dư vào dung dịch E thì thu được m gam kết tủa. Giá trị của m và V lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án D
Dung dịch C chứa:
Dung dịch D có tổng:
Nhỏ từ từ dung dịch D vào dung dịch C:
Tiếp tục xảy ra phản ứng:
Trong dung dịch E còn 0,3 mol HCO3-. Tiếp tục cho dung dịch Ba(OH)2 dư vào E
Khối lượng kết tủa là:
Câu 25:
Một chất hữu cơ X có công thức phân tử là C4H11NO2. Cho X tác dụng hoàn toàn với 100 ml dung dịch NaOH 2M, sau phản ứng thu được dung dịch Y và 2,24 lít khí Z (đktc). Nếu trộn lượng khí Z này với 3,36 lít H2 (đktc) thì được hỗn hợp khí có tỉ khối so với H2 là 9,6. Khối lượng chất rắn thu được khi cô cạn dung dịch Y là
 Xem đáp án
Xem đáp án
Đáp án D
X (C4H11NO2) + NaOH Z Z là NH3 hoặc amin, X là muối amoni.
Theo đầu bài, ta có:
Ta có:
Câu 26:
Oxi hoá 9,2 gam ancol etylic bằng CuO đun nóng thu được 13,2 gam hỗn hợp gồm anđehit, axit cacboxylic, ancol dư và nước. Hỗn hợp này tác dụng với Na sinh ra 3,36 lít H2 (ở đktc). Phần trăm khối lượng ancol bị oxi hoá là:
 Xem đáp án
Xem đáp án
Đáp án C
Theo giả thiết ta có:
Phương trình phản ứng:
Theo các phương trình phản ứng và giả thiết ta có:
Vậy phần trăm khối lượng ancol bị oxi hóa là:
Câu 27:
Hỗn hợp A gồm 1 axit no đơn chức (mạch hở) và một axit không no đơn chức mạch hở có một liên kết đôi ở gốc hiđrocacbon. Khi cho a gam A tác dụng hết với CaCO3 thoát ra 1,12 lít CO2 (đktc). Cho 7,8 gam hỗn hợp B gồm CH3OH và C2H5OH tác dụng hết với Na thoát ra 2,24 lít H2 (đktc). Nếu trộn a gam A với 3,9 gam B rồi đun nóng có H2SO4 đặc xúc tác thì thu được m gam este (hiệu suất H%). Giá trị m theo a, H là:
 Xem đáp án
Xem đáp án
Đáp án B
Đặt công thức trung bình của hai axit trong X là
Đặt công thức trung bình của hai ancol trong Y là
Phương trình phản ứng:
Theo (1), (2) và giả thiết ta có:
Như vậy khi cho a gam hỗn hợp axit phản ứng với 3,9 gam hỗn hợp ancol thì số mol đem phản ứng của axit và ancol đều bằng nhau và bằng 0,1 mol.
Với hiệu suất 100% thì khối lượng este thu được là:
Trên thực tế hiệu suất phản ứng este hóa là H% nên khối lượng este thu được là:
Câu 28:
Este X mạch hở có công thức phân tử C7H10O4. Từ X thực hiện các phản ứng sau:
(1)
(2)
(3)
(4)
Biết các phản ứng xảy ra theo đúng tỉ lệ mol. Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án C
Các phương trình phản ứng xảy ra như sau:
A. Đúng, X có mạch cacbon không phân nhánh.
B. Đúng, đun nóng X3 với H2SO4 đặc (170°C), thu được chất Z.
C. Sai, trong Y có số nguyên tử cacbon nhỏ hơn số nguyên tử hidro.
D. Đúng, X3 có nhiệt độ sôi cao hơn X2.
Câu 29:
Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là:
 Xem đáp án
Xem đáp án
Đáp án D
Đặt công thức phân tử của hiđrocacbon là CnH2n+2-2k (k là số liên kết pi trong phân tử).
Các phản ứng:
Theo giả thiết và phương trình phản ứng ta thấy:
Vì hiđrocacbon ở thể khí nên và từ (3) suy ra (vì hợp chất có 1 C không thể có liên kết p).
• Nếu n=2, k=2 thì hiđrocacbon là
• Nếu n=3, k=3 thì hiđrocacbon là C3H2 (loại).
• Nếu n=4, k=4 thì hiđrocacbon là
Câu 30:
Để phân tích định tính các nguyên tố trong hợp chất hữu cơ, người ta thực hiện một thí nghiệm được mô tả như hình vẽ:
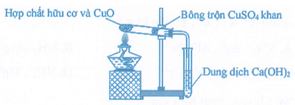
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án B
Phát biểu đúng là: Thí nghiệm trên dùng để xác định sự có mặt của C và H trong các hợp chất hữu cơ.
Câu 31:
X, Y là hai peptit mạch hở, có tổng số nguyên tử oxi là 9 và đều được tạo bởi từ glyxin và valin. Đốt cháy m gam hỗn hợp E chứa X, Y cần dùng 2,43 mol O2, thu được CO2, H2O, N2; trong đó khối lượng của CO2 nhiều hơn khối lượng của H2O là 51,0 gam. Mặt khác thủy phân hoàn toàn m gam E với 600ml dung dịch KOH 1,25M (đun nóng), cô cạn dung dịch sau phản ứng thu được (1,6m + 8,52) gam rắn khan. Phần trăm khối lượng của Y (Mx < My) có trong hỗn hợp E là
 Xem đáp án
Xem đáp án
Đáp án A
. Đặt Đ. chéo:
Câu 32:
Cho các phát biểu sau:
(1) Điều chế kim loại Al bằng cách điện phân nóng chảy A12O3;
(2) Tất cả kim loại kiềm thổ đều tan trong nước ở nhiệt độ thường;
(3) Quặng boxit có thành phần chính là Na3AlF6;
(4) Bột nhôm tự bốc cháy khi tiếp xúc với khí clo;
(5) Thạch cao sống có công thức là CaSO4.2H2O;
(6) Đun nóng có thể làm mềm nước có tính cứng vĩnh cửu.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
Phát biểu đúng là (1), (4), (5).
(2) Sai, do Ba không tác dụng với nước dù ở nhiệt độ cao, Mg không tác dụng với nước ở nhiệt độ thường.
(3) Sai, do quặng boxit có thành phần chính là Al2O3, Na3AlF6 là criolit.
(6) Sai, chỉ làm mềm được nước cứng tạm thời.
Câu 33:
Kết quả thí nghiệm với các dung dịch muối clorua riêng biệt của các cation: X+, Y2+, Z3+, T3+ được ghi vào bảng dưới đây:
| Mẫu thử | Thí nghiệm | Hiện tượng |
| X+ | Tác dụng với dung dịch NaOH | Có mùi khai |
| Y2+ | Tác dụng với dung dịch Na2SO4 | Kết tủa trắng |
| Z3+ | Nhỏ từ từ dung dịch NH3 vào đến dư | Kết tủa keo trắng |
| T3+ | Tác dụng với dung dịch Na2CO3 | Kết tủa nâu đỏ và có khí không màu thoát ra |
Các cation X+, Y2+, Z3+, T3+ lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Y2+ tác dụng với dung dịch Na2SO4 có kết tủa trắng loại B và D.
Z3+ tác dụng với dung dịch NH3 dư ® tạo kết tủa keo trắng không tan loại C.
Câu 34:
Cho các phát biểu sau:
(a) Phản ứng thủy phân este trong môi trường kiềm là phản ứng một chiều.
(b) Trong phản ứng điều chế este, người ta thường thêm cát (SiO2) để xúc tác cho phản ứng.
(c) Hiđro hóa glucozơ (xt, t°), thu được sobitol.
(d) "Da giả" được tổng hợp từ phản ứng trùng ngưng amino axit.
(e) Thủy phân hoàn toàn các peptit trong dung dịch kiềm, thu được các amino axit.
(f) Dung dịch các amin có vòng benzen đều không làm đổi màu quỳ tím.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
(a) Đúng.
(b) Sai, trong phản ứng điều chế este, người ta thường cho thêm H2SO4 đặc để xúc tác cho phản ứng.
(c) Đúng.
(d) Sai, "Da giả" được tổng hợp từ phản ứng trùng hợp vinyl clorua.
(e) Sai, thủy phân hoàn toàn các peptit trong dung dịch kiềm, thu được muối của các amino axit.
(f) Sai, C6H5CH2NH2 làm quỳ tím hoá xanh.
Câu 35:
Cho 100 ml dung dịch hỗn hợp X chứa A12(SO4)3 a M, MgCl2 b M, và H2SO4 c M. Đổ từ từ V lít dung dịch hỗn hợp Y gồm KOH 0,6M và Ba(OH)2 0,2M, kết quả thí nghiệm thu được cho trong hình sau.
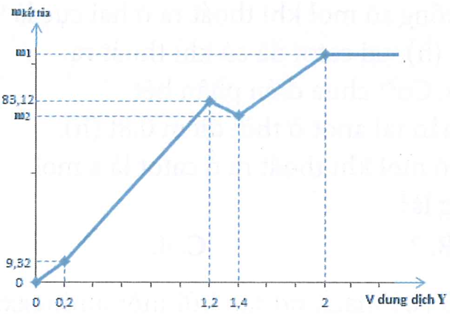
Giá trị m1 + m2 là:
 Xem đáp án
Xem đáp án
Đáp án C
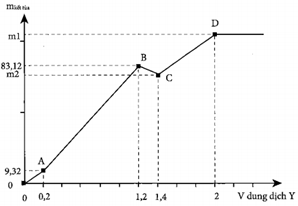
Từ dung dịch Y:
Từ A: Thông qua Có thể coi đoạn đầu, chưa có kết tủa hidroxit
Tại điểm B, toàn bộ và kết tủa hết. (khi không có điểm gãy, Al3+ và Mg2+ sẽ kết tủa đồng thời)
Từ số mol
Lúc này:
Vì sau đó kết tủa còn tăng dư.
Từ khối lượng kết tủa:
Hệ:
Tại C: Al(OH)3 tan hết:
Tại D: Kết tủa cực đại,
Câu 36:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư;
(b) Sục khí Cl2 vào dung dịch FeCl2;
(c) Dẫn khí H2 dư qua bột CuO nung nóng;
(d) Cho Na vào dung dịch CuSO4 dư;
(e) Nhiệt phân AgNO3;
(g) Đốt FeS2 trong không khí;
(h) Điện phân dung dịch CuSO4 với điện cực trơ;
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là:
 Xem đáp án
Xem đáp án
Đáp án A
Các phản ứng xảy ra như sau:
Sau khi kết thúc các phản ứng, thí nghiệm thu được kim loại: (c), (e), (h).
Số thí nghiệm thu được kim loại là 3.
Câu 37:
Nung nóng 1,26 mol hỗn hợp X gồm Mg, Fe(NO3)2 và FeCO3 trong một bình kín đến khối lượng không đổi thu được chất rắn Y và 13,44 lít hỗn hợp khí Z (đktc) có tỉ khối đối với H2 là 22,8. Cho toàn bộ chất rắn Y tác dụng với dung dịch hỗn hợp 2,7 mol HCl và 0,38 mol HNO3 đun nhẹ thu được dung dịch A và 7,168 lít hỗn hợp khí B (đktc) gồm NO và N2O. Cho toàn bộ dung dịch A tác dụng với một lượng dư dung dịch AgNO3 thu được 0,448 lít NO (đktc) là sản phẩm khử duy nhất và m gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Vì Y còn tính khử nên Z không chứa O2.
Theo đề ta có:
Quy đổi Y thành và đặt với a + b = 0,32 (1)
Cho A tác dụng với AgNO3 thoát khí NO (0,02 mol) nên A chứa H+ dư (0,08) và A không chứa NO3-
và
Từ (1), (2), (3) suy ra:
Câu 38:
Cho các chất hữu cơ sau đây: X là axit cacboxylic không no, đơn chức (chứa 2 liên kết ); Y là axit cacboxylic no, đơn chức; Z là ancol no; T là este mạch hở, 3 chức, tạo từ X, Y và Z (chứa 5 liên kết ). Cho 26,5 gam hỗn hợp E gồm X, Y, Z, T tác dụng vừa đủ với 250 ml dung dịch NaOH 1M, thu được 20,9 gam hỗn hợp muối F và 13,8 gam ancol Z. Toàn bộ Z tác dụng với Na dư, thu được 5,04 lít H2 (đktc). Nung F với NaOH dư và CaO ở nhiệt độ cao, thu được hỗn hợp khí Q có tỉ khối so với H2 là 8,8. Các phản ứng xảy ra hoàn toàn. Phần trăm theo khối lượng của X trong E gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
Theo đề, X là axit không no, có 1 liên kết C=C đơn chức và T là este ba chức được tạo thành từ 2 phân tử chất X, 1 phân tử chất Y và 1 ancol Z ba chức.
Từ phản ứng của Z với Na
Khi cho E tác dụng với
Ta có: Muối thu được gồm HCOONa hoặc CH3COONa và RCOONa.
+ Xét muối HCOONa (a mol) và RCOONa (b mol)
Vậy X là
Câu 39:
Điện phân (với điện cực trơ, màng ngăn) dung dịch chứa hỗn hợp CuSO4 và NaCl (tỉ lệ mol 1:1) bằng dòng điện một chiều có cường độ ổn định. Sau t (h), thu được dung dịch X và sau 2t (h), thu được dung dịch Y. Dung dịch X tác dụng với bột Al dư, thu được a mol khí H2. Dung dịch Y tác dụng với bột Al dư, thu được 4a mol khí H2. Cho các phát biểu sau:
(1) Tại thời điểm 2t (h), tổng số mol khí thoát ra ở hai cực là 9a mol.
(2) Khi thời gian là 1,75t (h), tại catot đã có khí thoát ra.
(3) Tại thời điểm 1,5t (h), Cu2+ chưa điện phân hết.
(4) Nước bắt đầu điện phân tại anot ở thời điểm 0,8t (h).
(5) Tại thời điểm 2t (h) số mol khí thoát ra ở catot là a mol.
Số phát biểu không đúng là?
 Xem đáp án
Xem đáp án
Đáp án A
Xét tại thời điểm t(h); dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1 : 1
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e Cu0; ở anot: 2Cl- - 2e Cl2 ; 2H2O - 4e 4H+ + O2.
Dung dịch X phản ứng với Al sinh ra a mol H2 lượng H+ đã phản ứng = 2a mol.
Số mol e trao đổi = b + 2a mol.
■ Xét tại thời điểm 2t(h), số mol e trao đổi = 2 (2a + b) mol.
Ở catot:
Cu2+ + 2e Cu0 ; 2H2O + 2e 2OH- + H2
Ở anot: 2Cl- - 2e Cl2 ; 2H2O - 4e 4H+ + O2.
Số mol e Cl- nhường = b mol số mol e H2O nhường = 4a + b mol Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol Số mol e H2O nhận = 4a mol số mol OH- = 4a mol. Trong dung dịch có OH- và H+ nên: H+ + OH- H2O.
Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ Al3+ + H2.
Số mol H2 == 4a a : b = 1 : 8
■ Xét các nhận định:
+ Tại thời điểm 2t(h) số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25(4a + b), thay b = 8a số mol khí thoát ra = 9a mol (1) đúng.
+ Tại thời điểm 1,75t(h) thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết số mol e Cu2+ nhận = 2b mol <1,75 (2a + b) 0,25b < 3,5a b : a < 14 đúng (do b : a = 8) (2) đúng.
+ Tại thời điểm 1,5t(h) thì số mol e trao đổi =1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
0,5b < 3a a : b > sai (do a : b = 1 : 8) Cu2+ chưa điện phân hết (3) đúng.
+ Tại thời điểm 0,8t (h) thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- vừa bị điện phân hết số mol e Cl- nhường là b mol = 0,8 (2a + b)
0,2b = 1,6 a a : b = đúng (do a : b = 1: 8) (4) đúng.
+ Tại thời điểm 2t (h) thì số mol H2 sinh ra = 2a mol (5) sai.
Câu 40:
Peptit X (CxHyOzN6) mạch hở tạo bởi một aminoaxit no chứa 1 nhóm NH2 và 1 nhóm COOH. Để phản ứng hết 19 gam hỗn hợp E chứa X, este Y (CnH2n-2O4) và este Z (CmH2m-4O6) cần 300 ml dung dịch NaOH 1M thu được hỗn hợp muối và hỗn hợp gồm 2 ancol có cùng số cacbon. Lấy toàn bộ muối nung với vôi tôi xút được hỗn hợp F chứa 2 khí có tỉ khối so với H2 là 3,9. Đốt cháy 19 gam E cần 0,685 mol O2 thu được 9,72 gam H2O. Thành phần phần trăm khối lượng của X trong E gần nhất với:
 Xem đáp án
Xem đáp án
Đáp án C
Nhận thấy Y, Z đều là hợp chất no, đa chức.
F chứa 2 khí có F chứa H2 muối chứa HCOONa.
F chứa 2 khí, 1 khí sinh ra từ muối của amino axit, 1 khí sinh ra từ muối của este.
Este Y, Z có dạng (HCOO)nR Quy đổi hỗn hợp E theo đồng đẳng hóa:
BTKL khi đốt cháy E:
Ta có hệ phương trình:
Do d=0 nên các chất trong E chính là các chất mà ta quy đổi được X là Gly6.
