Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (30 đề)
Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 12)
-
14710 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Sục từ từ đến dư khí X vào nước vôi trong. Quan sát thấy lúc đầu có kết tủa trắng tăng dẩn, sau đó kết tủa tan ra. Khí X là
 Xem đáp án
Xem đáp án
Đáp án B
Khí X là khí CO2
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Khi sục tiếp CO2 dư thì kết tủa CaCO3 bị hòa tan theo phương trình
CO2 + CaCO3 + H2O → Ca(HCO3)2
Câu 2:
Chất khí nào sau đây có mùi khai, xốc và tan tốt trong nước?
 Xem đáp án
Xem đáp án
Đáp án C
Chất X là khí NH3
Câu 3:
Kim loại nhôm không phản ứng được với dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
Al thụ động trong H2SO4 đặc, nguội.
Chú ý: Al còn thụ động trong HNO3 đặc, nguội.
Câu 4:
Dung dịch Na2CO3 tác dụng được với dung dịch
 Xem đáp án
Xem đáp án
Đáp án D
Na2CO3 tác dụng được với CaCl2
Na2CO3 + CaCl2 → CaCO3 ↓ + 2NaCl
Câu 5:
Polime nào sau đây trong thành phần chứa nguyên tố nitơ?
 Xem đáp án
Xem đáp án
Đáp án A
A. Polime Tơ trong thành phần nguyên tố chứa ni tơ.
B. Poli(vinyl clorua). chứa các nguyên tố C, H, Cl.
C. Polietilen. Là chứa các nguyên tố C, H.
D. Cao su buna thành phần các nguyên tố gồm: C, H:
Câu 6:
Cho kim loại Cu lần lượt vào các dung dịch: HNO3 (loãng), FeCl3, AgNO3, HCl. Số trường hợp có phản ứng hóa học xảy ra là
 Xem đáp án
Xem đáp án
Đáp án A
Cu phản ứng được với tất cả 3 dung dịch HNO3(loãng), FeCl3, AgNO3
2Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag ↓
Chú ý: Trong dãy điện hóa: Tính khử , tính oxi hóa Cu khử được trong dung dịch muối.
Câu 7:
Cho các kim loại Al, Fe, Au, Ag. Kim loại dẫn điện kém nhất là:
 Xem đáp án
Xem đáp án
Đáp án D
Thứ tự dẫn điện: Ag > Au > Al > Fe => Fe là kim loại dẫn điện kém nhất
Câu 8:
Axit aminoaxetic không tác dụng với dung dịch nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Axit aminoaxit có nhóm -NH2 và -COOH trong phân tử nên phản ứng được với HCl, H2SO4 loãng, NaOH.
KHÔNG phản ứng được với KCl.
Câu 9:
Thuốc thử được dùng để phân biệt dung dịch Gly-Ala-Gly với dung dịch Gly-Ala là
 Xem đáp án
Xem đáp án
Đáp án A
+ Gly-Ala-Gly có 2 liên kết peptit nên tác dụng được với Cu(OH)2 cho dung dịch màu tím.
+ Gly-Ala chỉ có 1 liên kết peptit nên không tác dụng được với Cu(OH)2.
Câu 10:
Chất nào sau đây không tạo kết tủa khi cho vào dung dịch AgNO3?
 Xem đáp án
Xem đáp án
Đáp án A
HNO3 không phản ứng được với AgNO3
Câu 11:
Sản phẩm của phản ứng este hóa giữa ancol metylic và axit propionic là
 Xem đáp án
Xem đáp án
Đáp án C
PTHH: CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
Câu 12:
Photpho thể hiện tính oxi hóa trong phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
P thể hiện tính oxi hóa khi p.ứ với chất khử, số oxi hóa của P sau phản ứng giảm
Số oxi hóa của P giảm từ 0 xuống P thể hiện tính oxi hóa
Câu 13:
Nhúng thanh Fe vào dung dịch CuSO4. Sau một thời gian, quan sát thấy?
 Xem đáp án
Xem đáp án
Đáp án C
PTHH: Fe + CuSO4 (dd màu xanh) → FeSO4 + Cu ↓ (đỏ)
Cu sinh ra bám vào thanh sắt hiện tượng: Thanh Fe có màu đỏ và dung dịch nhạt dần màu xanh.
Câu 14:
Cho 31,6 gam hỗn hợp X gồm Fe và Fe3O4 tan hết trong dung dịch HCl, thu được 2,24 lít khí H2 (đktc) và dung dịch Y chỉ chứa 60,7 gam hỗn hợp muối. Khối lượng của Fe3O4 có trong X là
 Xem đáp án
Xem đáp án
Đáp án A
Đặt
BTNT “H”:
BTKL:
BTNT “O”:
Câu 15:
Một số este có mùi thơm, không độc, được dùng làm chất tạo mùi hương trong công nghiệp thực phẩm, mỹ phẩm. Benzyl axetat có mùi thơm của loại hoa (quả) nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án D
isoamyl axetat (CH3COOCH2CH2CH(CH3)CH3) có mùi chuối chín etyl butirat
(CH3CH2CH2COOC2H5) có mùi thơm của dứa
Geranyl axetat (CH3COOC10H17) có mùi thơm của hoa hồng
Benzyl axetat (CH3COOCH2C6H5) có mùi thơm của hoa nhài
Câu 16:
Phương trình hóa học nào sau đây viết sai?
 Xem đáp án
Xem đáp án
Đáp án A
A. Sai, sửa lại 2NaHCO3 Na2CO3 + CO2 + H2O
Câu 18:
Tơ nào sau đây thụộc loại tơ tổng hợp?
 Xem đáp án
Xem đáp án
Đáp án C
Tơ axetat là tơ bán tổng hợp
Tơ tằm, sợi bông là tơ thiên nhiên
Tơ nitrin là tơ tổng hợp
Câu 19:
Cho 0,1 mol (C17H35COO)3C3H5 tác dụng hoàn toàn với dung dịch NaOH (dư, đun nóng), thu được m gam glixerol. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
PTTH:
(C17H35COO)2CH3 + 3NaOH → C17H35COONa + C3H5(OH)3
0,1 → 0,1 (mol)
Câu 20:
Kết quả thí nghiệm của các dung dịch X, Y, Z, T với thuốc thử được ghi ở bảng sau:
|
Mẫu thử |
Thuốc thử |
Hiện tượng |
|
X |
Quỳ tím |
Chuyển màu hồng |
|
Y |
Dung dịch I2 |
Có màu xanh tím |
|
Z |
Dung dịch AgNO3 trong NH3 |
Kết tủa Ag |
|
T |
Nước brom |
Kết tủa trắng |
Các dung dịch X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án D
- Axit glutamic làm quỳ tím chuyển thành màu hồng
- Cho iot vào tinh bột thấy chuyển màu xanh tím
- Glucozơ tác dụng dung dịch AgNO3 trong NH3, thu được Ag
- Anilin tác dụng nước brom, thu được kết tủa màu trắng.
Câu 21:
Từ 16,20 tấn xelulozơ sản xuất được m tấn xenlulozơ trinitrat (biết hiệu suất phản ứng tính theo xenlulozơ là 90%). Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Vì
C6H7O2(OH)3 + 3HNO3 C6H7O2(NO2)3 + 3H2O
0,09 → 0,09 (mol)
.
Câu 22:
Hỗn hợp X gồm etyl axetat, đimetyl ađipat, vinyl axetat, anđehit acrylic và ancol metylic (anđehit acrylic và ancol metylic có số mol bằng nhau). Đốt cháy hoàn toàn 19,16 gam X cần vừa đủ 1,05 mol O2, dẫn toàn bộ sản phẩm cháy vào nước vôi trong dư, thu được dung dịch có khối lượng giảm m gam so với dung dịch ban đầu. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
nC3H4O = nCH4O → Gộp thành C4H8O2
C8H14O4 = C4H8O2 + C4H6O2
→ X gồm C4H8O2 (a) và C4H6O2 (b)
mX = 88a + 86b = 19,16
nO2 = 5a + 4,5b = 1,05
→ a = 0,12 và b = 0,1
nCO2 = 4a + 4b = 0,88 (mol)
nH2O = 4a + 3b = 0,78 (mol)
Ca(OH)2 dư → nCaCO3 = nCO2 = 0,88 (mol)
Δm = mCO2 + mH2O – mCaCO3 = (gam)
→ Giảm 35,24.
Câu 23:
Chất nào sau đây là chất khí ở điểu kiện thường?
 Xem đáp án
Xem đáp án
Đáp án A
Metylamin (CH3NH2) là chất khí ở điều kiện thường. Anilin, Etyl axetat ở thể lỏng ở đk thường Alanin ở thể rắn ở điều kiện thường
Câu 24:
Saccarozơ là loại đường phổ biến nhất, có nhiều trong cây mía, củ cải đường và hoa thốt nốt. Công thức phân tử của saccarozơ là
 Xem đáp án
Xem đáp án
Đáp án C
Công thức phân tử của saccarozơ C12H22O11
Câu 25:
Cho các phát biểu sau:
(a) Thủy phân saccarozơ trong môi trường kiềm thu được glucozơ và fructozơ.
(b) Muối phenylamoni clorua không tan trong nước.
(c) Trong phân tử peptit mạch hở Gly- Ala-Gly có 4 nguyên tử oxi.
(d) Lực bazơ của metylamin lớn hơn amoniac.
(e) Quá trình lưu hóa cao su tạo ra cầu nối -S-S- giữa các mạch cacbon không phân nhánh tạo thành mạch phân nhánh.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
a) đúng
b) sai, C6H5NH3Cl tan trong nước
c) đúng, H2N-CH2-CONHCH(CH3)CO-NH-CH2-COOH → có 4 nguyên tử oxi
d) đúng
e) sai, Bản chất của quá trình lưu hóa cao su là tạo ra cầu nối -S-S- giữa các mạch cao su không phân nhánh tạo thành mạng không gian
→ có 3 phát biểu đúng.
Câu 26:
Cho các sơ đồ phản ứng sau:
C8H14O4 + NaOH → X1 + X2 + H2O
X1 + H2SO4 → X3 + Na2SO4
X3 + X4 → Nilon-6,6 + H2O
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án C
C3H14O4 + NaOH → X1 + X2 + H2O (1)
X1 + H2SO4 → X3 + Na2SO4 (2)
X3 + X4 → Nilon-6,6 + H2O (3)
C8H14O4 có k = (8.2 + 2 – 14)/2 = 2
Từ (2) suy ra X3 là axit
Từ (3) suy ra X3 là axit ađipic HOOC-[CH2]4-COOH
Suy ra X4 là hexametilen điamin [H2N-CH2]6-NH2
Từ (2) suy ra X1 là NaOOC-[CH2]4-COONa
Từ (1) → CTCT phù hợp của C8H14O4 là HOOC-[CH2]4-COOC2H5 (tạp chức axit và este)
Suy ra X là C2H5OH
A. Sai vì nhiệt độ sôi C2H5OH < CH3COOH
B. Sai vì X2, X3, X4 đều mạch thẳng không phân nhánh
C. Đúng vì muối NaOOC-[CH2]4-COONa có nhiệt độ nóng chảy cao hơn HOOC-[CH2]4-COOH
D. Sai, vì H2N-[CH2]6-NH2 làm quỳ tím chuyển sang màu xanh
Câu 27:
Hòa tan hoàn toàn 28,4 gam hỗn hợp gồm Cu, FeCl2, Fe(NO3)2 và 0,02 mol Fe3O4 trong 560 ml dung dịch HCl l,0M, thu được dung dịch X. Cho dung dịch AgNO3 dư vào X thì có 0,76 mol AgNO3 tham gia phản ứng, thu được m gam kết tủa và thoát ra 0,448 lít khí (đktc). Biết các phản ứng xảy ra hoàn toàn, NO là sản phẩm khử duy nhất của trong các quá trình. Giá trị của m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
BTNT “N”:
Đặt a, b là số mol Cu và FeCl2
(1)
BTNT “Cl”:
BTNT Ag:
Bảo toàn electron:
Từ (1) và (2) và b = 0,08
Câu 28:
Thực hiện các thí nghiệm sau:
(a) Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp).
(b) Cho FeO vào dung dịch HNO3 loãng dư, đun nóng.
(c) Cho Si vào dung dịch NaOH dư.
(d) Cho dung dịch NaHSO4 vào dung dịch NaHCO3.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch H2SO4 loãng.
(g) Cho đinh sắt vào dung dịch H2SO4 đặc, nóng, dư.
Sau khi các phản ứng xảy ra, số thí nghiệm sinh ra chất khí là
 Xem đáp án
Xem đáp án
Đáp án B
(a) 2NaCl + 2H2O 2NaOH + H2 ↑ + Cl2 ↑
(b) FeO + HNO3 → Fe(NO3)3 + NO ↑ + H2O
(c) Si + 2NaOH + H2O → Na2SiO3 + 2H2 ↑
(d) NaHSO4 + NaHCO3 → Na2SO4 + CO2 ↑ + H2O
(e) 9Fe(NO3)2 + 6H2SO4 → 2Fe2(SO2)3 + 5Fe(NO3)3 + 3NO ↑ + 6H2O
(g) 2Fe + 6H2SO4 đặc Fe2(SO4)3 + 3SO2 ↑ + 6H2O
cả 6 phản ứng đều thu được khí.
Câu 29:
Hỗn hợp X gồm CH4, C2H4, C3H4, CH4 và H2. Dẫn X qua Ni nung nóng, sau khi các phản ứng hoàn toàn, thu được hỗn hợp Y có tỉ khối so với NO2 là 1. Cho 2,8 lít Y (đktc) tác dụng tối đa 36 gam brom trong dung dịch. Cho 2,8 lít X (đktc) tác dụng tối đa X gam brom trong dung dịch. Giá trị của X là
 Xem đáp án
Xem đáp án
Đáp án D
Độ không no của Y là:
Vì phản ứng giữa hỗn hợp hidrocacbon và H2 là pư hoàn toàn, Y có phản ứng với dd Br2
Y còn hidrocacbon không no H2 pư hết
Đặt công thức chung của Y là ta có:
Phản ứng cộng họ không làm thay đổi số nguyên tử cacbon nên số cacbon trong X là 3,4
→ Đặt công thức chung của hidrocacbon có trong X:
0,125 0,0756 0,125 (mol)
Ta có: 0,2 mol X chứa 0,125 mol
→ 0,125 mol X chứa 5/64 mol
Xét: X + Br2
5/64 → 0,1875 (mol)
→
Câu 30:
Cho 2,4 gam Mg tác dụng hoàn toàn với 250 ml dung dịch chứa FeSO4 0,2M và CuSO4 0,3M, thu được m gam chất rắn. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Ta có: (Mg nhường)
→ Mg pư hết, muối dư
Câu 31:
Đốt cháy hoàn toàn X mol este đơn chức, mạch hở E cần vừa đủ V lít O2 (đktc), thu được y mol CO2 và z mol H2O. Biết X = y - z và V = 100,8x. Số chất thỏa mãn điều kiện của E là
 Xem đáp án
Xem đáp án
Đáp án A
Do x=y-z → X là este không no có 1 liến kết đôi C=C.
Do bài toán dưới dạng tổng quát nên ta tự chọn lượng chất: x = 1 mol
(lít)
BTNT “O”:
(1)
Mà theo đề bài: x = y - z = 1 (2)
Giải (1) và (2) được y = 4 và z = 3
Vậy X có CTPT là C4H6O
Các CTCT thỏa mãn là:
HCOOC=C-C (cis-trans)
HCOOC-C=C HCOOC(C)=C
C-COOC-C
C=C-COO-C
Vậy có 6 chất thỏa mãn điều kiện của X.
Câu 32:
Cho m gam Mg vào 500 ml dung dịch gồm H2SO4 0,4M và Cu(NO3)2. Sau khi phản ứng xảy ra hoàn toàn, thu được 1,12 lít (đktc) hỗn hợp khí X gổm N2, H2, dung dịch Y và còn lại 2,0 gam hỗn hợp kim loại. Tỉ khối của X so với H2 là 6,2. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Đặt và (mol)
(1)
(2)
Giải (1) và (2) được: a = 0,02 và b = 0,03
Do sau phản ứng thu được khí H2 và hỗn hợp KL (Mg dư và Cu) nên dung dịch Y không chứa và
Y chứa (x mol); (y mol) và (0,2 mol)
BTNT “N”:
BTĐT cho dung dịch Y: (3)
BTe:
(4)
Giải (3) và (4) thu được x = 0,195 và y = 0,01
Câu 33:
Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Cho bột Zn vào lượng dư dung dịch HCl.
(c) Dẫn khí H2 dư qua ống sứ chứa bột CuO nung nóng.
(d) Cho B. vào lượng dư dung dịch CuSO4.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
 Xem đáp án
Xem đáp án
Đáp án B
(1) Mg + Fe2(SO4)3 dư → MgSO4 + 2FeSO4
→ không thu được kim loại
(2) Zn + 2HCl dư → ZnCl2 + H2
→ không thu được kim loại
(3) H2 dư + CuO → Cu + H2O
→ thu được kim loại Cu
(4) Ba + 2H2O → Ba(OH)2 + H2
CuSO4 + Ba(OH)2 → Cu(OH)2 + BaSO4
→ không thu được kim loại
(5) Fe(NO3)2 + AgNO3 + Fe(NO3)3 + Ag
→ thu được kim loại Ag
Vậy có 2 thí nghiệm thu được kim loại sau phản ứng là (3) và (5).
Câu 34:
Hòa tan hết m gam hỗn hợp E gồm Al, Mg, MgO vào dung dịch chứa KHSO4 và 0,34 mol HNO3, thu được 8,064 lít (đktc) hỗn hợp khí X gồm NO, H2 và NO2 (tỉ lệ mol tương ứng 10: 5: 3) và dung dịch Y chỉ chứa các muối. Cho dung dịch NaOH dư vào Y thì có 2,28 mol NaOH tham gia phản ứng, thu được 17,4 gam kết tủa. Phần trăm khối lượng Mg trong E là
 Xem đáp án
Xem đáp án
Đáp án A
Dựa vào tỉ lệ suy ra
Sau khi cho Y tác dụng với NaOH dư thu được kết tủa là Mg(OH)2
BTNT “N”:
Đặt
BTĐT dd Y:
BTKL:
Đặt và (mol)
(1)
(2)
Giải hệ (1) và (2) được a = b = 0,15 mol
Câu 35:
Có 4 dung dịch riêng biệt: H2SO4 1M, HNO3 1M, NaOH 1M, HCl 1M. Cho 5 ml mỗi dung dịch vào 4 ống nghiệm và khí hiệu ngẫu nhiên là X, Y, Z, T. Tiến hành thí nghiệm với các dung dịch X trên, kết quả thu được như sau:
- Hai dung dịch X và Y tác dụng được với FeSO4.
- Dung dịch Z có pH thấp nhất trong 4 dung dịch.
- Hai dung dịch Y và T phản ứng được với nhau.
Các dung dịch X, Y, Z, T lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
- 2 dung dịch tác dụng được với FeSO4: HNO3, NaOH (X, Y)
- Dung dịch có pH thấp nhất (nồng độ cao nhất) là H2SO4 → Z là H2SO4
- T là HCl
- Y phản ứng được với T nên Y là NaOH
→ X là HNO3
Vậy: X: HNO3; Y: NaOH; Z: H2SO4; T: HCl
Câu 36:
Nhỏ từ từ dung dịch Ba(OH)2 1M vào dung dịch chứa x mol H2SO4 và y mol Al2(SO4)3. Khối lượng kết tủa (m gam) phụ thuộc vào thể tích dung dịch Ba(OH)2 (V ml) được biểu diễn bằng đồ thị sau:
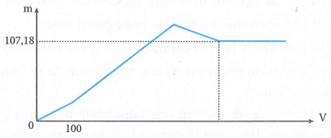
Giá trị của x và y lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
Đoạn 1:
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
0,1……0,1
→ x = 0,1
Khi Al(OH)3 bị hòa tan hết thì kết tủa chỉ còn lại BaSO4
nBaSO4 = x + 3y = 0,46 → y = 0,12
Câu 37:
Hỗn hợp X gồm một ancol đơn chức, một axit cacboxylic đơn chức và một axit cacboxylic hai chức (đều no, mạch hở). Đun nóng 15,34 gam X (xúc tác H2SO4 đặc), sau một thời gian thu được 2,34 gam H2O và hỗn hợp Y gồm các hợp chất hữu cơ. Đốt cháy hoàn toàn Y, thu được 18,92 gam CO2 và 7,20 gam H2O. Cho toàn bộ Y tác dụng tối đa với dung dịch chứa 11,20 gam KOH, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Do các chất đều no, mạch hở nên ta có thể quy đổi hỗn hợp X thành:
HCOOH: a
(COOH)2: b
CH2: c
CH3OH: d
(1)
(2)
(3)
(4)
Giải hệ (1) (2) (3) (4)
Ta thấy c < d CH2 nằm trong axit, không nằm trong ancol (ancol là CH3OH)
Muối gồm: HCOOK: 0,06 (COOK)2: 0,07; CH2: 0,06
.
Câu 38:
Hỗn hợp M gồm 3 peptit X, Y, Z (đều mạch hở) với tỉ lệ mol tương ứng là 4: 3: 2 có tổng số liên kết peptit trong 3 phân tử X, Y, Z bằng 12. Thủy phân hoàn toàn 78,10 gam M, thu được 0,40 mol A1 0,22 mol A2 và 0,32 mol A3. Biết A1, A2, A3 đều có dạng H2NCnH2nCOOH. Mặt khác, cho X gam M phản ứng vừa đủ với NaOH, thu được y gam muối. Đốt cháy hoàn toàn y gam muối cần vừa đủ 32,816 lít O2 (đktc), thu được Na2CO3, CO2, H2O và N2. Giá trị của y gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án C
- Gộp peptit: 4X + 3Y + 2Z thành X4Y3Z2 + 8H2O
Peptit có số liên kết peptit là: 47k – 1
- Chặn khoảng giá trị của số liên kết peptit để xác định kì
Giả sử số liên kết peptit của X, Y, Z lần lượt là x, y, z
Số liên kết peptit trong peptit mới X4Y3Z2 là 4x + 3y + 2z + 8
+ Min: Khi x = 1; y = 1; z = 10 số liên kết là 4.1 + 3.1 + 2.10 + 8 = 35
+ Max: Khi x = 10; y = 1; z = 1 số liên kết là 4.10 + 3.1 + 2.1 + 8 = 53
(số mol là 0,4/20 = 0,02 mol)
- Do các amino axit đều có dạng H2NCnH2nCOOH nên ta quy đổi hỗn hợp thành CONH, CH3, H2O (bằng số mol peptit).
BTKL:
BTKL:
Tỉ lệ: Đốt 112,46 gam muối cần 4,395 mol O2
y gam 32,816/22,4 mol
y = 37,487 (g) gần nhất với 37,45 gam.
Câu 39:
Tiến hành thí nghiệm điều chế isoamyl axetat theo các bước sau đây:
Bước 1: Cho 1 ml CH3CH(CH3)CH2CH2OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 - 6 phút ở .
Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm.
Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án C
A. Sai, H2SO4 đặc có vai trò làm chất xúc tác, hút ẩm và làm tăng hiệu suất của phản ứng.
B. Sai, Mục đích chính của việc thêm dung dịch NaCl bão hòa là để tạo hiện tượng tách lớp rõ ràng hơn.
C. Đúng, Vì đây là phản ứng thuận nghịch.
D. Sai, Chất lỏng trong ống nghiệm trở nên tách lớp.
Câu 40:
Ở điều kiện thường, thực hiện thí nghiệm với khí X như sau:
Nạp đẩy khí X vào bình thủy tinh, rồi đậy bình bằng nắp cao su. Dùng ống thủy tinh vuốt nhọn đẩu nhúng vào nước, xuyên ống thủy tinh qua nắp cao su rồi lắp bình thủy tinh lên giá thí nghiêm như hình vẽ. cho các phát biểu sau:
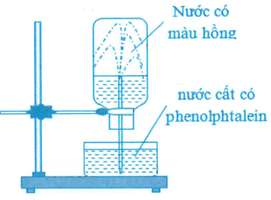
(a) Khí X có thể là amoniac hoặc metyl amin.
(b) Nếu khí X là HCl thì nước không thể phun vào trong bình thủy tinh.
(c) Tia nước phun mạnh vào trong bình thủy tinh do áp suất trong bình cao hơn áp suất không khí.
(d) Nếu thay thuốc thử phenolphtalein bằng quỳ tím thì nước trong bình sẽ có màu xanh.
(e) So với điều kiện thường, khí X tan trong nước tốt hơn khi đun nóng.
(g) Có thể thay nước cất chứa phenolphtalein bằng dung dịch NH3 bão hòa chứa phenolphtalein.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án B
(a) Đúng, Amoniac hoặc metyl amin đều tan nhiều trong nước cho môi trường bazơ, làm phenolphtalein chuyển sang màu hồng.
(b) Sai, Khí X là HCl tan nhiều trong nước, làm áp suất trong bình giảm nên nước vẫn phun vào trong bình thủy tinh.
(c) Sai, Do khí tan nhiều trong nước nên tia nước phun mạnh vào bình do áp suất trong binh thấp hơn áp suất không khí.
(d) Đúng, Khí X (NH3, CH3NH2,...) tan trong nước cho môi trường bazơ làm quỳ tím chuyển màu xanh.
(e) Sai, Khi đun nóng thì khả năng hòa tan của khí trong nước giảm.
(g) Sai, Dung dịch NH3 đã bão hòa thì không thể hòa tan được khí X, cho nên không có hiện tượng nước phun vào bình.
