Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (30 đề)
Đề thi thử THPT Quốc gia môn Hóa học năm 2022 có đáp án (Đề số 14)
-
14722 lượt thi
-
40 câu hỏi
-
60 phút
Danh sách câu hỏi
Câu 1:
Tên gọi của hợp chất có công thức cấu tạo là
 Xem đáp án
Xem đáp án
Đáp án B
Isopren thuộc loại Ankadien, trong phân tử có 2 liên kết đôi isopren có tên thay thế (danh pháp IUPAC) là 2-metylbuta-1,3-dien
Câu 2:
Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm −OH?
 Xem đáp án
Xem đáp án
Đáp án B
C3H5(OH)3 glixerol hay Propan-1,2,3-triol
Câu 3:
Kim loại có khối lượng riêng nhỏ nhất là
 Xem đáp án
Xem đáp án
Đáp án D
Có 5 chú ý về kim loại cần ghi nhớ.
- Kim loại có nhiệt độ nóng chảy thấp nhất. Hg
- Kim loại có nhiệt độ nóng chảy cao nhất. W
- Kim loại cứng nhất. Cr
- Kim loại nhẹ nhất. Li
- Kim loại dẫn điện tốt nhất. Ag
Câu 4:
Polime nào sau đây được điều chế bằng phản ứng trùng hợp?
 Xem đáp án
Xem đáp án
Đáp án C
A, D: điều chế bằng phản ứng trùng ngưng
C: tơ nhân tạo (bán tổng hợp)
Câu 5:
Khi bị nhiệt phân, muối nitrat nào sau đây tạo sản phẩm là kim loại?
 Xem đáp án
Xem đáp án
Đáp án A
Chú ý phản ứng
Ngoài ra Hg(NO3)2 cũng bị nhiệt phân ra kim loại Hg, NO2, O2
Câu 6:
Dung dịch NaHCO3 không tác dụng với dung dịch
 Xem đáp án
Xem đáp án
Đáp án C
Các phản ứng như sau:
A.
B.
D.
Câu 7:
Kim loại nào dưới đây không tan trong nước ở điều kiện thường?
 Xem đáp án
Xem đáp án
Đáp án B
Kim loại kiềm, kiềm thổ (trừ Mg, Be) mới tan được trong nước ở điều kiện thường.
Câu 8:
Thủy phân hoàn toàn xenlulozo trong môi trường axit, thu được chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Xelulozo được cấu tạo từ các đơn vị nên khi thủy phân sẽ tạo ra glucozơ
Câu 10:
Trong các cặp chất dưới đây, cặp chất nào cùng tồn tại trong một dung dịch?
 Xem đáp án
Xem đáp án
Đáp án D
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất một trong các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
A.
B.
C.
D. Không xảy ra phản ứng trao đổi vì không sinh ra chất kết tủa, chất khí hoặc chất điện ly yếu.
Câu 11:
X là một loại tơ. Một mắt xích cơ bản của X có khối lượng là 226u (hau đvC). X có thể là
 Xem đáp án
Xem đáp án
Đáp án B
Cần nhớ công thức của các polime
A. Xenlulozo triaxetat.
B. Tơ nilon - 6,6.
C. Poli metyl acrylat.
D. Tơ nitron (hay olon).
Câu 12:
Cho hỗn hợp gồm K2O, BaO, Al2O3 và FeO vào lượng nước dư, thu được dung dịch X và chất rắn Y.
Sục khí CO2 đến dư vào dung dịch X, thu được kết tủa là
 Xem đáp án
Xem đáp án
Đáp án C
Dung dịch X chứa các anion OH- và
Sục CO2 ta có các phản ứng.
Câu 13:
Khi thủy phân không hoàn toàn pentapeptit Ala - Gly - Val - Gly - Ala được tối đa bao nhiêu tripeptit khác nhau?
 Xem đáp án
Xem đáp án
Đáp án B
Các tripeptit thu được là Ala - Gly - Val; Gly - Val - Gly; Val - Gly - Ala
Câu 14:
Số hidrocacbon thơm có cùng công thức phân tử C8H10 bằng
 Xem đáp án
Xem đáp án
Đáp án C
etylbenzen (1 đồng phân)
xylen (3 đồng phân, )
Câu 16:
Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án A
Fructozo trong môi trường kiềm sẽ chuyển thành dạng Glucozo, trong khi dung dịch AgNO3/NH3 tạo ra môi trường kiềm nhờ cân bằng
Câu 17:
Nước thải công nghiệp thường chứa con ion kim loại nặng như Hg2+, Pb2+, Fe3+,... Để xử lí sơ bộ nước thải trên, làm giảm nồng độ các ion kim loại nặng với chi phí thấp, người ta sử dụng chất nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Hầu hết các hidroxit của các kim loại nặng đều là hợp chất không tan.
Để xử lý sơ bộ nước thải có chứa các ion kim loại nặng, người ta thường sử dụng nước vôi trong tạo các hidroxit không tan, lọc lấy phần dung dịch.
Câu 18:
Andehit axetic thể hiện tính oxi hóa trong phản ứng nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
Chú ý: Khử - Cho, O - Nhận (chất khử là chất nhường e, chất OXH là chất nhận e)
Ví dụ.
Chú ý ở đấy H2 nhường e (nên đóng vai trò chất khử, như vậy andehit trong trường hợp này đóng vai trò chất OXH).
Câu 19:
Thủy phân hoàn toàn triglixerit X trong dung dịch NaOH, thu được glixerol, natri stearat và natri oleat. Đốt cháy hoàn toàn m gam X thu được H2O và 9,12 mol CO2. Mặt khác, m gam X tác dụng hoàn toàn với H2 dư (xúc tác Ni, nung nóng) thu được chất béo Y. Đem toàn bộ Y tác dụng hoàn toàn với NaOH vừa đủ, rồi thu lấy toàn bộ muối sau phản ứng đốt cháy trong oxi dư thì thu được tối đa a gam H2O. Giá trị của a gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án B
Nhận xét nhanh X tạo bởi các axit có 18C, axit stearic C17H35COOH và axit oleic C17H33COOH, chất béo có dạng chung là trong đó các gốc R đều chứa 17C.
→Phân tử X có nguyên tử C
→Muối
Câu 20:
Xét các phát biểu sau:
(a) Kim loại Na phản ứng mạnh với nước;
(b) Khí N2 tan rất ít trong nước;
(c) Khí NH3 tạo khói trắng khi tiếp xúc với khi HCl;
(d) P trắng phát quang trong bóng tối;
(e) Thành phần chính của phân supephotphat kép là Ca(H2PO4)2 và CaSO4.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
(e) sai. Đó là thành phần chính của phân supephotphat đơn.
Còn phân supephotphat kép có thành phần chính là Ca(H2PO4)2.
Câu 21:
Có các phát biểu sau:
(a) H2NCH2COHNCH2CH2COOH có chứa 1 liên kết peptit trong phân tử;
(b) Etylamin, metylamin ở điều kiện thường đều là chất khí, có mùi khai, độc;
(c) Benzenamin làm xanh quỳ ẩm;
(d) Các peptit, glucozo, saccarozo đều tạo phức với Cu(OH)2;
(e) Thủy phân đến cùng protein đơn giản chỉ thu được các ;
(f) Protein được tạo nên từ các chuỗi peptit kết hợp lại với nhau.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
(a) sai vì chất đó không phải peptit.
(c) sai vì C6H5NH2 tính bazo rất yếu không đủ làm quỳ ẩm đổi màu.
(d) sai vì đipeptit không có khả năng tạo phức với Cu(OH)2.
Câu 22:
Cho chất X (CrO3) tác dụng với lượng dư dung dịch NaOH, thu được hợp chất Y của crom. Đem chất Y cho vào dung dịch H2SO4 loãng, dư, thu được hợp chất Z của crom. Đem chất Z tác dụng dung dịch HCl dư, thu được khí T. Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 23:
Cho các phát biểu sau:
(a) Các kim loại Na, K và Al đều phản ứng mạnh với nước;
(b) Dung dịch muối Fe(NO3)2, tác dụng được với dung dịch HCl;
(c) P cháy trong Cl2 có thể tạo thành PCl3 và PCl5;
(d) Than chì được dùng làm điện cực, chế tạo chất bôi trơn, làm bút chì đen;
(e) Hỗn hợp Al và NaOH (tỉ lệ số mol 1.1) tan hoàn toàn trong nước dư;
(g) Người ta không dùng CO2 để dập tắt đám cháy magie hoặc nhôm.
Số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Số phát biểu đúng là gồm (b), (c), (d), (e) và (g).
(a) sai vì có Al không thỏa mãn.
Câu 24:
Đốt môi sắt chứa kim loại M cháy ngoài không khí rồi đưa vào bình đựng khí CO2 (như hình vẽ). Thấy kim loại M tiếp tục cháy trong bình khí đựng CO2.
Kim loại M là
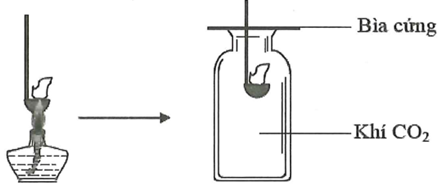
 Xem đáp án
Xem đáp án
Đáp án D
Câu 25:
Cho dãy các chất: NH4Cl, (NH4)2SO4, NaCl, MgCl2, FeCl2, AlCl3. Số chất trong dãy tác dụng với lượng dư dung dịch Ba(OH)2 tạo thành kết tủa là
 Xem đáp án
Xem đáp án
Đáp án D
Câu 26:
Cho 0,1 mol andehit X phản ứng tối đa với 0,3 mol H2, thu được 9 gam ancol Y. Mặt khác 2,1 gam X tác dụng hết với lượng dư dung dịch AgNO3 trong NH3, thu được m gam Ag. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Nhận xét: khi andehit phản ứng với H2 thì có thể xảy ra phản ứng cộng ở gốc hidrocacbon C = C, hoặc nhóm chức -CH = O
Ta có Y là ancol no → Công thức phân tử của Y là C4H10O2.
Mặt khác: vậy X là C4H4O2, là andehit 2 chức, có 1 liên kết C = C trong gốc
CTCT X: (X tráng bạc cho 4 Ag)
Câu 27:
Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2, Ba(AlO2)2, Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau:
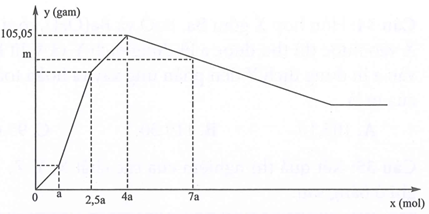
Giá trị m là
 Xem đáp án
Xem đáp án
Đáp án D
Phân tích từng giai đoạn trên đồ thị
Giai đoạn 1:
Trung hòa
Giai đoạn 2:
Tạo đồng thời hai kết tủa BaSO4 và Al(OH)3
Giai đoạn 3:
BaSO4 đã đạt cực đại nên chỉ tạo Al(OH)3 thêm →
Lượng kết tủa cực đại
Giai đoạn 4:
Tại hòa tan thì (vẫn max do không bị hòa tan) và Al(OH)3 tan
còn
Câu 28:
Đốt cháy hoàn toàn một lượng este X (no, đơn chức, mạch hở) thì số mol O2 phản ứng bằng số mol CO2 sinh ra. Mặt khác, cho 6,0 gam X tác dụng vừa đủ với dung dịch KOH, thu được dung dịch chứa m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án C
Este no đơn chức mạch hở → Công thức phân tử là CnH2nO2.
Đốt cháy X:
Vì
→ X là HCOOCH3 (metyl fomat). Ta có
Câu 29:
Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án A
Nhận xét: sinh ra khi cho X tác dụng với H2O < sinh ra khi cho X tác dụng với KOH dư.
→Khi X tác dụng với H2O, Al bị dư.
Đặt số
Phản ứng với H2O thì Al còn dư
→ Bảo toàn e:
Phản ứng với KOH dư → X tan hoàn toàn.
→ Bảo toàn e:
Giải hệ (1) và (2) và
Câu 30:
Cho 6,3 gam hỗn hợp X gồm axit axetic, axit propionic và axit acrylic vừa đủ để làm mất màu hoàn toàn dung dịch chứa 6,4 gam brom. Để trung hoàn toàn 3,15 gam hỗn hợp X cần 90 ml dung dịch NaOH 0,5M. Thành phần phần trăm khối lương của axit axetic trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án C
Trong đó 6,3(g)
Đổi dữ kiện: Trung hòa 3,15g X cần 0,045 mol NaOH
→ Trung hòa 6,3g X cần
Giải (1) và (2)
Câu 31:
Cho 7,35 gam axit glutamic và 15 gam glyxin vào dung dịch chứa 0,3 mol KOH, thu được dung dịch Y. Cho Y tác dụng hoàn toàn với dụng dịch HCl dư, thu được m gam muối. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án D
Cách 1:
Muối gồm
Cách 2:
BTKL
Câu 32:
Điện phân 200 ml dung dịch CuSO4 1,0 M và NaCl a M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 2A trong thời gian 14475 giây. Dung dịch thu được có khối lượng giảm 14,75 gam so với dung dịch ban đầu.
Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án D
Cu chưa bị điện phân hết và khí thoát ra là Cl2 và có thể có cả O2.
Nếu chỉ có khí Cl2:
Loại
→ có cả O2 thoát ra → mdung dịch giảm (có thể quy đổi thành )
Đặt số (quy đổi Cu, Cl2, O2 thành CuCl2 và CuO cho đơn giản)
BTNT [Cu]: a + b = 0,15 mol
m(dung dịch giảm)
(bảo toàn nguyên tố Cl)
Câu 33:
Cho 0,15 mol bột Cu và 0,3 mol Fe(NO3)2 vào dung dịch chứa 0,5 mol H2SO4 (loãng). Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án B
Có quá trình khử.
Có hết nhận tối đa
Quá trình oxi hóa. và
cho tối đa ne nhận tối đa
Vậy chứng tỏ NO được tính theo số mol e cho
lít
Câu 34:
Hỗn hợp X gồm Ba, BaO và Ba(OH)2 có tỉ lệ số mol tương ứng 1.2.3. Cho m gam X vào nước thì thu được a lít dung dịch Y và V lít khí H2 (đktc). Hấp thụ 8V lít CO2 (đktc) vào a lít dung dịch Y đến phản ứng xảy ra hoàn toàn thì thu được 98,5 gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Đặt và
Công thức tính nhanh:
X là axit → Loại A.
Câu 35:
Kết quả thí nghiệm của các chất X, Y, Z, T (dạng dung dịch) với thuốc thử được ghi ở bảng sau:
| Thuốc thử | Mẫu thử | Hiện tượng |
| Dung dịch NaHCO3 | X | Có bọt khí |
| Dung dịch AgNO3/NH3, t° | X | Kết tủa Ag trắng sáng |
| Y | Kết tủa Ag trắng sáng | |
| Z | Không hiện tượng | |
| Cu(OH)2/OH- | Y | Dung dịch xanh lam |
| Z | Dung dịch xanh lam | |
| T | Dung dịch tím |
Các chất X, Y, Z, T lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
Khí → X là axit → Loại A.
X có phản ứng tráng gương → Loại D.
T có pứ màu biure → T không thể là đipeptit → Loại C.
Câu 36:
Hidrocacbon mạch hở X . Trộn m gam X với 0,52 gam stiren thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được 2,24 lít CO2 (đktc) và 0,9 gam H2O. Mặt khác, toàn bộ lượng Y trên làm mất màu tối đa a gam Br2 trong dung dịch. Giá trị của a là
 Xem đáp án
Xem đáp án
Đáp án D
Đốt 0,78 gam X được 0,06 mol CO2 vào 0,03 mol H2O là
→ X là C4H4:
Vậy
Câu 37:
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp chất rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị m gần nhất với giá trị nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án A
NO là khí hóa nâu trong không khí
0,03 mol H2 + 0,02 mol NO → BTNT[N]:
Do X còn có khả năng nhường e nên O2 ban đầu hết.
SO2 và CO2 để có 2 nguyên tử O nên
BTNT[O]:
Câu 38:
Đốt cháy hỗn hợp gồm 2,6 gam Zn và 2,24 gam Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 1M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 28,345 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là
 Xem đáp án
Xem đáp án
Đáp án C
Hỗn hợp
Khi tác dụng với HCl chỉ có các oxit bị hòa tan
Đặt
Bảo toàn nguyên tố Cl
Bảo toàn e cho toàn bộ quá trình
Giải hệ và
(%V chính là % số mol)
Câu 39:
Hỗn hợp E gồm ba peptit mạch hở. đipeptit X, tripeptit, tetrapeptit Z có tỉ lệ mol tương ứng là 2:1:1. Cho một lượng E phản ứng hoàn toàn với dung dịch NaOH dư, thu được 0,25 mol muối của glyxin, 0,2 mol muối của alanin và 0,1 mol muối của valin. Mặt khác, đốt cháy hoàn toàn m gam E, thu được tổng khối lượng của CO2 và H2O là 39,14 gam. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án A
Đặt ẩn theo dữ kiện
Quy đổi
Đốt E thu được
và
Câu 40:
X, Y là hai axit kế tiếp thuộc cùng dãy đồng đẳng axit fomic; Z là este hai chức tạo bởi X, Y và ancol T. Đốt cháy 25,04 gam hỗn hợp E chứa X, Y, Z, T (đều mạch hở) cần dùng 16,576 lít O2 (đktc) thu dược 14,4 gam nước. Mặt khác, đun nóng 12,52 gam E cần dùng 380 ml dung dịch NaOH 0,5M. Biết rằng ở điều kiện thường, ancol T không tác dụng được với Cu(OH)2. Phần trăm khối lượng của X có trong hỗn hợp E gần nhất với
 Xem đáp án
Xem đáp án
Đáp án D
BTKL khi đốt E
→Nhận xét quan trọng: đốt axit, este luôn có Đốt ancol T sẽ có , Z là este 2 chức tạo bởi axit đơn chức và ancol T (T phải có 2 chức) → ancol T thuộc loại no 2 chức mạch hở.
Cách 1: tư duy cổ điển
Ta có sơ đồ:
Bảo toàn nguyên tố [O]:
Quan hệ đốt cháy:
Số mol NaOH pứ:
+ Giải hệ )1) (2) và (3) ta có: và
Số nguyên tử
→ 2 Axit là HCOOH và CH3COOH (chú ý: ancol T đa chức và không phản ứng với Cu(OH)2 → T có số )
→ Hỗn hợp E gồm:
Số nguyên tử C trong este = số nguyên tử C trong HCOOH, CH3COOH và ancol T
→
[Với ].
Ancol T không hoàn toàn Cu(OH)2 → T là với x = 3
Cách 2: tư duy quy đổi
Đổi dữ kiện để đồng nhất
→ Đốt
→ Đốt 12,52g E cần
Quy đổi E
Biện luận: các axit kế tiếp nhau, ancol đa chức + không phản ứng với Cu(OH)2 nên tối thiểu 3C nên tư duy: lắp 0,5 mol CH2 cho ancol T, lắp 0,5 mol CH2 cho axit Y.
→ Thực tế trong E
